鱼类神经坏死病毒纳米探针的制备与特征分析
2015-12-16粟子丹史成银刘江春王胜强
粟子丹,史成银,刘江春,王胜强
(1.农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所,山东青岛 266071;2.上海海洋大学水产与生命学院,上海 201306;3.莱州明波水产有限公司,山东莱州 261418)
鱼类神经坏死病毒纳米探针的制备与特征分析
粟子丹1,2,史成银1,刘江春3,王胜强1,2
(1.农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所,山东青岛 266071;2.上海海洋大学水产与生命学院,上海 201306;3.莱州明波水产有限公司,山东莱州 261418)
为了快速检测鱼类神经坏死病毒,本研究设计了病毒特异性的发夹型探针,经硫醇修饰后与纳米银溶胶结合,制备了鱼类神经坏死病毒纳米探针(Ag-NNV),并使用透射电镜、多功能酶标仪、表面增强拉曼光谱仪等对纳米探针Ag-NNV的表征及发夹型探针在纳米银粒子表面的覆盖率进行了测定和分析。结果表明,裸露的纳米银粒子为球形,平均直径50 nm;制备的纳米探针颗粒为球形,平均直径90 nm。纳米银粒子和纳米探针在溶液中均具有良好的分散性。平均每个纳米银粒子表面结合发夹型探针约100条,单位表面积的探针覆盖量为0.56 pmol/cm2。该纳米探针制备简便,适合用于表面增强拉曼散射法对鱼类神经坏死病毒进行快速检测。
纳米探针;神经坏死病毒;表面增强拉曼散射
鱼类神经坏死病毒(nervous necrosis virus,NNV)是单链RNA病毒,属于野田村病毒科(Nodaviridae)乙型野田村病毒属(Betanodavirus)。该病毒是鱼类病毒性神经坏死病的病原,能够引起鱼苗的大量死亡[1]。其分布范围广泛,在亚洲、欧洲、澳洲、北美洲等地都有该病毒流行的报道。检测鱼类神经坏死病毒已有酶联反应吸附实验法、荧光抗体法、RT-PCR法等[2],但这些方法样品制备复杂、检测时间长,不适合于该病毒的快速现场检测。
近年来,一种无须样品制备,可实时、原位、快速检测病原微生物和生物大分子的表面增强拉曼散射(surface-enhanced Raman scattering,SERS)技术,在疾病诊断和生物分析领域获得越来越多的应用。其中基于纳米银颗粒的SERS纳
米探针技术已被成功用于基因检测的研究[3]和人类病毒感染的检测[4],其检测极限能达到0.5 fM的DNA模板[5]。但是还没有此技术用于动物及水产病原检测的报道。
本研究制备了纳米银溶胶,将其与硫醇修饰的病毒特异性的发夹型探针偶联,制作成可用于检测鱼类神经坏死病毒的SERS纳米探针,并对其表征进行了测量分析,为建立鱼类神经坏死病毒的SERS快速检测法打下了基础。
1 材料与方法
1.1 主要试剂及仪器设备
盐酸羟胺、硝酸银购自美国Sigma公司,6-巯基-1-己醇购自百灵威科技有限公司,氯化镁、氢氧化钠、氯化钠购自上海国药集团,Tris-HCl(pH 8.0)购自北京索莱宝公司。主要仪器为Thermo Scientific公司的全波长多功能酶标仪,德国IKA公司的C -MAGHS4磁力搅拌器和英国Renishaw公司的激光共聚焦拉曼光谱仪。
1.2 实验方法
1.2.1 神经坏死病毒特异性的发夹型探针设计。选择鱼类神经坏死病毒RNA2基因序列(Genbank登录号为KJ541748.2)的特异性区段,使用软件Beacon Designer 7.9设计发夹型探针,在探针的5'端用巯基进行修饰,在探针的3'端用Cy3标记。探针序列为:5'-dithiol-A(5)CGCATCGTAGTCAATGGACAGCGGACGGATGCG-Cy3-3'。下划线部分是探针的臂端,中间部分为鱼类神经坏死病毒的特异性序列,构成探针的环区。探针由大连宝生物公司合成。
1.2.2 纳米银溶胶的制备与特征分析。纳米银溶胶的制备参考Leopold等人[6]的盐酸羟氨还原法。具体做法是:将10 ml 20 mM的硝酸银溶液迅速倒入90 mL含有1.67 mM的盐酸羟胺和3.3 mM 氢氧化钠的混合液中,同时磁力搅拌。制得的纳米银溶胶的光学特征采用全波长多功能酶标仪扫描300~700 nm的紫外-可见光吸收光谱。其结构和表面形貌特征用透射电子显微镜观察,并测量纳米银颗粒的平均直径。
1.2.3 纳米银溶胶的稳定性分析。将制得的纳米银溶胶分为两组,一组置于室温下,另一组置于4℃冰箱中,均避光保存。在2个月内持续取样,测量各组溶胶的紫外-可见光吸收光谱和pH值,分析其稳定性。
1.2.4 纳米探针的制备与特征分析。鱼类神经坏死病毒纳米探针(Ag-NNV)的制备参考Wang等人[7]的方法并略有改动。将1 μM巯基化的发夹型探针和1 mM的MgCl2溶液充分混匀,室温避光条件下静置5 h左右。加入等体积的纳米银溶胶,混匀,在摇床上轻微摇晃1 d,加入少量NaCl溶液,使其终浓度为5 mM,静置1 d。重复3次加NaCl溶液的过程。然后加入6-巯基-1-己醇使其终浓度为1 mM,混匀静置10 min,以置换掉非特异结合的发夹型探针。最后13 400 r/m离心15 min,取沉淀用20 mM Tris-HCl(pH 8.0)缓冲液重新悬浮。离心过程重复三次。采用1.2.2的方法分析纳米探针Ag-NNV的特征。
1.2.5 纳米银粒子上NNV发夹型探针的载量测定。使用Demers等人[8]的配体交换法测定纳米银颗粒上NNV发夹型探针的结合量。取制备好的纳米探针Ag-NNV,加入巯基乙醇使其终浓度为1 mM,混匀静置24 h,将结合于纳米银颗粒上的NNV发夹型探针置换出来。然后13 400 r/m离心15 min,取上清液,测量其荧光值。依据Cy3标记的寡核苷酸含量与荧光值的回归方程,计算出结合在纳米银颗粒上的NNV发夹型探针的摩尔数。再用纳米探针Ag-NNV的吸光度和摩尔吸光系数7.1ⅹ108cm-1M-1,计算出纳米探针Ag-NNV中纳米银粒子的摩尔数[9]。依据上述两个数据,最后计算出结合在每个纳米银粒子上的NNV发夹型探针的平均数量。
1.2.6 纳米探针Ag-NNV的拉曼光谱测定。拉曼光谱仪采用532 nm激发波长,氦氖激光器激光输出功率50 mW。纳米探针Ag-NNV溶液放在毛细玻璃管中,40倍的显微镜物镜聚焦到样品溶液中。使用1 800 groove/mm全息光栅,拉曼光谱积分时间为10 s。
2 结果
2.1 纳米银溶胶的表征及稳定性
本研究制备的纳米银溶胶呈褐绿色,pH值在7.0左右。在透射电子显微镜下观察可见:裸露的纳米银颗粒为球形,直径约50 nm(图1a)。300~700 nm紫外-可见光吸收光谱显示,纳米银溶胶在412 nm处有最大吸收峰,最大吸收波长半高宽小于100 nm,表明纳米银溶胶的分散性良好(图2)。
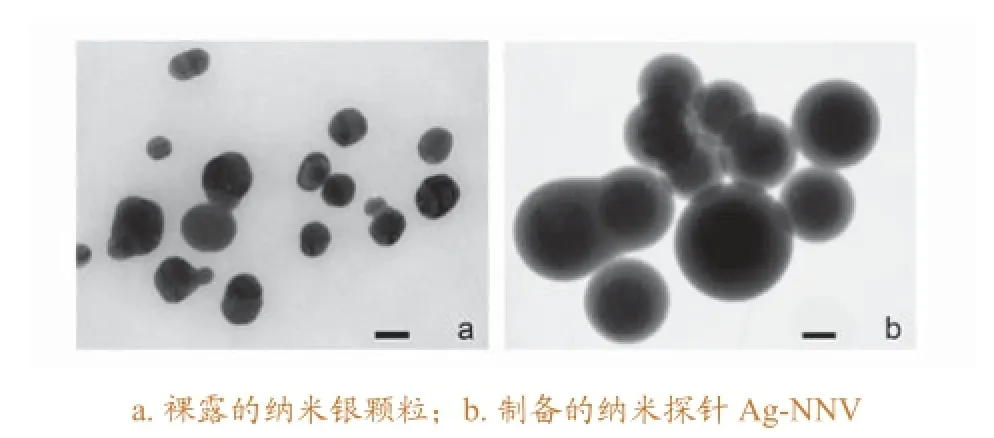
图1 透射电镜下裸露的纳米银颗粒及制备的纳米探针Ag-NNV(标尺 = 50 nm)
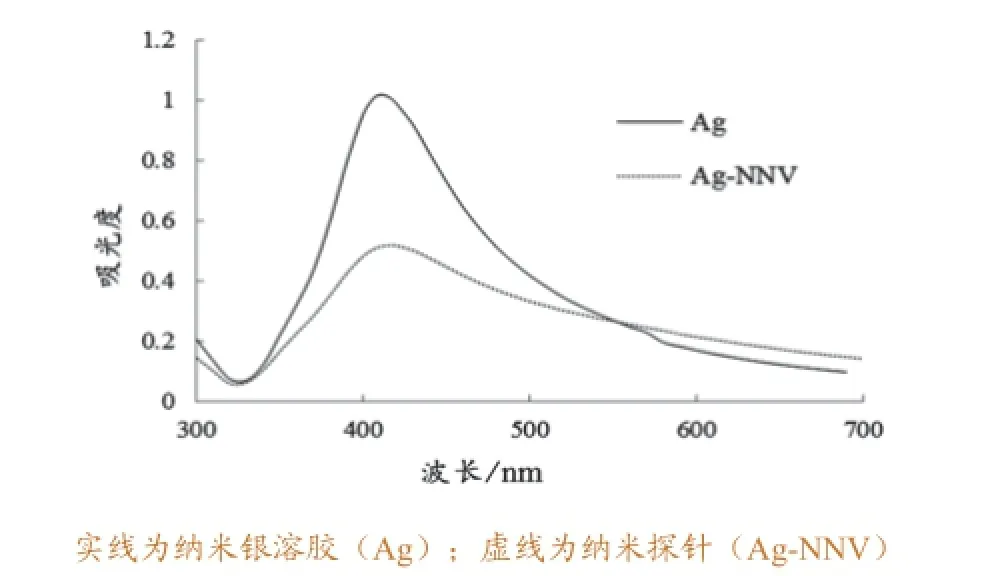
图2 纳米银溶胶及纳米探针Ag-NNV的紫外-可见光吸收光谱
在室温和4℃保存的纳米银溶胶,在两个月内均能保持相对稳定,pH值基本没有变化(图3)。300~700 nm紫外-可见光吸收光谱也一直保持相似的谱型,最大吸收波长保持不变,但最大吸光度随时间的推移而缓慢下降。其中,在刚制备好的一个星期内下降较快,随后的下降比较平缓。与常温保存比较,4℃保存时,纳米银溶胶的最大吸光度下降更加缓慢(图4)。
2.2 纳米探针Ag-NNV的表征分析
将NNV发夹型探针和纳米银溶胶结合孵育后,巯基和纳米银表面形成Ag-S键,制作出了纳米探针Ag-NNV。结合前后溶胶的颜色没有明显变化。电镜观察测量,纳米探针Ag-NNV的平均直径为90 nm,比裸露的纳米银粒子大了约40 nm;纳米探针表面相对比较光滑(图1b)。在300~700 nm紫外-可见光吸收光谱上,纳米探针Ag-NNV的最大吸收波长为416 nm,最大吸收波长半高宽小于100 nm。与结合发夹型探针前的纳米银溶胶相比,其最大吸收波长向右漂移4 nm(图2),表明NNV发夹型探针已经结合到了纳米银粒子上。
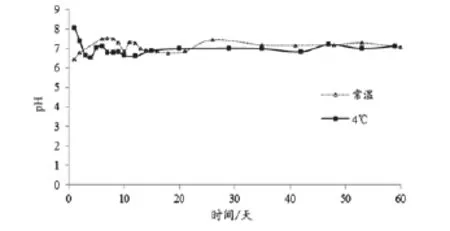
图3 制备后2个月内纳米银溶胶pH值的变动情况
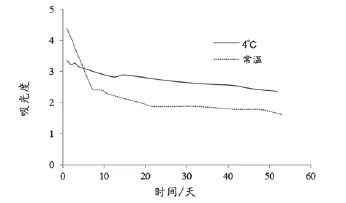
图4 制备后2个月内纳米银溶胶最大吸光度的变动情况
2.3 纳米银粒子表面NNV发夹型探针的载量
建立的Cy3标记的寡核苷酸浓度与荧光值的回归方程为y=248.58x+0.14(R²= 0.992 1),其中y代表荧光值,x代表寡核苷酸浓度(μM)。通过全波长多功能酶标仪测得上清中荧光含量为45.92,由此计算出纳米银粒子表面结合的NNV发夹型探针的摩尔浓度为0.184 1 μM。根据纳米银粒子的摩尔浓度0.001 85 μM及其平均直径50 nm,可计算出平均每个纳米银粒子表面结合发夹型探针约100条,纳米银粒子单位表面积的探针覆盖量为0.56 pmol/cm2。
2.4 纳米探针Ag-NNV的拉曼光谱
根据测定,纳米探针Ag-NNV的拉曼光谱特征峰主要有:729 cm-1、949 cm-1、1096 cm-1、1281 cm-1、1377 cm-1、1 067cm-1,其中1 096 cm-1是嘌呤A的特征峰(图5)。
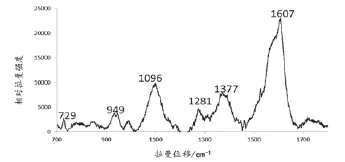
图5 纳米探针Ag-NNV的拉曼光谱图
3 讨论
试验表明,纳米银溶胶在4℃和常温下都能保持较长时间的稳定,可用于制备纳米探针。其中纳米银溶胶在4℃的稳定性要强于在常温的稳定性,建议银溶胶避光保存在4℃的条件。与文献中提及的保存条件一致[4,10]。与结合NNV发夹型探针前的纳米银溶胶相比,纳米探针Ag-NNV的最大吸光度下降了0.5 左右,说明在制备纳米探针的过程中纳米银粒子有损失,原因可能是离心过程中离心管表面吸附了一些纳米银粒子,需要在操作中尽量克服。
本研究制备的纳米探针,平均每个纳米银粒子表面结合发夹型探针约100条,比Wang等人[4]报道的发夹型探针结合数量(90条)稍多,更适合用于表面增强拉曼光谱检测探针信号。有研究表明[11],在一定范围内,增加寡核苷酸探针的使用量,可以增加纳米银粒子表面结合的探针数量。
本实验成功制备出纳米探针Ag-NNV,对其表征测量分析表明,该纳米探针生物学性能良好,可用于SERS法检测鱼类神经坏死病毒。本研究为应用纳米探针技术检测水生动物病原做了有益的探索,基于纳米探针的检测技术有望成为一种快速检测水产病原微生物的方法。
[1] Munday B L,Kwang J,Moody N. Betanodavirus infections of teleost fish:a review[J]. Journal of Fish Diseases,2002,25(3):127-142.
[2] Shetty M,Maiti B,Santhosh K S,et al. Betanodavirus of marine and freshwater fish:distribution,genomic organization,diagnosis and control measures[J]. Indian Journal of Virology,2012,23(2):114-123.
[3] Mckenzie F,Graham D. Controlled assembly of SERRS active oligonucleotide–nanoparticle conjugates[J]. Chem. Commun.,2009(38):5757-5759.
[4] Wang H,Fales A M,Zaas A K,et al. Surface-enhanced Raman scattering molecular sentinel nanoprobes for viral infection diagnostics[J]. Analytica Chimica Acta,2013,786:153-158.
[5] Faulds K,Smith W E,Graham D. Evaluation of surfaceenhanced resonance Raman scattering for quantitative DNA analysis[J]. Anal Chem,2004,76(2):412-417.
[6] Leopold N,Lendl B. A New Method for Fast Preparation of Highly Surface-Enhanced Raman Scattering(SERS)Active Silver Colloids at Room Temperature by Reduction of Silver Nitrate with Hydroxylamine Hydrochloride[J]. The Journal of Physical Chemistry B,2003,107(24):5723-5727.
[7] Wang H,Vo-Dinh T. Multiplex detection of breast cancer biomarkers using plasmonic molecular sentinel nanoprobes[J]. Nanotechnology,2009,20(6):65101.
[8] Demers L M,Mirkin C A,Mucic R C,et al. A fluorescence-based method for determining the surface coverage and hybridization efficiency of thiol-capped oligonucleotides bound to gold thin films and nanoparticles[J]. Anal Chem,2000,72(22):5535-5541.
[9] Lee J S,Lytton-Jean A K,Hurst S J,et al. Silver nanoparticle-oligonucleotide conjugates based on DNA with triple cyclic disulfide moieties[J]. Nano Lett,2007,7(7):2112-2115.
[10] 杨生春,唐春,董守安,等. 基于纳米Ag粒子的表面等离子体共振光谱测定CN-的研究[J]. 分析试验室,2005(1):55-58.
[11] Vidal Jr B C,Deivaraj T C,Yang J,et al. Stability and hybridization-driven aggregation of silver nanoparticle–oligonucleotide conjugates[J]. New Journal of Chemistry,2005,29(6):812.
Production and Characterization of Silver Nanoprobe for Detection of Fish Nervous Necrosis Virus
Su Zidan1,2,Shi Chengyin1,Liu Jiangchun3,Wang Shengqiang1,2
(1. Key Laboratory of Sustainable Development of Marine Fisheries,Ministry of Agriculture,Yellow Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Qingdao,Shandong 266071;2. College of Fisheries and Life Science,
Shanghai Ocean University,Shanghai 201306;3. Laizhou Mingbo Aquatic Company Ltd.,Laizhou,Shandong 261418)
A nanoprobe(Ag-NNV)was prepared and characterized for detecting fish nervous necrosis virus. The morphology and spectroscopic properties of Ag-NNV nanoprobe were evaluated by transmission electron microscopy,automatic microplate reader and surface-enhanced Raman microscope. The results showed that the Ag-NNV nanoprobe was sphere-shaped with average diameter of 90 nm and dispersed well in the solution. The number of hairpin probe attached on a silver nanoparticle was estimated to be about 100 and the coverage density was 0.56pmol/cm2. With easy preparation,the Ag-NNV nanoprobe can be used for quick detection of fish nervous necrosis virus by surface enhanced Raman scattering.
nanoprobe;nervous necrosis virus;surface-enhanced Raman scattering(SERS)
S941
A
1005-944X(2015)06-0075-04
国家科技支撑计划课题(2012BAD17B01)
史成银
