应用荧光定量RT-PCR检测J亚群禽白血病病毒
2015-12-16屈素洁邹联斌陈芳芳张步娴莫胜兰施开创尹彦文
屈素洁,邹联斌,陈芳芳,张步娴,胡 杰,莫胜兰,施开创,李 军,尹彦文
(广西壮族自治区动物疫病预防控制中心,广西南宁 530001)
应用荧光定量RT-PCR检测J亚群禽白血病病毒
屈素洁,邹联斌,陈芳芳,张步娴,胡 杰,莫胜兰,施开创,李 军,尹彦文
(广西壮族自治区动物疫病预防控制中心,广西南宁 530001)
针对J亚群禽白血病病毒(ALV-J)基因序列保守区域设计一对特异性引物和一条特异性探针,通过构建重组阳性标准质粒作为阳性标准品,建立了检测ALV-J核酸的荧光定量PCR方法。优化反应体系和条件后进行特异性、敏感性、重复性试验。结果显示,该检测方法特异性强,与其它禽源病毒如A亚群禽白血病病毒(ALV-A)、B亚群禽白血病病毒(ALV-B)、新城疫病毒( NDV)、禽流感病毒(AIV)、鸡传染性贫血病毒(CIAV)和马立克病病毒(MDV)均不发生交叉反应;该方法可检测到3.2×102拷贝/μL的病毒核酸,与常规RT-PCR相比,敏感性高100倍;重复性试验的变异系数小于2%。研究结果表明,建立的Real-time RT-PCR 检测方法特异性强、灵敏度高、可重复性好,可用于ALV-J的定量检测。
J亚群禽白血病病毒;Taqman 探针;荧光定量PCR
禽白血病(avian leukosis,AL)是由禽白血病病毒(ALV)和禽肉瘤病病毒群病毒引起的禽类多种肿瘤性疾病的统称[1]。自禽白血病病鸡中分离的有6个亚群,即A、B、C、D、E和J亚群。其中A、B、C、D、J亚群属于外源性禽白血病病毒,具有致瘤性;E 亚群属于内源性禽白血病病毒,没有致瘤性[2-5]。J亚群禽白血病由J亚群禽白血病病毒(avian leukosis virus subgroup J,ALV-J)引起的一类禽类传染性肿瘤疾病。据推测该亚群病毒为内源性ALV与外源性
ALV重组而来[6]。由于诱发肿瘤、患鸡胴体废弃、产蛋性能下降和其他未知的对鸡群生产性能的影响,ALV-J给养禽业带来巨大经济损失和严重威胁[7]。目前,尚无针对J亚群禽白血病的有效治疗方法和疫苗,只能通过特异性诊断并淘汰阳性鸡以及采取种群净化措施来控制该病[8-9]。
目前常用的ALV-J检测方法有病毒分离与鉴定、血清学试验和分子生物学试验等,这些方法在敏感性、特异性、时效性等方面均存在不足[10]。实时荧光定量RT-PCR(real-time RT-PCR)是近年来发展起来的一种新型PCR技术,既能定性检测,也能定量检测,且所需时间较短、敏感性较高,避免了传统的RT-PCR后的检测处理步骤,节省了时间和材料[11],故很快得到了广泛应用。本研究根据ALV-J基因序列保守区域设计特异性引物和探针,旨在建立一种快速、灵敏、特异的ALV-J Real-time RT-PCR检测方法,为ALV-J的快速诊断和定量检测提供技术手段。
1 材料与方法
1.1 材料
J亚群禽白血病病毒(ALV-J)、A亚群禽白血病病毒(ALV-A)、B亚群禽白血病病毒(ALV-B)、新城疫病毒( NDV)、禽流感病毒(AIV)、鸡传染性贫血病毒(CIAV)和马立克病病毒(MDV)均由广西区动物疫病预防控制中心保存。
1.2 主要试剂和仪器
One Step PrimeScript RT-PCR Kit(Perfect Real Time)、胶回收试剂盒、RNA提取试剂盒、PMD 18-T Simple Vector均购自Takara公司;DH5α感受态购自Tiangen;其他试剂均为国产分析纯。荧光定量PCR仪为ABI公司的ABI Step One Plus型。
1.3 引物与TaqMan探针的设计与合成
根据GenBank 收录的ALV-J基因序列保守区域,设计1对特异性引物及相应的Taqman探针,上游引物:5′-GGAAGACCAAAGGCCATAAA -3′-A,下游引物:5′-CATAGCTTGACCCTGGGAAT-3′,探针序列:JOE- CACACACCACCGGGATTCCGBHQ1。扩增片段长度为129bp。将探针的5′端以荧光报告基团JOE标记;3′端以荧光淬灭基团BHQ1标记,引物和探针由大连宝生物工程有限公司合成。
1.4 病毒RNA的提取与cDNA合成
参照RNA提取试剂盒说明书提取鸡胚尿囊液中的RNA。
1.5 阳性标准模板的制备
将获得的RNA进行PCR扩增,PCR反应体系如下:上、下游引物各5 pmol,dNTPs 5 nmol,10×Buffer 2μL,cDNA 2 μL,Taq DNA聚合酶0.5 U,加ddH2O至20 μL。PCR 反应条件为:95℃ 5 min;94℃ 30 s,54℃ 30 s,72℃ 30 s,30 个循环;72℃ 10 min。PCR 产物经琼脂糖凝胶电泳鉴定,回收目的DNA片段,将目的片段与pMD18-T载体16℃连接过夜,转化DH5α感受态细胞,质粒经PCR鉴定阳性命名为ALV-P,用核酸蛋白分析仪测定阳性质粒浓度,并换算成拷贝数。
1.6 荧光定量RT-PCR方法的建立
1.6.1 荧光定量RT-PCR反应体系与反应条件的优化
参考One Step PrimeScript RT-PCR Kit推荐的反应体系和条件,在相同浓度模板和反应体系中,采用矩阵法确定引物和探针的最佳浓度。在以上参数优化的基础上,进行荧光定量RT-PCR循环参数的优化,整个优化过程综合考虑Ct值、荧光强度、重复性等,确定反应条件。
1.6.2 标准曲线的建立
将阳性质粒标准品进行10倍梯度稀释,取浓度为3.2×101~3.2×107拷贝/μL的标准品作为模板,根据优化后的体系和条件进行Real-time RTPCR反应,建立标准曲线,并得出反应的扩增效率和曲线的相关性系数。
1.6.3 敏感性试验
取浓度为3.2×101~3.2×107拷贝/μL的标准品作为模板,根据优化后的体系和条件进行Realtime RT-PCR反应,同时以常规RT-PCR作为参比方法,检测其灵敏度。
1.6.4 特异性试验
对A亚群禽白血病病毒、B亚群禽白血病病毒、新城疫病毒、禽流感病毒、鸡传染性贫血病毒和马立克病病毒分别取等量样品提取病毒RNA(或DNA),采用所建立的ALV-J Real-time RT-PCR 方法进行检测。
1.6.5 重复性试验
取5个10倍梯度稀释的标准品,按所建立的Real-time RT-PCR方法分别进行批内、批间检测的可重复性试验。批内试验检测,每个浓度设3个重复;批间试验进行3次独立检测,每次间隔10天,计算Ct值的平均值和变异系数(CV)。
1.7 临床样品检测
对广西区动物疫病预防控制中心收集、保存的221份历年鸡肺、气管、脾脏等组织进行检测。将提取出的病毒核酸分别进行ALV-J实时荧光RTPCR检测和常规RT-PCR检测,以评价其临床实用性。
2 结果
2.1 质粒浓度的计算
测得阳性质粒的OD260/OD280=1.74,计算出质粒浓度为0.185μg/μL,其拷贝数为3.2×108拷贝/μL。
2.2 荧光定量RT-PCR方法的建立
2.2.1 荧光定量RT-PCR反应体系与反应条件的建立
经反应体系与反应条件的优化,确定了最终反应体系与反应条件。反应体系为20μL:2×One Step RT-PCR Buffer Ш 10μL,Takara Ex Taq HS 0.4μL,PrimeScript RT Enzyme Mix Ⅱ 0.4μL,Rox Reference Dye Ⅱ(50×)0.4μL,上下游引物、探针各0.8μL,模板RNA 3μL,双蒸水加至20μL。反应条件:反转录42℃/5 min;预变性92℃/10s;92℃/3s,55℃/30s(收集荧光)40个循环。
2.2.2 荧光定量RT-PCR标准曲线的建立
通过Real-time RT-PCR,得到检测ALV-J的扩增曲线和标准曲线(图1)。ALV-J Real-time RTPCR 标准品具有良好的线性关系( 相关系数R2= 0.999,扩增效率E = 1.07)。
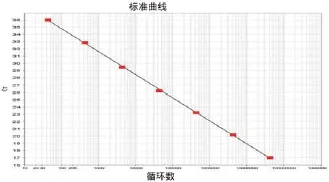
图1 荧光定量RT-PCR检测ALV-J标准曲线
2.2.3 特异性试验结果
特异性试验结果显示,仅ALV-J出现扩增曲线,而ALV-A、ALV-B、NDV、AIV、CIAV、MDV和空白对照均无扩增曲线,说明针对ALV-J设计的检测引物和探针特异性好。
2.2.4 荧光定量PCR的敏感性
经过检测,确定Real-time RT-PCR 检出的最低限为3.2×102拷贝/μL(图2),常规PCR 的检测极限为3.2×104拷贝/μL(图3)。Real-time RT- PCR与常规RT-PCR相比,敏感性高100倍。

图2 real-time RT-PCR 敏感性试验
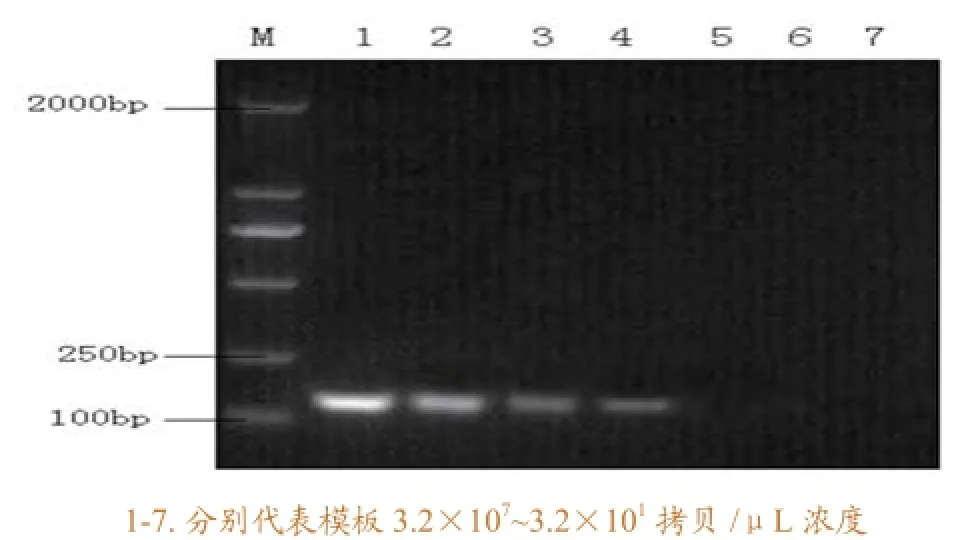
图3 常规RT-PCR的灵敏度检测
2.2.5 重复性试验结果
取5个10倍梯度稀释的标准品分别做3个组内重复和组间重复试验,结果显示(表1),批内试验变异系数为0.41%~0.79%,批间试验变异系数为0.51%~0.94%,均小于2%,表明所建立的Realtime PCR方法具有良好的可重复性。
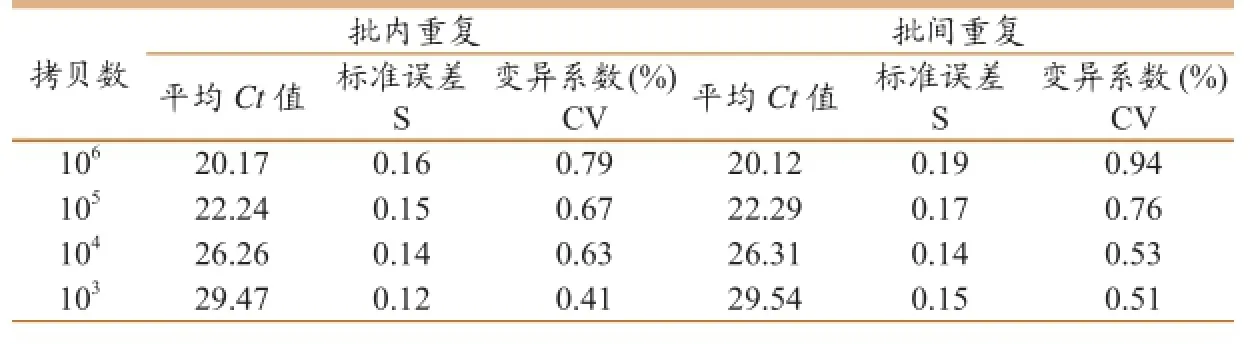
表1 实时荧光RT-PCR的重复性
2.3 临床样品检测
利用建立的荧光定量RT-PCR方法,对保存的广西地区收集的221份病料核酸进行检测,结果显示,检出ALV-J 14份,阳性率为6.33%,检测结果与RT-PCR结果一致。
3 讨论
目前,禽白血病病毒J亚群对世界养禽业造成了极大的危害和损失,但仍没有有效的治疗方法,及时检测、净化种群是控制本病的主要手段。目前主要采用病理组织学、血清学、PCR等方法检测和诊断ALV-J。但是病理组织学法检测操作复杂,费时费力;血清学检测方法易受外界条件干扰;传统的PCR无法进行定量分析,无法确切检测出机体内病毒的增殖状态。Real-time RT-PCR是将普通PCR通过标准曲线对未知模板进行分析,进而实现PCR技术从定性到定量的飞跃。基于TaqMan探针的实时荧光PCR不仅具有快速、灵敏、操作简便等优点,而且由于该法采用引物和探针的“双保险”,因此特异性更强,可避免PCR技术带来的假阳性反应。
本研究建立的实时荧光定量RT-PCR检测ALV-J的方法,特异性好,只从ALV-J阳性病料中检测到特异性的扩增信号,不与检测的其他常见家禽传染病发生特异性反应。试验所建立的标准曲线的相关系数R2=0.999,扩增效率E = 1.07,说明核酸拷贝数的对数值与Ct值之间有极显著的线性关系,优化的体系和条件很好地满足了试验要求。重复性试验得出组内和组间变异系数为0.41%~0.94%,说明此方法具有很好的准确性和重复性,可以稳定地用于ALV-J核酸的定量检测。该试验中建立的曲线可检测到3.2×102拷贝/μL的初始模板量,检测敏感性比常规RT-PCR提高100倍以上。检测量大,一次可以检测96份样品,整个反应都在密闭系统内进行,避免了样品间的污染。检测速度快,从样品处理包括RNA的提取,PCR等到试验结束,只需4个小时,比其他的血清学检测方法节省了时间,准确性高。Taq Man探针只与特异性的模板发生反应,假阳性率低,与SYBR Green I相比,不需要考虑引物二聚体和其他非特异性扩增。
综上所述,本研究建立的J亚群禽白血病病毒实时荧光定量RT-PCR检测方法具有特异性强、灵敏度高、重复性好、能够准确定量等优点,为快速检测病原和定量检测病毒含量提供了必要的技术平台。
[1] Saif Y M . 禽病学[M].苏敬良,高福,索勋,译. 11 版.北京:中国农业出版社,2005.
[2] 李佳桃,崔宝玉,岳华,等.荧光定量 RT-PCR 检测禽白血病病毒方法的建立及应用[J].中国动物检疫,2008 ,25(9):25-28.
[3] Calnek B W. Disease of Poultry [M].Ames,Iowa,USA:Iowa State University Press, 1991:334-380.
[4] 何爱飞,徐春志,雷云华,等. 蛋鸡血管瘤型禽白血病的诊断[J].动物医学进展,2009,30(1):112-115.
[5] 成子强,赵振华,郝永清,等. 禽白血病病毒J亚群(ALV-J)的血清学调查及PCR 诊断[J] .中国病毒学,2002,17(4):324 -329.
[6] Li Y H,Liu X M,Xu C G,et al. Isolation,identification,and phylogenetic analysis of two avian leukosis virus subgroup J strains associated with hemangioma and myeloid leukosis[J].Vet Microbiol,2013,166(3/4):356-364.
[7] Gao Y N,Liu Y Z,Zhu H B,et al. Differential expression of immune-related cytokine genes in response to Jgroup avian leukosis virus infection in vivo[J].Mol Immunol,2013,187(2):278-283.
[8] Saif Y M. Diseases of Poultry[M].12thed. Oxford in England:Blackwell Publishing ,2008:514-568.
[9] 崔治中,郭惠君,孙淑红.鸡白血病的流行现状和防制对策 [C]//.中国畜牧兽医学会2009学术年会论文集(上册).石家庄:中国畜牧兽医学会,2009:268 -275.
[10] 杭柏林,胡建和,李杰,等. J 亚群禽白血病病毒检测方法的研究进展[J].中国农学通报,2011,27(32):21-24.
[11] 袁亚男,刘文忠.实时荧光定量PCR技术的类型、特点与应用[J].中国畜牧兽医,2008,35(3):27-30.
Development and Application of a Real-time RT-PCR Assay for Avian Leukosis Virus Subgroup J
Qu Sujie,Zou Lianbin,Chen Fangfang,Zhang Buxian,Hu Jie,Mo Shenglan,Shi Kaichuang,Li Jun,Yin Yanwen
(Guangxi Center for Animal Disease Control and Prevention,Nanning,Guangxi 53001)
A pair of specific primers and a specific probe was designed according to the ALV-J conserved gene sequence and a plasmid containing the target gene was constructed as a standard control. A real-time PCR assay was developed for detection of ALV-J. After optimization of the reaction conditions,the assay was tested for its specificity,sensitivity and repeatability. Result showed that the assay was highly specific and there were no cross-reactions with other avian pathogens including ALV-A,ALV-B,NDV,AIV,CIAV and MDV. The assay had a detection limit of 3.2×102copies/μL viral RNA,100 times more sensitive than the conventional PCR,and its coefficient of variations was less than 2% in the reproducible test. The results indicated that this real-time RT-PCR assay was of high specificity,sensitivity and reproducibility,and could be used for the quantitative detection of ALV-J.
ALV-J;Taqman probe;Real-time PCR
S8562.65+7
A
1005-944X(2015)06-0056-05
广西区水产畜牧兽医局科技项目(桂渔牧科1204935)
尹彦文
