病毒性出血性败血症病毒液相芯片检测技术的建立
2015-12-16尹伟力梁君妮张四化岳志芹
尹伟力,梁君妮,林 超,张四化,岳志芹,刘 荭
(1. 烟台出入境检验检疫局,山东烟台 264000;2. 山东出入境检验检疫局,山东青岛 266000;3. 深圳出入境检验检疫局,广东深圳 518000;4. 武汉市重大动物疫病防控中心,湖北武汉 430003)
病毒性出血性败血症病毒液相芯片检测技术的建立
尹伟力1,梁君妮1,林 超2,张四化4,岳志芹2,刘 荭3
(1. 烟台出入境检验检疫局,山东烟台 264000;2. 山东出入境检验检疫局,山东青岛 266000;3. 深圳出入境检验检疫局,广东深圳 518000;4. 武汉市重大动物疫病防控中心,湖北武汉 430003)
为建立检测病毒性出血性败血症病毒(VHSV)的液相芯片快速检测技术,用DNAStar软件对Gen-Bank中VHSV的G基因进行序列分析,设计VHSV特异性引物并标记生物素。探针氨基化修饰并与荧光编码微球偶联后与VHSV RT-PCR产物杂交反应,用液相芯片仪器检测荧光信号。结果表明液相芯片检测体系能够正确检出VHSV。病毒核酸的最低检出量为10pg,检测特异性高,说明初步建立了检测VHSV的液相芯片技术,为VHSV的检测提供了新方法。
病毒性出血性败血症病毒(VHS);液相芯片;检测
病毒性出血败血症病毒(viral hemorrhagic septicemia of salmonids virus,VHSV)感染鱼类引起的病毒性出血败血症,又称鳟鱼腹水病、新鳟鱼病等[1]。病原是一种弹状病毒,能引起鱼类急性或慢性内脏性疾病,死亡率非常高[2]。
病毒性出血败血症在欧洲流行已久,法国、意大利、瑞士、挪威、瑞典、波兰等欧洲国家均有正式报导[3]。近年来,该病已蔓延至在北美洲、大洋洲、东南亚等区域[4-5]。
VHSV主要感染鳟鱼及其他鲑科鱼类,对其他养殖类非鲑科鱼苗也有影响[6]。通常当水温降至
10℃左右时,鱼群就会发病[7]。出血性败血症的主要病理变化为组织器官出血、变性、坏死。肝、肾是靶器官,细胞出现空泡化或固缩化[8]。
细胞分离是检测VHSV的“金标准”,但该方法操作复杂、检测周期长[9-10]。因此,建立快速、高通量的检测方法,成为水产养殖业迫切需要解决的问题。液相芯片技术是一种新型快速检测技术,该方法集流式细胞术、纳米荧光微球、荧光信号数字处理和传统化学发光技术为一体[11-15],其优势在于所需样本量少,检测周期短,既可检测核酸也可检测抗体[16]。本试验采用RT-PCR检测方法与液相芯片检测技术结合,建立了VHSV的液相芯片快速检测方法,为VHSV的检测提供了又一种方法。
1 材料与方法
1.1 毒株核酸
病毒性出血性败血症病毒(VHSV)、传染性造血器官坏死病毒(IHNV)、流行性造血器官坏死病毒(EHNV)和传染性胰脏坏死病毒(IPNV)核酸均由深圳出入境检验检疫局友情提供;鲤春病毒株(SVCV)由本实验室保存。
1.2 试剂与设备
表面羧基化的荧光编码微球、鞘液、甲基咪唑(TE)、碳二亚胺购置美国BD公司;TMAC(temtrameihyl-ammdnium chloride)、Tris、SDS(10% solution)、链霉菌抗生物素蛋白-藻红蛋白(SAPE)购自美国Sigma公司;SPAE Streptavidin-R-phycoerythrin购自美国Prozyme公司;RNA提取试剂盒(Takara MiniBEST Viral RNA/DNA Extraction Kit Ver.3.0)、RT-PCR试 剂 盒(RT-PCR Kit II)、DL2000 marker购自大连宝生物公司。
BD FACSArray液相芯片仪(FACSArray美国BD公司);Eppendorf Mastercycler Gradient梯度PCR扩增仪(EP Gradient德国Eppendorf公司);AlphamagerTM2200凝胶成像系统(2200美国AP公司);Eppendorf高速冷冻离心机(5417R 德国Eppendorf公司)等。
1.3 引物探针的设计
通过Internet登陆美国国立生物信息技术中心(NCBI),查询检索已公布的VHSV G基因序列(JF781265.1),利用软件DNA Star 7.0找出两种病毒基因中最为保守的碱基作为液相芯片检测探针。利用Primer Premier5.0软件在探针上、下游设计一对引物。上、下游引物5’端进行生物素标记;探针5’端进行氨基化修饰(表1)。
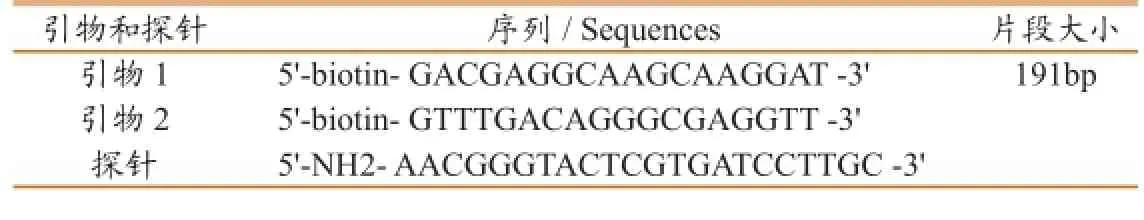
表1 引物及探针序列
1.4 RT-PCR反应体系的建立
采用RNA提取试剂盒(大连宝生物公司)提取VHSV RNA。RT-PCR扩增的反应体系:在0.2mL PCR反应管中,依次加入10×RT-PCR buffer 2.5μL、dNTP(各2.5mmol/L)2.5μL、10pmol/μL F1 0.5μL、10pmol/μL R1 0.5μL、Inhibiter 0.5μL、AMV XL 0.5μL、AMV Taq(5U/μL)0.5μL、25mmol/L MgCl25.0μL、总RNA 3.0μL,加入双蒸水使反应体积达到25μL。以上反应体系中,除了引物、总RNA和双蒸水,其它组分均为RT-PCR试剂盒的组分。
优化并确定RT-PCR扩增的反应程序:50℃30min;94℃ 2min;94℃ 30s、58℃ 30s、72℃30s,30个循环;72℃延伸5min;4℃保温。
扩增产物用2%琼脂糖凝胶电泳,在紫外凝胶图像分析系统上观察、分析扩增产物。
1.5 液相芯片检测体系的建立
1.5.1 寡核苷酸探针与微球共价偶联
①将微球漩涡混合20s充分分散;取3×106个微球(75μL),于1.5mL离心管中10000g离心1min,去上清;
②加入50μL 0.1mol/L甲基咪唑溶液(pH4.5),漩涡混合,超声波处理(30s-1min);
③加入氨基化探针1.0nmol,漩涡混合;
④加入2.5μL碳二亚胺溶液(10mg的碳二亚胺粉末加入1.0mL的灭菌纯水,现用现配)充分混匀,室温避光孵育30min。
⑤重复④一次。
⑥加入1.0mL 0.02% Tween-20,混匀,10000g离心1min,弃上清;
⑦加入1.0mL 0.1% SDS,混匀,10000g离心1min,弃上清;
⑧用0.1mol/L甲基咪唑溶液(pH4.5)100mL重悬微球,2~8℃避光保存,待用。
1.5.2 杂交
杂交体系包括:1.5μL探针偶联微球,33μL 1.5×TMAC 杂交液,14.5μL TE,2.5μL RT-PCR产物,空白孔以5μL TE取代PCR产物。混合均匀后于98℃变性10min,在52℃温度下孵育15min,18000g离心2min 去上清;加入50 μL用1×TMAC 杂交液稀释的SA-PE(1∶500),选定温度下孵育10min,18000g离心2min 去上清;加入50μL 1×TMAC 杂交液,漩涡混合使微球重悬,上机分析。
杂交温度的优化,杂交反应时间在15min条件下,根据探针的Tm值,选48℃、50℃、52℃、54℃、56℃等5个温度梯度为研究对象,考察不同杂交温度下液相芯片的检测效果。
1.6 液相芯片检测体系重复性验证
将VHSV的RT-PCR产物用于液相芯片检测试验,做3个重复,计算变异系数。
1.7 液相芯片检测体系特异性验证
将IPNV、SVCV、IHNV、EHNV、VHSV的RT-PCR产物或PCR产物,用液相芯片检测体系进行检测。判断整个液相芯片检测体系对非目标物有无检测信号。
1.8 液相芯片检测体系灵敏度验证
将VHSV病毒核酸进行10倍系列稀释,得到10-8、10-7、10-6、10-5、10-4、10-3、10-2、10-1等 不同稀释度的稀释液,用已经建立的液相芯片检测体系进行检测,用于考察整个检测体系的灵敏度。
1.9 样本检测
用建立的方法对32份实验室保存的样品进行检测,与世界动物卫生组织《水生动物疫病诊断手册》推荐的PCR法[17]对比,评价其准确性。
2 结果
2.1 PCR体系的建立
将VHSV RNA作为模板进行PCR扩增,产物经2%琼脂糖凝胶电流分析,结果显示扩增出大小为191bp左右的目的条带,与预期扩增的片段大小一致(图1)。

图1 VHSV RT-PCR电泳结果
2.2 液相芯片检测体系的建立
2.2.1 杂交温度优化
参与计数的荧光编码和微球均在100个以上(图2a),表明用于计算的荧光编码微球数量有效,所产生的荧光强度中位值(MFI)可信,3个荧光编码微球的空白对照MFI值均小于500,试验可进行结果判断。试验结果表明48℃~56℃之间,荧光变动幅度都不大,显示52℃杂交良好,高于54℃时,检测荧光下降剧烈,因此最佳杂交温度选为52℃。
2.2.2 液体芯片检测体系确立
液相芯片定性比值结果(LQRR)等于样品校正后的MFI值(MFIS)与空白对照MFI平均值(MFIB)的比值,即LQRR=MFIS/MFIB。如果LQRR≥3,判定为阳性样本;如果2≤LQRR<3,则判定为可疑;如果LQRR<2,则判定为阴性。参与计数的荧光编码微球均≥100个,表明用于计数的荧光编码微球数量有效,所产生的MFI值可信,各个荧光编码微球的空白对照MFI均<500,表明结果有效,试验可以进行结果判定。
从图2b、c、d看出,偶联微球的探针与
VHSV RT-PCR产物在Red-A、Yellow-A检测通道下均有荧光信号,表明VHSV液相芯片构建成功。
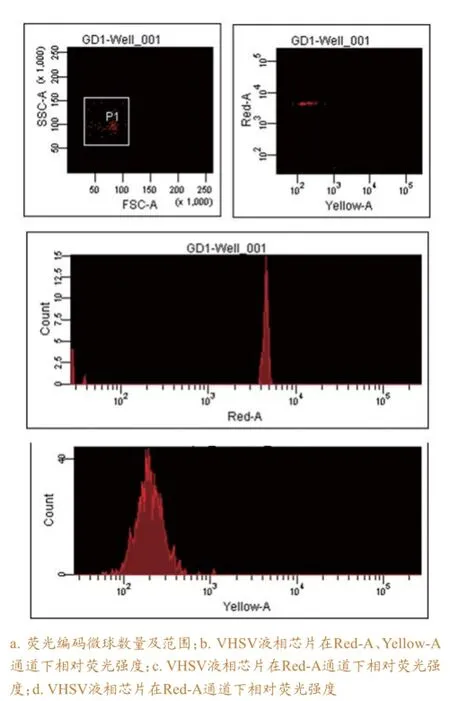
图2 VHSV液相芯片检测结果
2.3 液相芯片检测体系的重复性验证
将提取的VHSV RNA进行RT-PCR扩增,然后在完全相同的条件下,用所建立的液相芯片体系进行三次检测,用以验证该方法的重复性和稳定性,计算各批次间检测的平均荧光强度值的变异系数,结果显示变异系数在5.3%以内,表明该方法具有良好的可重复性。
2.4 液相芯片检测体系的特异性验证
分别以VHSV、SVCV、IHNV、EHNV和IPNV的RT-PCR产物或PCR产物模板,进行液相芯片检测。结果(表2)表明,对目标病毒的检测结果均为阳性,而对非目标病毒的扩增产物的检测值均为阴性,表明所建立的方法具有很好的特异性。
2.5 液相芯片检测体系的灵敏性验证
将VHSV核酸进行10倍系列稀释,得到10-8、10-7、10-6、10-5、10-4、10-3、10-2、10-1等 不同稀释度的稀释液,用已经建立的液相芯片检测体系进行检测,灵敏度检测结果如表3所示,检测VHSV 最低限量为10pg。液相芯片法比PCR要灵敏。
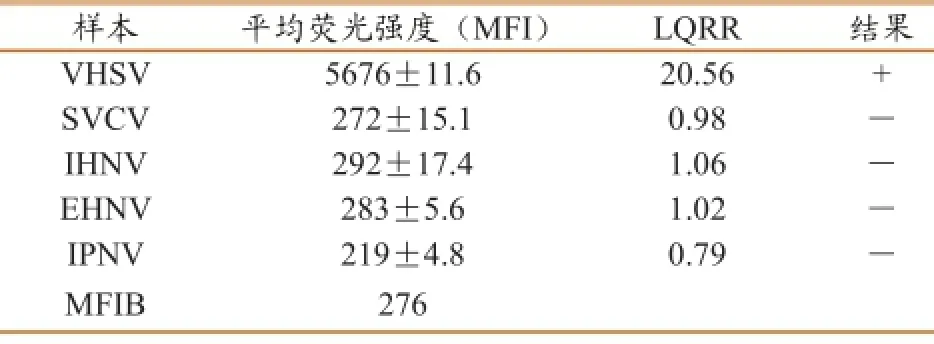
表2 液相芯片检测体系特异性验证
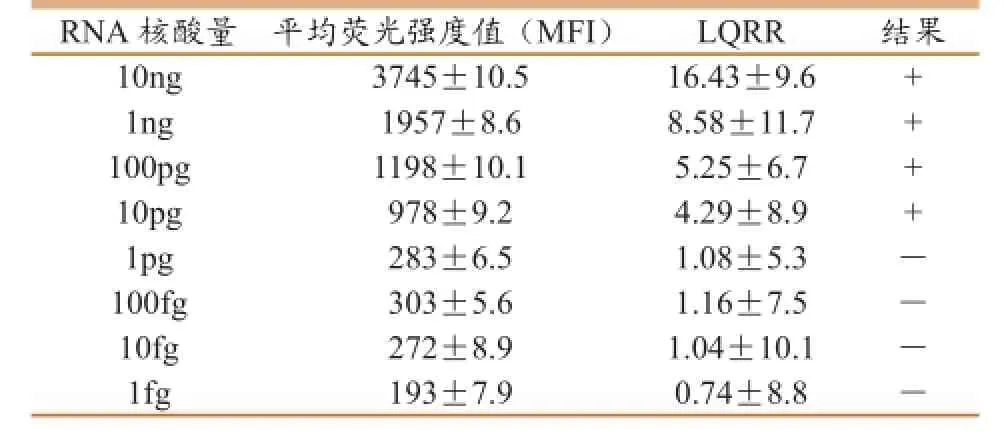
表3 液相芯片检测体系灵敏度验证
2.6 样本检测
对32份实验室保存的样品检测结果(表4)显示,4份样品为阳性,包括2份烟台鲈鱼、1份荣成黄颡鱼及1份上海鲈鱼。该法与OIE推荐的PCR方法检测结果基本一致,但PCR检测结果中有1份阳性样品电泳谱带较弱,较难辩别。
3 讨论
本研究首次在国内外建立了病毒性出血性败血症病毒的液相芯片快速检测技术,可应用于本病的快速检测及流行病学调查等工作。
与传统检测方法相比,液相芯片技术集合了多种核酸扩增、液相微球杂交、激光等多种检测技术,具有快速、简便、高通量等优点[18]。杂交与检测过程中无需繁琐的洗涤步骤,且整个反应都在同一密闭反应管中进行,避免了开盖的交叉污染。与固相芯片相比,由于采用了流式悬浮微球杂交技术,其反应更为高效,操作也更为灵活。与常规PCR方法相比,由于液相芯片检测体系通过激光检测核酸杂交微球的集合体,有效避免了多种核酸扩增产
物的相互干扰,提高了灵敏度。
液相芯片检测的技术关键是设计多重扩增引物与探针[19]。本研究通过比对不同VHSV毒株的基因组序列,初步筛选多种引物,通过反复优化,选定适合检测VHSV的引物。在优化探针实验中发现,G、C碱基含量应该在40%~60%,过少不易与PCR产物杂交,过多则会出现特异性杂交。探针内部的互补序列如果超过4个碱基则会出现发夹结构。此外,探针的每个碱基必须与扩增产物一一配对,因此,在设计探针时应选择了VHSV高度保守的序列。
在方法建立过程中,本研究对杂交温度选择、碳二亚胺溶液浓度的最适浓度、探针与微球偶联次数等进行了探索。通过多次实验,发现杂交温度的主要根据探针Tm值而确定,一般选择Tm值上下各6℃范围进行摸索。碳二亚胺溶液最合适浓度为10mg/mL,低于此浓度会影响偶联。探针与微球偶联次数在2~3次较为合适,如果偶联不成功可以增加次数,但不要超过5次,否则本底值过高,会影响结果。同时研究表明,在分析结果时,首先要圈定微球范围(如图2a),尽量圈定微球集中地区域,分散于其他位置的微球可以忽略不计,否则会造成结果的偏差。
由本实验中对32样品临床检测结果可知,液相芯片检测结果与传统PCR方法基本一直,但PCR检测结果中有1份样品电泳带较弱,肉眼较难辩别,而液相芯片检测结果为阳性,说明灵敏度比传统PCR方法高。所建立的液相芯片检测体检测VHSV最低限量为10pg。
本方法能够对病毒性出血性败血症病毒进行快速检测,从样品处理到出结果仅需2.5小时左右。由于采用了接近生物反应体系的液相芯片系统和特异性的探针,使该方法的特异性高于传统检测方法,大大杜绝了非特异性扩增造成的假阴性结果。采用了液相反应体系,使该方法灵敏度高于PCR,避免了PCR检测中溴化乙锭对人员和环境的污染,非常适合对进出境水生动物进行高通量检测。
[1] 陈爱平,江育林,钱冬,等.病毒性出血性败血病[J].中国水产,2011(2):57-58.
[2] 安元龙,吴斌,林长军.荧光环介导逆转录等温扩增(RTLAMP)技术在病毒性出血性败血症(VHS)诊断中的应用[J].中国动物检疫,2012,29(12):21-26.
[3] Garver KA,Traxler GS,Hawley LM,et al. Molecular epidemiology of viral haemorrhagic septicaemia virus(VHSV)in British Columbia,Canada,reveals transmission from wild to farmed fish[J]. Dis Aquat Organ,2013,104(2):93-104.
[4] Verrier ER,Ehanno A,Biacchesi S,et al. Lack of correlation between the resistances to two rhabdovirus infections in rainbow trout[J].Fish Shellfish Immunol,2013,35(1):9-17.
[5] Pham PH,Lumsden JS,Tafalla C,et al. Differential effects of viral hemorrhagic septicaemia virus(VHSV)genotypes IVa and IVb on gill epithelial and spleen macrophage cell lines from rainbow trout(Oncorhynchus mykiss)[J]. Fish Shellfish Immunol,2013,34(2):632-640.
[6] 翁善钢.病毒性出血性败血症的流行与诊断[J].水产养殖,2014,35(2):49-50.
[7] 倪穗,余晓巍,王建平,等.应用巢式逆转录聚合酶链反应检测鱼类病毒性出血性败血症病毒(VHSV)[J].海洋与湖沼,2009,40(4):489-493.
[8] 安元龙,吴斌,林长军,等.荧光环介导逆转录等温扩增(RT-LAMP)技术在病毒性出血性败血症(VHS)诊断中的应用[J].中国动物检疫,2012,29(12):23-25.
[9] 陈进会,陈文,黄伟,等.病毒性出血性败血症病毒(VHSV)实时荧光环介导等温扩增检测方法的建立[J].中国动物检疫,2013,30(5):42-45,46.
[10] 许建明,张念之,蒋一男,等.Taqman MGB探针快速定量检测VHSV方法的研究[J].高技术通讯,2010,20(2):208-213.
[11] Hulse R E,Kunkler P E,Fedynyshyn J P,et al. Optimization of multiplexed bead-based cytokine immunoassays for rat serum and brain tissue[J]. Neurosci Methods,2004,136(1):87-98.
[12] Maskos U,Southern E M. A study of oligonucleotide reassociation using large arrays of oligonucleotides synthesised on a glass support. [J]. Nucleic Acids Res,1993,21(20):4663-4669.
[13] Peterson A W,Wolf L K,Georgiadis R M. Hybridization of mismatched or partially matched DNA at surfaces[J]. J Am Chem Soc,2002,124(49):14601-14607.
[14] Gotoh M,Hasegawa Y,Shinohara Y,et al. A new approach to determine the effect of mismatches on kinetic parameters in DNA hybridization using an optical biosensor[J]. DNA Res,1995,2(6):285-293.
[15] Alam M. Diagnostic limitations to accurate diagnosis of cholera.[J].Clin Microbiol,2010,48(11):3918 –3922.
[16] Bessede E,Delcamp A,Sifre E. New methods for detection of campylobacters in stool samples in comparison to culture[J]. Clin Microbiol,2011,49(3):941-944.
[17] 世界动物卫生组织.病毒性出血性败血症[M]. 水生动物疾病诊断手册,2012版,2.3.9章,374-396. http://www.oie.int/ international-standard-setting/aquatic-code/access-online/.
[18] Baums IB. Luminex detection of fecal indicators in river samples,marine recreational water and beach sand[J] Mar Pollut Bull 2007,54(5):521-536.
[19] Liu J,Meng C,Zhang SH,et al. Multiplex reverse transcription PCR Luminex assay for detection and quantitation of viral agents of gastroenteritis[J]. Clin Virol,2011,50(4):308-313.
Development of a Liquid Chip Technique for Detection of Viral Hemorrhagic Septicemia of Salmonids Virus(VHSV)
Yin Weili1,Liang Junni1,Lin Chao2,Zhang Sihua4,Yue Zhiqin2,Liu Hong3
(1.Yantai Entry-exit Inspection and Quarantine Bureau,Yantai,Shandong 264000;2. Shandong Entry-exit Inspection and Quarantine Bureau,Qingdao,Shandong 266000;3. Shenzhen Entry-exit Inspection and Quarantine Bureau,Shenzhen,Guangdong 518000;4. Wuhan Center for Major Animal Disease Control and Prevention,Wuhan,Hubei 430003)
In order to develop a liquid chip assay for detection of viral hemorrhagic septicemia of salmonids virus(VHSV),the G gene of VHSV in the GenBank was sequenced by using the software DNAStar 7.0 and specific VHSV primers labeled with biotin were prepared and coupled with fluorescence-coded microspheres. The aminationed probe was used for hybridization of VHSV PCR products,and a liquid chip detection technique for detection of VHSV was established by using BD FACSArray to detect fluorescence signal in the reaction system. The results showed that VHSV could be accurately detected by the developed liquid chip detection technique. The lower detection limit with this method was 10 pg of viral RNA,and the specificity of this method was very high.The study provided a new method for rapid and high throughput detection of VHSV.
viral hemorrhagic septicemia of salmonids virus(VHSV);liquid chip assay;detection
S941.41+3
A
1005-944X(2015)06-0064-05
公益性行业科研专项经费项目201210055-4;科技部十二五支撑项目2013BAD12B02;国家质检总局科技计划项目2012IK018
