金鼓鱼幼鱼对蛋白质的适宜需要量研究
2015-12-15林思源游翠红王树启李远友
林思源, 游翠红, 王树启, 李远友
(汕头大学 海洋生物研究所 广东省海洋生物技术重点实验室, 广东 汕头 515063)
金鼓鱼(Scatophagus argus)又名金钱鱼, 属鲈形目(Perciformes)、鲈亚目(Percoidei)、金钱鱼科(Scatophagidae)、金钱鱼属(Scatophagus), 是一种广盐(0~35‰)、植食性鱼类, 因其体表分布有数十个黑色圆斑, 类似金钱状, 故得名金钱鱼。该鱼主要分布于南海和东海南部, 尤以广东沿海分布最为广泛。因其具有较高的营养与经济价值, 近年来已成为中国南方沿海较受欢迎的养殖品种之一; 同时, 金鼓鱼体态优美, 体色会随着环境的改变而变化, 是著名的观赏鱼类; 因此不少学者认为金鼓鱼是一种非常具有潜力的半咸水养殖鱼类[1]。
目前, 关于广盐、植食性鱼类的营养需求方面的研究资料较少, 主要集中在蓝子鱼科(Siganidae)(与金鼓鱼同属鲈形目)鱼类。王树启等[2]报道黄斑蓝子鱼(Siganus canaliculatus)幼鱼对脂肪及蛋白的适宜需要量分别在 29.01%~34.37%和 6%~9%; 朱卫等[3]报道点蓝子鱼(Siganus guttatus)对脂肪的适宜需要量为 13.94%。为了促进金鼓鱼人工养殖业的发展, 有必要对其营养需求和饲料配方进行研究。蛋白质是鱼类最重要的三大营养素之一, 与鱼类的生长发育、生理功能和鱼肉品质等密切相关, 也是影响鱼类饲料成本的最主要因素[4]。为此, 本研究设计了5种不同蛋白水平的配合饲料, 通过8周饲养试验, 比较不同饲料投喂组鱼的生长性能、饲料利用率、常规生化指标、消化酶活性、免疫与抗氧化指标等, 以确定金鼓鱼幼鱼对蛋白的适宜需要量, 为饲料配方的研发提供参考依据和资料, 丰富植食性海水鱼类的营养学内容。
1 材料与方法
1.1 试验饲料
在参考其他杂食、植食性鱼类营养需求的基础上, 以酪蛋白为蛋白源, 鱼油为脂肪源, 配制脂肪水平为8%、蛋白水平分别为24%、28%、32%、36%、40%的5种配合饲料(D1~D5), 其具体配方及营养成分见表1。将各种饲料原料混合均匀、加水, 用饲料机(上海渔机所生产)制成直径约1 mm的浮性颗粒饲料, 自然晾干后保存于4℃冰箱中备用。
1.2 实验动物
试验用金鼓鱼幼鱼(初始体质量约4 g左右)购于当地一家水产养殖公司。试验前, 将鱼放在汕头大学南澳临海实验站的海上网箱中驯养 4周, 前两周用冰鲜杂鱼和商品饲料(广东海大公司生产的金枪鱼(Thunnus thynnus)饲料)混合投喂, 然后逐步过渡到完全投喂商品饲料; 后两周用 5种试验饲料等量混合投喂。
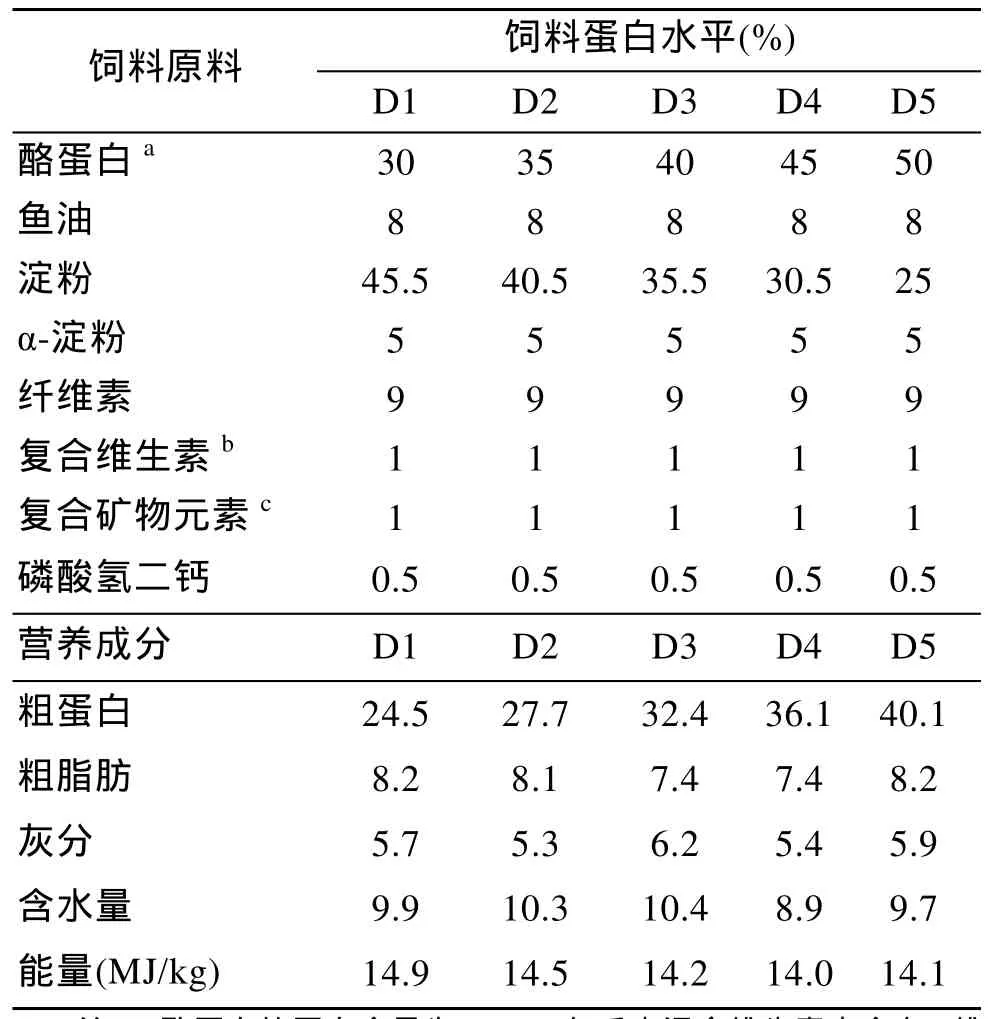
表1 饲料配方及常规营养成分Tab.1 Ingredients and composition of experiment diets
1.3 养殖试验分组及日常管理
养殖试验在南澳临海实验站所属海域的试验鱼排的网箱中进行, 网箱规格为0.6 m×0.6 m×1.5 m。网箱四周上半部设有50目的密网以防止配合饲料随水流飘走, 网箱顶部有盖网以防止试验鱼逃逸和鸟类啄食。试验鱼分为5组, 每组3个平行网箱, 每个网箱放鱼20尾。试验鱼分组前, 将鱼停食24 h, 然后选取体质健壮、规格基本一致的鱼(平均体质量约4.3 g)用 0.01%苯氧基乙醇(α-phenoxyethanol)麻醉,称质量后放入相应网箱中。每天投喂两次(8: 30, 16:30), 饱食投喂, 每次每个网箱轮流投喂 3次, 半小时内吃完。每天检查网箱是否存在破损, 记录水温、鱼死亡情况及投饵量。养殖期间, 水温为(24±2)℃,溶氧量大于5 mg/L。养殖周期为8周。
1.4 样品采集
实验开始和结束时, 将鱼停食24 h, 用0.01%苯氧基乙醇麻醉后逐条称质量并记录。养殖试验结束时, 从每个网箱中随机取6尾鱼, 其中3尾鱼直接置于–20℃冻存, 用于测定全鱼的常规生化成分; 另外3尾鱼经称体质量、测量体长后, 解剖肝脏称质量,然后分别取肝脏、胃、肠组织样品。肝脏样本用于测定消化酶和氨基酸代谢酶活性、免疫与抗氧化指标等; 胃、肠组织用于测定消化酶活性。所有样品取出后迅速用液氮速冻, 保存在–80℃冰箱中备用。
1.5 生长、生理生化指标的测定
1.5.1 生长性能指标
增质量率、特定生长率、饵料系数、蛋白质效率、成活率和肝体比等按照下列公式计算:

式中:Wt为养殖试验结束时鱼的平均体质量(g);W0为养殖试验开始时鱼的平均体质量(g);Wh为鱼肝脏质量(g);n为试验天数。
1.5.2 饲料及全鱼生化成分的测定
配合饲料及全鱼样品的水分、粗蛋白、粗脂肪、灰分含量均按照国GB/T 6435-1986、GB/T 6432-1994、GB/T 6433-2006、GB/T 6438-2008进行测定[2]。
1.5.3 生理指标的测定
相关酶活性均采用南京建成生物工程研究所的试剂盒进行测定, 具体方法详见各自说明书。测定指标包括胃、肠、肝组织的胃蛋白酶、胰蛋白酶、淀粉酶; 肝脏的谷丙转氨酶(glutamic-pyruvic transaminase,GPT)、谷草转氨酶(glutamic oxalacetic transaminase,GOT); 肝脏的免疫与抗氧化指标包括谷胱甘肽过氧化物酶(glutathion peroxidase, GPX)、过氧化氢酶(catalase, CAT)、溶菌酶(lysozyme)、酸性磷酸酶(acid phosphatase, ACP)、碱性磷酸酶(alkaline phosphatase,ALP)、超氧化物歧化酶(superoxide dismutase, SOD )总抗氧化力(activity in the anterior intestine, T-AOC)、丙二醛(malonaldehyde, MDA)等。
1.6 数据分析
数据以平均值±标准误(n=3)表示, 各组数据用Excel初步处理后, 用 Spss16.0软件进行单因素方差分析(ANOVA)和 Duncan多重比较分析比较组间差异, 当P<0.05时认为差异显著; 根据增质量率与饲料蛋白水平做二次回归分析, 确定金鼓鱼达到最佳生长效果时的饲料蛋白水平。
左边界和地基右边界y方向约束,上边界和路基右边界自由,下边界y和z方向约束。加宽路基处理后,计算模型的网格划分如图3所示。
2 结果与分析
2.1 饲料蛋白水平对金鼓鱼生长性能的影响
以蛋白水平24% ~40%的5种配合饲料投喂金鼓鱼幼鱼 8周后, 鱼体的生长性能及相应指标变化等见表2。各组鱼的成活率均在85%以上, 相互之间无显著性差异(P>0.05); 增质量率、特定生长率和蛋白质效率均随着饲料蛋白水平的升高呈现先上升后下降的趋势, 而饲料系数的变化呈相反趋势。当饲料蛋白水平为 32.4%时(D3组)试验鱼生长效果较好, 其中, 增质量率和特定生长率显著大于 D1与 D2组(P<0.05), 与 D1组相比分别增长 76.97%和 46.03%(表3), 同时饵料系数却显著低于 D1和 D2组(P<0.05), 与D1组相比减少41.97%(表3), 蛋白质效率显著高于其他4组(P<0.05)。各组鱼肝体比无显著性差异(P>0.05)。构建金鼓鱼幼鱼的增质量率(y)和饲料蛋白水平(x)的二次曲线回归方程:y= –838.35773+58.32379x–0.83883x2, 当饲料蛋白水平为 35.15时,其增质量率达到最大水平(图1)。
2.2 饲料蛋白水平对金鼓鱼全鱼体成分的影响
不同饲料投喂金鼓鱼 8周后, 全鱼的生化成分变化见表4。全鱼的灰分和水分含量没有显著差异(P>0.05); 粗脂肪含量与饲料蛋白水平变化趋势相反,其中D1组粗脂肪含量显著高于D3~D5组(P<0.05); 全鱼粗蛋白含量随着饲料蛋白水平的上升而上升, D5与D4组显著高于其他3组(P<0.05)。结果说明, 饲料蛋白水平会对全鱼粗脂肪及粗蛋白水平产生显著影响。

表2 饲料蛋白水平对金鼓鱼幼鱼生长和饲料利用的影响Tab.2 Effects of varying dietary protein levels on the growth performance and feed utilization efficiency of butterfish juveniles

表3 主要生长指标组间差异百分比比较Tab.3 The variation range of some mean growth perfor-mance indexes
2.3 饲料蛋白水平对金鼓鱼消化酶活性的影响
饲料蛋白水平对金鼓鱼幼鱼消化酶活性的影响见图2~图4。饲料蛋白水平的变化并不影响消化道中脂肪酶及淀粉酶活性(P>0.05), 但对蛋白酶活性却产生了显著影响。其中, 胃蛋白酶和肠道中胰蛋白酶活性均随着饲料蛋白水平的升高呈现先上升后下降的趋势, 与增质量率变化趋势相似。D3与 D4组鱼胃蛋白酶活力显著高于 D1、D2组(P<0.05); D4组
肠道中胰蛋白酶活性最高, 显著高于D1、D2与D5组(P<0.05); 但各组鱼肝脏胰蛋白酶活性差异不显著(P>0.05)。说明金鼓鱼可以通过提高胃、肠道的蛋白酶活性增强对饲料中蛋白成分的消化吸收。

表4 饲料蛋白水平对金鼓鱼全鱼生化成分的影响Tab.4 Effects of varying dietary protein levels on the body biochemical composition of butterfish juveniles

图1 不同饲料蛋白水平下金鼓鱼幼鱼的增质量率Fig.1 Weight gain rate of butterfish juveniles fed diets with different levels of protein

图2 不同饲料蛋白水平对金鼓鱼幼鱼胃、肠道和肝脏蛋白酶活性的影响Fig.2 Effects of varying dietary protein levels on the on protease activities in stomach, forgut and liver of butterfish

图3 不同饲料蛋白水平对金鼓鱼幼鱼胃、肠道和肝脏脂肪酶活性的影响Fig.3 Effects of varying dietary protein levels on the lipase activities in stomach, forgut and liver of butterfish

图4 不同饲料对金鼓鱼幼鱼肠道和肝脏淀粉酶活性的影响Fig.4 Effects of varying dietary protein levels on the amylase activities in forgut and liver of butterfish
2.4 饲料蛋白水平对金鼓鱼幼鱼谷草转氨酶、谷丙转氨酶活性的影响
不同饲料投喂组鱼肝脏的谷丙转氨酶(GPT)和谷草转氨酶(GOT)活性见图5。结果显示, 随着饲料蛋白水平升高, 肝脏中GPT和GOT的活性呈现先上升后下降的趋势, 这与各饲料组鱼的增质量率的变化趋势一致; 其中D3、D4组鱼的GPT活性显著高于D1与D5组, D3组鱼的GOT活性显著高于D1组(P<0.05)。说明饲料蛋白水平显著影响金鼓鱼幼鱼肝脏中这两种转氨酶的活性。

图5 饲料蛋白水平对金鼓鱼肝脏谷丙转氨酶、谷草转氨酶活性的影响Fig.5 Effects of varying dietary protein levels on the GPT and GOT activities in liver of butterfish juveniles
2.5 饲料蛋白水平对金鼓鱼幼鱼免疫、抗氧化指标的影响
饲料蛋白水平显著影响金鼓鱼幼鱼肝脏抗氧化酶活性。其中超氧化物歧化酶、过氧化氢酶及总抗氧化力的变化趋势与增质量率的变化趋势相符, 分别在D3、D4和D3组达到最大值, 且均显著高于D1、D2和D5组(P<0.05)。丙二醛(MDA)变化趋势与前三者相反, 以 D3组最低, 显著低于 D1与 D2组(P<0.05); 此外, 谷胱甘肽过氧化物酶(GPX)活性在各组之间无显著性差异。以上结果表明, 适宜的饲料蛋白水平对改善金鼓鱼幼鱼的免疫及抗氧化能力有一定帮助。
3 讨论
3.1 蛋白水平影响金鼓鱼幼鱼的生长性能
鱼类对蛋白质的营养需求与鱼类的食性有较大关系, 植食性鱼类对蛋白质的需求小于杂食性鱼类,而肉食性鱼类的蛋白营养需求最高[2]。例如, 植食性的黄斑蓝子鱼为 29.01%~34.37%[2]、杂食性的美国红鱼 (Sciaenops ocellatus)的蛋白需求量为40%[5]、丝尾 鳠 (Cuvier & Valenciennes)为 44%[6]等; 肉食性鱼类较高, 如 佛罗里达鲳 鲹 (Trachinotus carolinus)为45%[7]、黑线鳕鱼 (Melano grammus aeglefinusL.)为 49.9%[8]、大西洋鳕 (Gadus morhuaL.)为 54.0%[9]、点带石斑鱼 (Epinephelus malabaricus)为55%[10], 一般在45%~55%。

表5 饲料蛋白水平对金鼓鱼幼鱼肝脏免疫和抗氧化指标的影响Tab.5 Effects of varying dietary protein levels on the immune and antioxidant indexes in liver of butterfish juveniles
迄今, 尚未有关于金鼓鱼蛋白营养需求的报道,但对黄斑蓝子鱼、点蓝子鱼[11]、等食性相近的海水鱼类的研究表明, 植食性海水鱼类的蛋白需求量在29%~34%。且蛋白需求量随生长阶段的不同有较大差异, 一般幼鱼蛋白营养需求高于成鱼。本研究发现,饲料蛋白水平显著影响金鼓鱼幼鱼的增质量率和特定生长率。随着饲料蛋白水平的提高, 金鼓鱼幼鱼的增质量率和特定生长率变化趋势一致, 均在 D3组(32%)达到最大值; 饲料系数变化趋势与增质量率和特定生长率相反, 在 D3组达到最小值, 表明 D3组饲料的蛋白水平达到鱼体最大生长所需。回归曲线分析表明, 当饲料的蛋白含量为 35.15%时幼鱼的增质量率最高。当饲料蛋白水平大于D3组(32%)后, 随着饲料蛋白水平升高, 蛋白质效率不断下降, 表明高蛋白饲料使得鱼体中更多的蛋白用于能量代谢,造成排放到水体中的氮增加, 导致蛋白质浪费[12-14]。
金鼓鱼幼鱼肝体比随饲料蛋白水平的上升而下降, 但各组间无显著差异。一方面, 可能是金鼓鱼幼鱼在生长、代谢中要维持适宜的能量, 所以当日粮中蛋白质提供的能量不足时, 选择性地积累一定量的脂肪, 并以此作为能量来源[11]; 另一方面, 可能是由于低蛋白组含有较高水平的淀粉, 导致饲料中糖类含量的提高, 引起糖原在肝脏中的积累, 引起肝体比增大[15]。
3.2 饲料蛋白水平影响金鼓鱼幼鱼鱼体常规生化成分
金鼓鱼鱼体粗蛋白含量随着饲料蛋白水平的上升而上升, 这与在黄斑蓝子鱼[2]和鲻鱼 (Mugilcephalus linnaeus)[16]中的研究结果一致, 但与高荣兵[17]对点蓝子鱼幼鱼的研究报道不一致, 他们发现:
随着饲料蛋白水平从 21%上升到 48%, 点蓝子鱼鱼体粗蛋白呈先上升后下降的趋势。此外, 也有研究表明, 饲料蛋白水平对鱼体粗蛋白含量并无显著影响,如对白梭吻鲈鱼 (Sciaenops ocellatus)[18]、大菱鲆幼鱼 (Scophthalmus maximus L.)[19]等的研究, 出现这些结果与鱼类的食性、生境、规格、养殖条件及日常管理等有关。本实验中当蛋白水平高于36.1%后, 金鼓鱼鱼体蛋白含量增速明显放缓, 暗示D5组饲料蛋白水平过高, 金鼓鱼通过其他代谢途径消耗了鱼体过剩的蛋白质[20]。
金鼓鱼鱼体粗脂肪含量随着饲料蛋白水平的上升而下降, 但各组之间无显著性差异。研究表明, 鱼体脂肪沉积与鱼体对能量的需要量有关, 且在一定程度上与饲料系数有关[21], 另一方面, 试验饲料基本等脂等能, 所以蛋白水平较低的饲料中含有较高含量的碳水化合物, 鱼体可能通过转化部分碳水化合物而获得一定的脂肪, 导致鱼体脂肪沉积量上升[22]。此外, 饲料蛋白水平没有对金鼓鱼幼鱼的水分和灰分含量产生显著影响, 类似的结果见于黄斑蓝子鱼。然而, 金鼓鱼幼鱼鱼体体成分改变的原因是否只与饲料的蛋白水平相关仍然有待研究。有学者认为, 鱼体基本营养组成与多种营养因素有关, 是复杂的代谢调控的结果[23]。本研究结果表明, 在适宜范围内提高饲料蛋白水平可以改善金鼓鱼肉质, 减少体内脂肪沉积。
3.3 试验饲料蛋白水平对金鼓鱼幼鱼蛋白酶成活性的影响
鱼类消化酶的活性与其食性、饲料组成等有很大关系。在一定范围内, 蛋白酶活性随着饲料蛋白水平的增加而增加[24]。本研究发现, 试验鱼消化道中蛋白酶活性的变化趋势基本一致, 随饲料蛋白水平的上升, 胃、肝脏和肠道蛋白酶活性均呈先上升后下降的趋势, 这与在其他鱼类中的研究结果相似[25-27], 表明饲料蛋白水平对金鼓鱼幼鱼蛋白酶活性有显著影响。同时, 金鼓鱼幼鱼前肠胰蛋白酶活性高于肝脏, 这与对鲮(Cirrhina molitorella)[28]、草鱼(Ctenopharyngodon idellus)[29]的研究结果一致。一般而言, 肝脏是消化酶分泌器官, 而消化的主要场所是肠道[30], 肝脏消化酶活性直接受消化酶分泌活性的影响; 而肠道消化酶活性受肝脏分泌和转运两个过程的影响[31], 本研究发现, 在相同的饲料蛋白水平下金鼓鱼幼鱼肝脏和肠道蛋白酶变化趋势基本一致, 表明饲料蛋白水平可能主要对肝脏中蛋白酶分泌过程产生影响。综上, 作者认为在一定范围内饲料蛋白水平的升高,可以促进金鼓鱼幼鱼蛋白酶活性, 从而提高其对饲料蛋白的消化吸收[27-28]。
3.4 试验饲料蛋白含量变化对金鼓鱼幼鱼肝脏谷草转氨酶、谷丙转氨酶活性的影响
肝脏中两种转氨酶酶活性的升高表明转氨基作用增强, 组织中氨基酸代谢物增加, 谷丙转氨酶(GPT)主要存在于肝细胞浆内, 作用于底物丙酮酸、a-酮戊二酸的广谱酶, 外来化合物可产生抑制或诱导作用[32]。GOT和GPT活性通常可用来指示动物的肝脏功能。林仕梅等[33]研究表明, 中华绒鳌蟹肝胰腺中GOT活力较肌肉中高, 认为肝胰脏是氨基酸合成和脱氨的主要场所。在本研究中, 对不同组鱼肝脏中GPT和GOT的活性测定后发现, 二者均在D3组中活力最高, 表明D3组蛋白含量可有效促进金鼓鱼幼鱼的氨基酸代谢, 有利于金鼓鱼幼鱼体内代谢平衡,这一结果与石英等[34]对血鹦鹉的研究结果相似, 该研究认为, 适宜的蛋白水平会在一定程度上促进鱼类肝脏中谷草转氨酶、谷丙转氨酶活性, 但过高的饲料蛋白水平会降低这两种酶的活性。
3.5 试验饲料蛋白水平对金鼓鱼幼鱼肝脏免疫与抗氧化指标的影响
所有抗氧化指标中, 总抗氧化力可以反映所有非酶体系抗氧化系统的能力[35]。SOD、CAT在鱼类中的作用主要是清除活性氧, 对过氧化氢(H2O2)和超氧化物(O2-)有清除作用[36]。GPX促进过氧化氢和脂质过氧化物的分解, 是一种高效的抗脂质过氧化酶[37]。本研究发现, 随着饲料蛋白水平的上升, 金鼓鱼幼鱼肝脏中T-AOC、GPX、SOD和CAT水平均呈先上升后下降的趋势, 相反的, MDA水平呈先下降后上升的趋势, 且均在 D3(32%)与 D4组(36%)中表现最好, 表明金鼓鱼幼鱼抗氧化能力与饲料蛋白水平有关。综合各种指标, 我们认为饲料蛋白水平在32%左右, 金鼓鱼幼鱼的抗氧化能力较高。
酸性磷酸酶是溶酶体的标志酶之一, 与细胞代谢有关, 常作为鱼类非特异性免疫的一个指标。碱性磷酸酶是膜结合蛋白, 参与多种代谢物的转运[38]。溶菌酶被认为是评估鱼类抗病及免疫能力的主要指标之一[35]。随着饲料蛋白水平的上升, 金鼓鱼幼鱼溶菌酶和酸性磷酸酶均呈现先上升后下降的趋势, 并且各组间有显著差异, 这与乐贻荣等[39]在奥尼罗非鱼(Oreochromis niloticus×O.aureus)中的报道不同, 该研究认为饲料蛋白水平变化对奥尼罗非鱼溶菌酶活性无显著影响, 表明不同种鱼类的饲料蛋白水平对其免疫能力的影响有所不同。在本研究中, 蛋白含量较低组金鼓鱼的免疫和抗氧化指标的活性均有所下降, 可能与饲料中必需氨基酸供应不足有关[40]; 另一方面, 不同的蛋白源含有的氨基酸未必完全适宜某种鱼类, 所以当饲料蛋白水平上升到一定程度后,营养拮抗因子也会在鱼体中增多, 从而影响鱼体免疫和抗氧化的能力[41]。综上, 32%~36%的饲料蛋白水平可能有利于提高金鼓鱼的免疫与抗氧化能力。
4 小结
研究结果表明, 金鼓鱼幼鱼饲料中蛋白的适宜添加量为35%左右。在此饲料蛋白水平下, 金鼓鱼的增质量率最大, 鱼体蛋白含量较高, 脂肪含量较低,消化道的蛋白酶活性较高, 鱼体的免疫与抗氧化能力较强。本研究首次确定金鼓鱼幼鱼对蛋白质的适宜需要量, 为其饲料配方研发提供了参考依据。
[1]兰国宝, 闫冰, 廖思明, 等.金钱鱼生物学研究及回顾[J].水产科学, 2005, 24 (7): 39-40.
[2]王树启, 徐树德.黄斑蓝子鱼幼鱼对蛋白质和脂肪适宜需要量的研究[J].海洋科学, 2010, 34(11): 18-22.
[3]朱卫, 刘鉴毅, 庄平, 等.饲料脂肪水平对点蓝子鱼生长和体成分的影响[J].海洋渔业, 2013, 35(1): 65-71.
[4]Lee S M, Cho S H, Kim K D.Effects of dietary protein and energy levels on growth and body composition of juvenile flounderParalichtys olivaceus[J].Journal of the World Aquaculture Society , 2000, 30: 306-315.
[5]Serrano J A, Nematipour G R, Gatlin D M.Dietary protein requirement of the red drum (Sciaenops ocellatus) and relative use of dietary carbohydrate and lipid [J].Aquaculture , 1992, 101: 283-291.
[6]Ng W K, Soon S C, Hashim R.The dietary protein requirement of a bagrid catfishMystus nemurus,determined using semipuri-fied diets of varying protein level [J].Aquaculture Nutrition, 2001, 7: 45-51.
[7]Lazo J P, Davis D A, Arnold C R.The effects of dietary protein level on growth, feed efficiency and survival of juvenile Florida pompano (Trachinotus carolinus) [J].Aquaculture, 1998, 169: 225-232.
[8]Kim J D, Lall S P, Milley J E.Dietary protein requirements of juvenile haddock (Melanogrammusaegle fnus L.) [J].Aquaculture Research, 2001, 32(S1):1-7.
[9]Hatlen B, Hell S J, Grisdale-Helland B.Energy and nitrogen partitioning in 250 g Atlantic cod (Gadus morhua L.) given graded levels of feed with different protein and lipid content [J].Aquaculture, 2007, 270:167-177.
[10]Tuan L A, Williams K C.Optimum dietary protein and lipid speci fcations for juvenile malabar grouper(Epinephelus malabaricus) [J].Aquaculture, 2007, 267:129-138.
[11]Parazo M M.Effect of dietary protein and energy level on growth, protein utilization and careass composition of rabbitfishSiganus guttatus[J].Aquaeulture, 1990,86: 41-49.
[12]王桂芹, 周洪琪, 陈建明, 等.翘 嘴红 鲌 对饲料蛋白的营养需求及豆粕对鱼粉的适宜替代量[J].中国水产科学, 2006, 13(2): 277-285.
[13]Kim K W, Wang X J, Bai S C.Reevaluation of the optimum dietary protein level for the maximum growth of juvenile Korean rockfish,Sebastes schlegeli(Hilgendorf) [J].Aquaculture Research, 2001, 32 (S1): 119-125.
[14]Alam M S, Watanabe W O, Carroll P M.Dietary protein requirements of juvenile black sea bass,Centropristis striata[J].Journal of the World Aquaculture Society, 2008, 39: 656-663.
[15]Hidalgoy F, Alliot E.Influence of water temperature on protein requirement and protein utilization in juvenile sea bass,Dicentrachus labrax[J].Aquaculture, 1988,72: 115-129.
[16]周文坚.鲻鱼对蛋白质的营养需求[J].现代渔业信息, 1991, 6 ( 9) : 18-22.
[17]高荣兵.点蓝子鱼幼鱼最适饲料蛋白、蛋能比及动植物蛋白比的研究[M].上海: 华东理工大学, 2010: 12-19.
[18]Schulz C, Bohm M, Wirth M, et al.Effect of dietary protein on growth, feed conversion, body composition and survival of pike perch fingerlings (Sander lucioperca)[J].Aquaculture Nutrition, 2007, 13: 373-380.
[19]Lee J K, Cho S H, Park S U, et al.Dietary protein requirement for young turbot (Scophthalmus maximusL.) [J].Aquaculture Nutrition, 2003, 9: 283-286.
[20]Samantaray K, Mohanty S S.Interactions of dietary levels of protein and energy on fingerling snakehead,Channa striata[J].Aquaculture, 1997, 156 : 245-249.
[21]邵庆均, 苏小凤, 许梓荣, 等.饲料蛋白水平对宝石鲈生长和体组成影响研究[J].水生生物学报, 2004,28(4): 367-373.
[22]Yang S D, Liu C H, Liu F G.Effect of dietary protein level on growth performance, carcass composition and ammonia excretion in juvenile sliver perch [J].Aquaculture, 2002, 213: 363-372.
[23]Luo Z, Liu Y J, Mai K S, et al.Optimal dietary protein requirement of grouperEpinephelus coioidesjuveniles fed isoenergetic diets in floating net cages [J].Aquaculture Nutrition, 2004, 10: 247-252.
[24]黄峰, 严安生, 张桂荣, 等.不同蛋白含量饲料对南方鲇胃蛋白酶和淀粉酶活性的影响[J].水生生物学报, 2003, 27(5): 451-456.
[25]董云伟, 牛翠娟, 杜丽, 等.饲料蛋白水平对罗氏沼虾生长和消化酶活性的影响[J].北京师范大学学报(自然科学版), 2001, 37(l): 96-99.
[26]李金秋, 林建斌, 朱庆国, 等.不同能量蛋白比饲料对牙鲆体内消化酶活性的影响[J].集美大学学报(自然科学版), 2005, 10(4): 296-299.
[27]邵庆军, 苏小凤, 许梓荣.饲料蛋白水平对宝石鲈生长和消化酶活性的影响[J].浙江大学学报, 2004,30(5): 553-556.
[28]姜巨峰, 张殿昌, 林黑着, 等.不同蛋白水平对鲮消化酶活性的影响[J].安徽农业科学, 2008, 36(16):6784-6786.
[29]高攀, 蒋明, 文华, 等.不同蛋白能力比饲料对草鱼幼鱼消化酶活性的影响[J].淡水渔业, 2009, 39(6):54 -58.
[30]孙海涛, 吉红.饲料蛋白水平对匙吻鲟幼鱼肌肉和消化酶活力的影响[J].水产科学, 2011, 30(20): 12-17.
[31]Zambonino-Infante J L, Cahu C L.Ontogeny of the gastrointestinal tract of marine fish [J].Comparative Biochemistry and Physiology Part C, 2001, 130: 477-487.
[32]Chien Y H, Pan C H, Hunter B.The resitance to physical stress byPenacus monodonjuveniles fed diets supplemented with astaxanthin[J].Aquaculture, 2003,216: 177-191.
[33]林仕梅, 薛敏, 中华绒鳌蟹营养蛋白质能量比对中华绒鳌蟹蛋白酶活力和饲料消化率的影响[J].浙江海洋学院学报(自然科学版), 2001, 20(B9): 62-65.
[34]石英, 冷向军, 李小勤, 等.饲料蛋白水平对血鹦鹉生长、体组成和肠道蛋白消化酶活性的影响[J].水生生物学报, 2009, 33(5): 874-880.
[35]Zhang Q B, Li N, Zhou G F, et al.In vivo antioxidant activity of polysaccharide fraction fromPorphyra haitanesis(Rhodephyta) in aging mice[J].Pharmacological Research, 2003, 48: 151-155.
[36]Tocher D J, Mourente G, Eecken A V, et al.Effects of dietary vitamin E on antioxidant defence mechanisms of juvenile turbot (Scophthalmus macimus), halibut(Hippoglossus hippoglossisL.) and sea bream (Sparus aurataL.) [J].Aquaculture Nutrition, 2002, 8: 195-207.
[37]Winston G W, Di Giulio R T.Prooxidant and antioxidant mechanisms in aquatic organisms [J].Aquatic Toxicology, 1991, 19: 137-161.
[38]Lakshmi R, Kundu R, Thomas E, et al.Mercuric chloride induced inhibation of acid and alkaline phosphatase activity in the kidney of MudskipperBoleophthalmus dentatus[J].Acta Hydrochimica et Hydrobiologica, 1991, 19(3): 341-344.
[39]乐贻荣, 杨弘, 徐启群, 等.饲料蛋白水平对奥尼罗非鱼生长、免疫功能以及抗病力的影响[J].海洋与湖沼, 2013, 44 (2): 493-498.
[40]Young V R.Protein and amino acids[M].New Jersey :Humana Press, 2000: 49-64.
[41]Li P, Yin Y L, Li D, et al.Amino acids and immune function[J].Br J Nutr, 2007, 98: 237-252.
