贻贝养殖区底层鱼类群落结构特征分析
2015-12-15汪振华章守宇
汪振华, 王 凯, 赵 静, 章守宇
(上海海洋大学 海洋科学学院, 上海201306)
贻贝养殖在一些国家的近岸水域是一种非常普遍的海水养殖模式[1]。近年来, 各主要养殖国家都呈现养殖规模不断扩增的趋势, 而养殖规模的增加使得其占据的自然海域面积上升到一个不能忽略的尺度[2], 从而成为一种典型的人工生境, 即由人工设置在自然水域中的构造物所支撑的物理和生物环境[3]。以东海区马鞍列岛特别保护区为例, 截止 2012年,在530 km2的海域紫贻贝Mytilus edulis和厚壳贻贝Mytilus coruscus的养殖规模已达2 400 hm2, 占总海域面积的近5%。在上述背景下, 围绕该人工生境生态效应的研究日渐丰富起来[2,4]。
贻贝养殖区域存在非常明显但强度大小不一的生化沉降[5-7]。这一过程往往会对养殖区域底部海床的理化环境产生很大影响[2,5]。由此引起的食物关系变化对底栖动物[1,6,8-10], 浮游生物[11-12], 游泳动物[10,13]以及海鸟和海兽[4]等生物群落产生一定的影响。国内外已有的研究主要侧重养殖活动对海区理化环境和底栖生物群落的影响, 针对养殖生境中的鱼类群落仅有Morrisey等[13]对新西兰北部南岛贻贝养殖区以及 Clynick等[10]对加拿大东部 Magdalen群岛两处贻贝养殖区的 2个研究案例, 其关注的是上层水体鱼类(养殖结构物内部和外表面)以及底栖性鲆鲽类的鱼类组成情况。事实上, 全面了解养殖活动对周边自然环境(包括生物组成情况)的影响是实现产业可持续发展的保证[14]。目前, 针对贻贝养殖区域底层水体鱼类群落的研究依然空白, 这给我们全面了解该生境的生态效应带来了一定的局限性。
本研究目的就是在已有研究的基础上, 深入探讨贻贝养殖生境底部区域鱼类群落特征, 从而揭示养殖活动对自然环境中鱼类组成的潜在影响, 丰富海水养殖生境中的海洋生态学研究内容。
1 材料与方法
1.1 研究区域选择
研究区域位于马鞍列岛海洋特别保护区西北部的绿华南部(图1)。目前东西绿华岛的南北分布有浮绳贻贝养殖面积约为200 hm2[15]。贻贝养殖生境站位(西绿华 MF1, 30°49′12.52″N, 122°36′56.17″E; 东绿华MF2, 30°48′50.97″N, 122°38′14.37″E)设置在研究区两处极少受捕捞干扰的水域, 同时在底质和潮流等环境相似的周边区域设置对照泥地站位(绿华南 SB,30°48′28.56″N, 122°36′47.16″E), 以便更好地研究养殖区的鱼类群落状况。上述3个站位的底质皆为粉砂质软泥(中值粒径d50为0.02~0.04 mm); 涨潮潮流皆呈东南至西北流向, 落潮时相反, 皆为西北至东南流向。大潮时, 3个站位的平均底层流速分别为22.5, 24.7和23.9 cm/s; 小潮时, 对应的底层潮流均速分别为9.7,11.2和11.1 cm/s。MF1、MF2和SB的平均水深分别为9.11 m±1.37 m, 8.72 m±1.94 m和9.45 m±1.72 m。
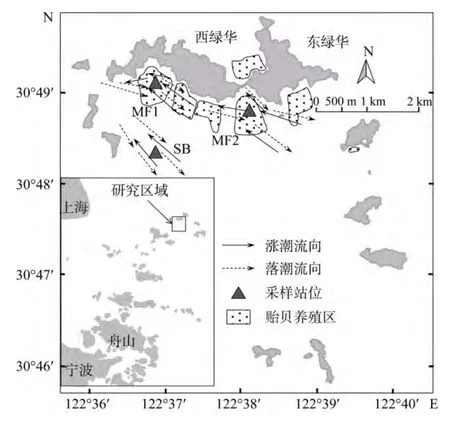
图1 研究区域和站位分布Fig.1 Location of study area and distribution of sampling stations
1.2 采样方法和样品处理
采用多网目三重组合定置底层刺网进行底层鱼类的采集[16]。每一张组合刺网由 8种不同网目大小的网片随机连接而成。该三重网由缩节长度和高度分别为 15 m和 1.5 m 的小网目网片(内网衣目大2a=25, 34, 43, 58 mm; 外网衣2a为210, 270 mm)以及30 m和2.4 m的大网目网片(内网衣目大2a为50,60, 70, 80 mm; 外网衣目大2a皆为330 mm)组合而成。因养殖区底部绳索纵横, 采用阿氏拖网采样几乎不可能, 故选择灵活性较高的底层刺网。近期研究表明, 该网具对底层鱼类的采集效果比较好, 且适用于底质类型较为复杂的生境[17]。本研究于 2009年1–12月逐月对所选站位进行同步昼夜鱼类采集, 选择每月的下旬进行为期1周的采样(每月20~30d), 刺网放置平均用时为20.63 h±2.13 h。放置刺网的同时,利用CTD仪(型号: AAQ1186)对温度、盐度等7个环境因子进行同步测量(结果见表1), 其中潮汐因子利用调查当日最大潮差来表示。
对所获得鱼类样品进行全部取样, 种类鉴定进行至分类地位最低阶元。依据2006年1版《海洋生物生态调查技术规程》游泳动物调查标准, 于取样当天完成基本的生物学测量(包括体重、体长、性腺成熟度、摄食等级等)。
1.3 数据处理和统计分析
鱼类依据其适温性分为暖水种和暖温种[18], 按其对固定栖息地的利用方式分为定居种、近海洄游种和河口洄游种[19-21]。采用 Margalef种类丰富度指数(d)、Shannon-Wienver种类多样性指数(H'),Pielou均匀度指数(J'), Jaccard相似性系数(I)以及 Pinkas相对重要性指数(IRI)对鱼类的多样性特征和优势种组成进行分析。用24 h的渔获数量表示各站位每个月份的相对丰度, 即渔获率。上述指数以季度为单位进行比较, 考虑到舟山北部海域海水温度和陆地气温的变化相比往往存在延后 1个月左右的特性, 加之环境调查时亦发现海水温度最低的 3个月份是在每年的前3个月(见表1), 故本文中季节划分如下:1~3月为冬季; 4~6月为春季; 7~9为夏季; 10~12为秋季。
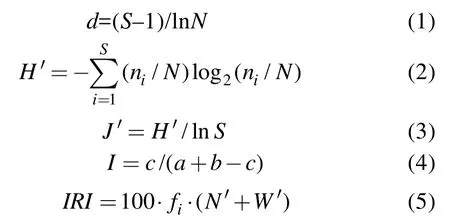
上述各式中S为总种类数,ni和wi分别为第i种鱼类的数量和重量,N和W为鱼类总个体数和总质量。fi为鱼类i在各站位出现的频率。ɑ为站位A的种类数,b为站位B的种类数,c为站位A、B中的共有种数。根据 Jacard相似性系数原理, 当I为0.00~0.25 时, 为极不相似; 当I为0.25~0.50时, 为中等不相似; 当I为0.50~0.75时, 为中等相似; 当I为0.75~1.00 时, 为极相似。N′和W′分别表示第i种鱼类的丰度和生物量百分比。
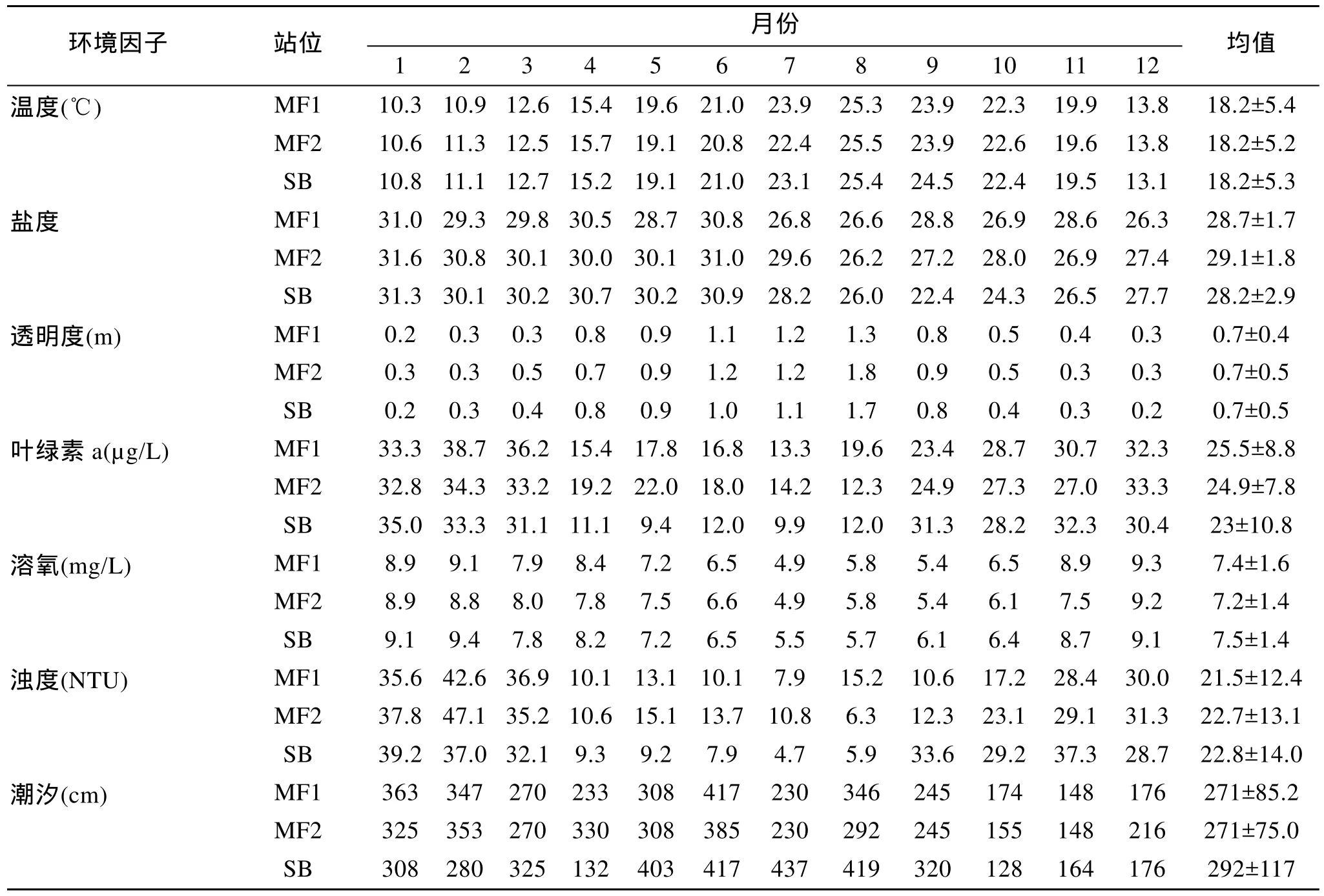
表1 三个站位7种环境因子的月变化Tab.1 Monthly variation of seven selected environmental factors at three stations
采用等级聚类分析鱼类群落组成的格局, 应用丰度矩阵进行相似性分析, 原始数据皆作开平方处理。分析时, 计算任意站位间的 Bray-curtis 相似性系数值BC, 形成相似性矩阵, 进行进一步的聚类分析。BC系数公式如下:。式中nik为第i个站位、种k的数量,njk为第j个站位、种k的数量。聚类分析时将出现率小于5%的种类剔除。利用相似性分析(ANOSIM)检验不同季节和区域群落组成的差异性, 置换数皆为1 000。采用生物与环境相关分析(BIOENV)检验各环境因子对鱼类组成的影响程度和方式。采用丰度生物量比较曲线(abundance biomass comparison curve, 简称ABC曲线)结合种类组成的排序,综合分析2种生境中鱼类的群落格局及其季节变化。用W值表示ABC曲线中生物量和丰度曲线的相对关系统计量:式中,Bi和Ai为ABC曲线中第i种鱼类对应的生物量和丰度的累积百分比,S为采集到的鱼类种数。当生物量优势曲线在丰度优势度曲线之上时,W为正; 反之W为负。上述群落格局的分析和相关性检验皆采用PRIMER 5.0 软件包完成。
使用 SPSS 16.0中的单因素方差分析功能对不同季节和不同生境类型的种类组成、相对丰度和多样性指数进行差异检验, 显著性水平为α=0.05。
2 结果
2.1 种类组成
全年在 2生境中共采集鱼类 41种, 隶属 10目28科36属(表2)。其中贻贝养殖生境采集鱼类35种,隶属9目23科31属(MF1为8目17科22属25种;MF2为7目17科24属25种), 而泥地生境站位SB采集鱼类7目17科21属共计25种。两生境间比较,贻贝养殖生境比泥地要多出 2目 6科 10属共计10种鱼类。3个站位间进行比较, 分类学上数量差异很小, 且 石首鱼科和 鳀 科皆为各自的优势类别, 但全年的Jaccard相似性系数IMF1-MF2=IMF1-SB=IMF2-SB=0.43,为中等程度不相似。
不同生态类型鱼类组成上, 全年采集到的暖水种、暖温种、定居种、近海洄游和河口洄游种分别为 22、19、17、23和 1种(表2)。其中贻贝养殖生境采集到的对应种数分别为18、17、15和20种, 没有河口种; 泥地生境则为12、13、11、13和1种。总体上, 暖水种和暖温种的数量差别不大, 两种生境定居种皆不同程度少于洄游种。除了河口洄游种鳗鲇(Plotosus anguillaris)外, MF中出现的其他生态类型的鱼类都要比SB丰富。
优势种组成方面: 贻贝养殖生境除了冬季西绿华出现的黄 鮟 鱇(Lophius litulon)外, 其他各优势种组成基本一致(表3)。泥地生境中的优势种除皮氏叫姑鱼(Johnius belangerii)、 赤鼻棱 鳀 (Thryssa kammalensis)和黄姑鱼(Nibea albiflora)之外, 其他种类同期都和MF站位不同。
具体到优势种在各生境的优势度情况: 石首鱼科鱼类成为各生境各季度的优势类群(表3)。皮氏叫姑鱼(Johnius belangerii)和小黄鱼(Larimichthys polyactis)是最常见的优势种。前者是贻贝养殖生境的全年优势种, 也是除冬季外泥地生境其他季节的优势鱼种, 但相同季节前一生境的优势度皆大于后一生境。小黄鱼(Larimichthys polyactis)仅在贻贝养殖生境有较大的优势度, 且大部分季节都是优势种,但在泥地生境却并非优势种。季节性优势种方面, 赤鼻棱 鳀 (Thryssa kammalensis)在两种生境的夏季皆成为绝对的优势种, 而 褐菖 鲉 (Sebastiscus marmoratus)、星康吉鳗(Conger myriaster)和鲬(Platycephalus indicus)则不同, 前两种仅在贻贝养殖生境成为优势种, 鲬(Platycephalus indicus)则在泥地生境成为优势种。此外, 黄鮟鱇(Lophius litulon)是冬季的优势鱼类,仅在研究区域西侧的MF1和SB采集到一定数量, 并未显示出两生境的显著差异。
2.2 单变量比较
种类组成的Jaccard相似性系数I(图2): 春夏季贻贝养殖站位的相似性系数皆高于其和泥地生境间的相似性系数, 但仅夏天贻贝站位间的种类组成相似性系数达到中等程度相似。其他季节无论是同一生境还是不同生境, 其相似性系数皆小于 0.5, 其中冬春两季贻贝养殖生境和泥地生境间的种类组成为极不相似。
鱼类群落相对丰度(图2): 春、夏、秋季贻贝养殖生境的平均相对丰度皆明显大于泥地生境, 但其季节间差异并不显著(春:F=0.073,P=0.795; 夏:F=0.859,P=0.385; 秋:F=0.554,P=0.481), 冬季前者略大于后者,且亦无显著性差异(F=0.986,P=0.354)。
鱼类群落物种多样性(图2): (1) 种类数上春夏季贻贝养殖生境的鱼类种数要高于泥地生境, 而秋季相反, 冬季有大有小, 差别不大; (2) 种类丰富度d在春夏季的贻贝站位要高于泥地, 但差异并不显著(春:F=0.115,P=0.744; 夏:F=0.027,P=0.875), 秋冬季贻贝养殖生境的平均丰富度要低于泥地, 亦不显著(秋:F=0.231,P=0.645; 冬:F=0.857,P=0.385); (3) 种类多样性H'呈现的规律和丰富度一致, 但夏季贻贝养殖生境鱼类多样性要显著高于泥地生境(F=10.72,P=0.014);(4) 种类均匀度J'表现出的规律和前两者极为相似, 且各季度之间的差异皆不显著。
各站位不同季度的渔获个体均重(表4): 两个贻贝养殖站位之间在春夏季时东绿华的平均渔获重量大于西绿华, 但到了秋冬季节, 则刚好相反; 天然泥地站位4个季度的渔获均重皆要大于同期的2个贻贝养殖站位。方差分析表明, 无论是贻贝养殖站位之间还是不同生境站位之间, 同一季节的渔获均值皆无显著差异。
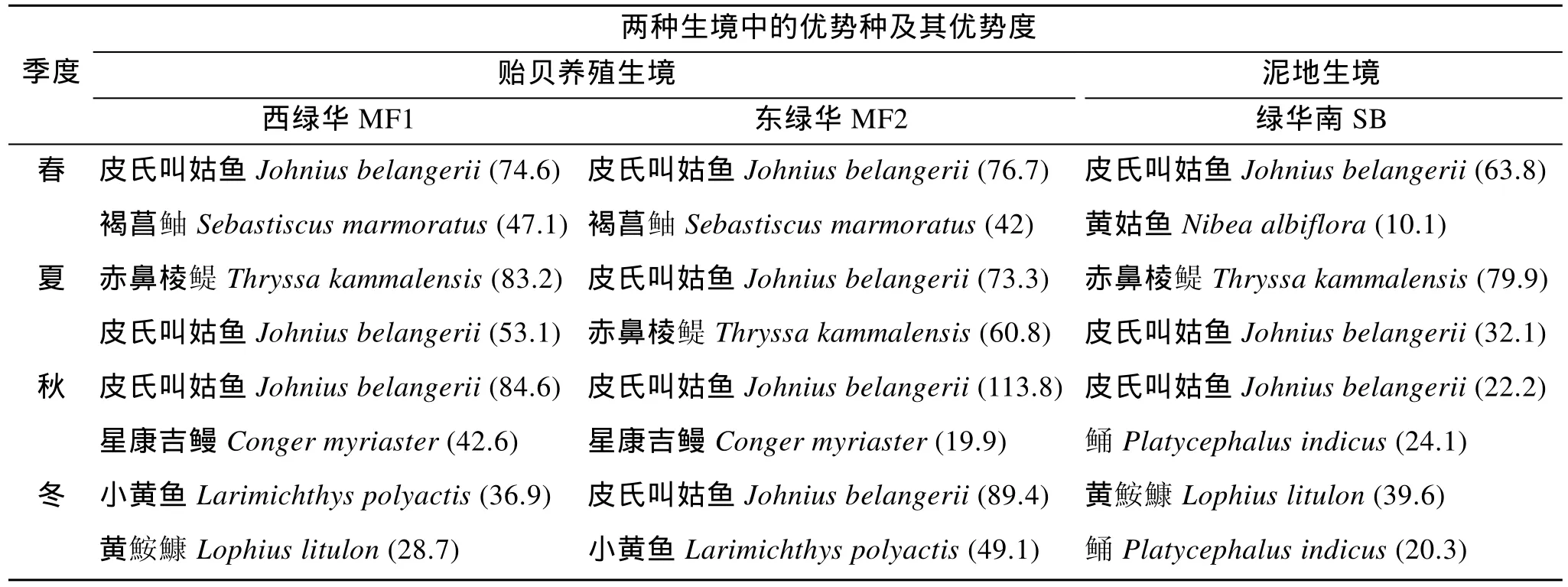
表3 不同生境各季度优势种组成Tab.3 Composition of dominant species at the studied stations in the four seasons
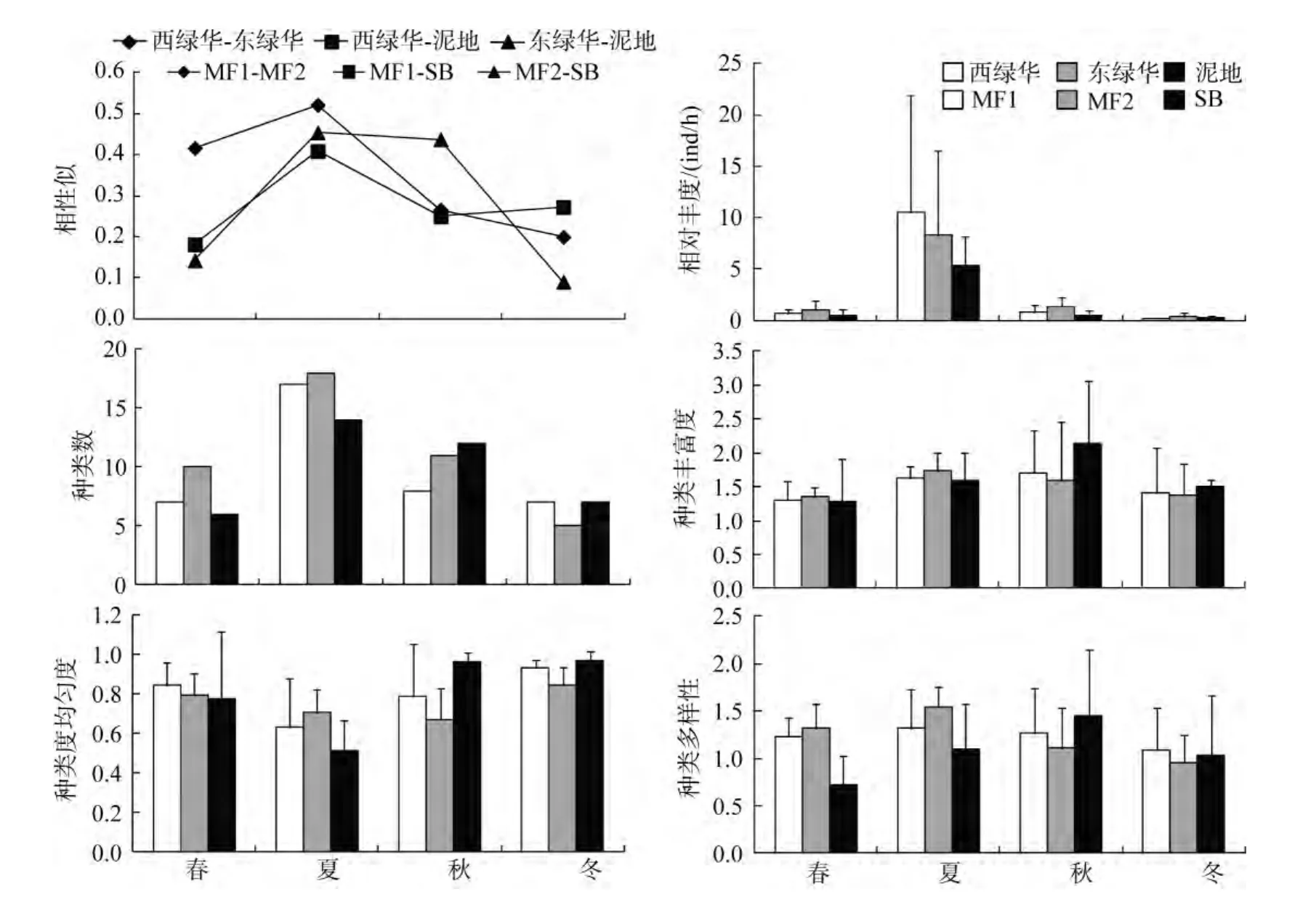
图2 鱼类群落各站位不同季度的单变量指标值Fig.2 Univariate indices of fish community structure at each sampling station in each season

表4 3个站位各季度渔获个体平均质量(g)Tab.4 Average weight of total individuals for each station during each season
2.3 多变量比较
聚类分析结果显示, 鱼类群落组成的格局差异主要体现在季节变化上, 但在相同季节, 贻贝养殖生境的种类组成相似性皆要大于其与泥地生境的相似性(图3)。以平均相似性 50%为界限, 可将其划分为5个群落: 以 赤鼻棱 鳀 、皮氏叫姑鱼和小黄鱼为优势种的夏季鱼类群落Ⅰ, 其平均群落组成相似性为72.4%; 以 褐菖 鲉 、 皮氏叫姑鱼和 鳀 为优势种的春季群落Ⅱ, 其平均群落组成相似性为82.7%; 以皮氏叫姑鱼、黄姑鱼和星康吉鳗为优势种的秋季群落Ⅲ, 其平均群落组成相似性为 52.6%; 以小黄鱼和皮氏叫姑鱼为优势种的贻贝生境冬季群落Ⅳ, 其平均群落组成相似性为 60%; 以 及以黄 鮟 鱇 和 鲬 为优势种的泥地生境冬季群落Ⅴ。5个群落间的总体差异显著(R=0.974,P=0.001)。不同群落间的组成差异性(表5)皆大于60%, 总体上较为显著, 而仅有春秋、夏秋和夏冬三组群落间的差异非常显著(表5)。
两种生境间的群落相似性分析显示, 贻贝养殖生境和泥地生境间群落组成有显著差异(GlobalR=0.093,P=0.021<0.05)。而两个贻贝养殖生境站位间无显著差异(R=–0.044,P=0.827>0.05)。
生物量丰度比较曲线(图4)显示: 贻贝养殖生境两个站位皆呈现丰度优势度曲线高于生物量优势度曲线的特点; 而 泥地生境在黄 鮟 鱇 和 鲬 等大个体底栖鱼类的影响下, 一开始呈现生物量优势度高于丰度优势度的特征, 随后交叉演变为相反趋势, 到第 7种鱼类时则又转为起始状态, 总体表现出大个体和小个体鱼类交替变化的不稳定状态。
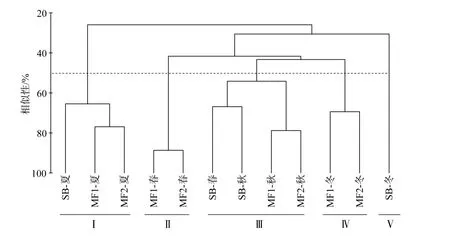
图3 贻贝养殖和泥地生境鱼类群落组成的Bray-Curtis聚类Fig.3 Bray-Curtis dendrogram of fish community composition in MF and SB habitats.
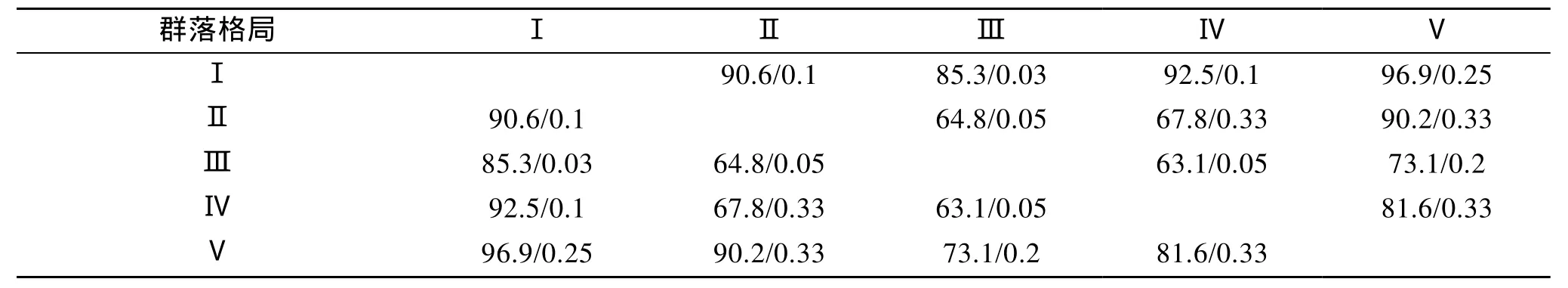
表5 5种群落格局间平均相异性及差异显著性水平(AD/P)Tab.5 The average dissimilarity of community composition and significance levels (AD/P)
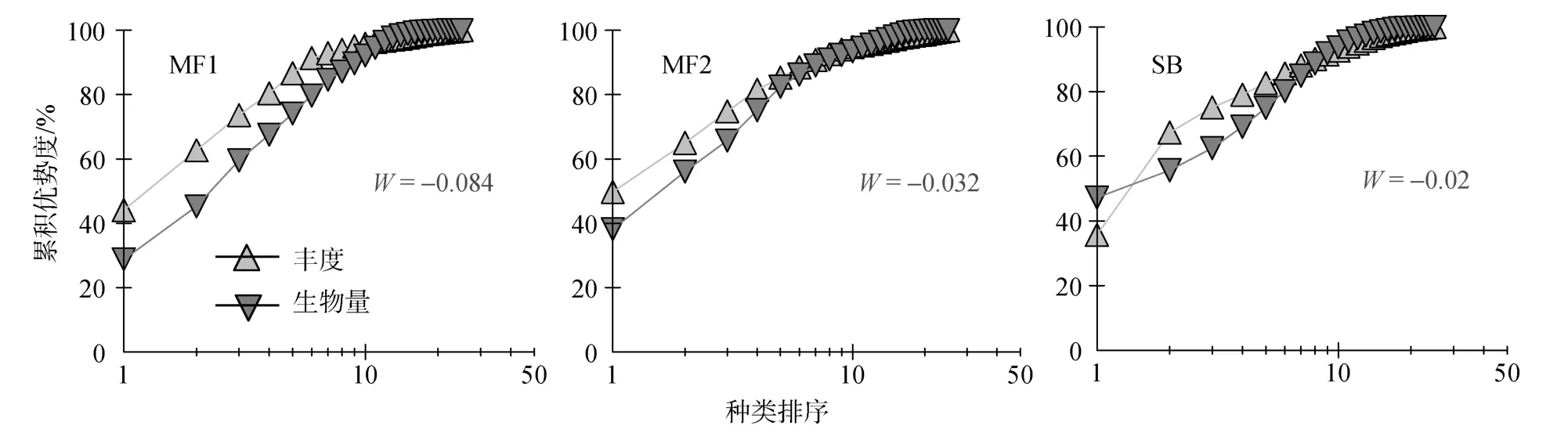
图4 贻贝养殖和泥地生境3个站位的ABC曲线Fig.4 The abundance and biomass comparison at three stations in the study area
2.4 BIOENV分析
从单个因子的影响来看, 贻贝养殖和泥地生境的鱼类群落和环境因子最大相关系数分别为 0.586和 0.312, 对应因子均为溶解氧。因子组合影响上,前者的最大相关系数为 0.647, 组合因子为盐度和溶解氧, 而后者最大 0.352, 对应的组合因子为溶解氧和潮汐。只有在泥地生境中, 浊度、透明度及叶绿素a表现出与鱼类群落的负相关关系, 而在贻贝养殖生境中, 各环境因子均表现出正相关(表6)。两生境中环境因子组合对鱼类群落表现出更强的正相关。
3 讨论
3.1 种类组成差异
贻贝养殖区水体上层由养殖绳索和贻贝串构成的复杂结构, 其功能类似 FADs(集鱼装置), 成为很多鱼类尤其是幼鱼的栖息庇护场所[13]。这种人工与自然环境共同构成的栖息地增加了沙泥等软相生境的空间异质性, 对底栖鱼类的数量和分布也产生一定影响[10]。而对底层水体其他鱼类而言, 在生物的水层—底栖耦合过程中, 必然会有相应的反应机制。
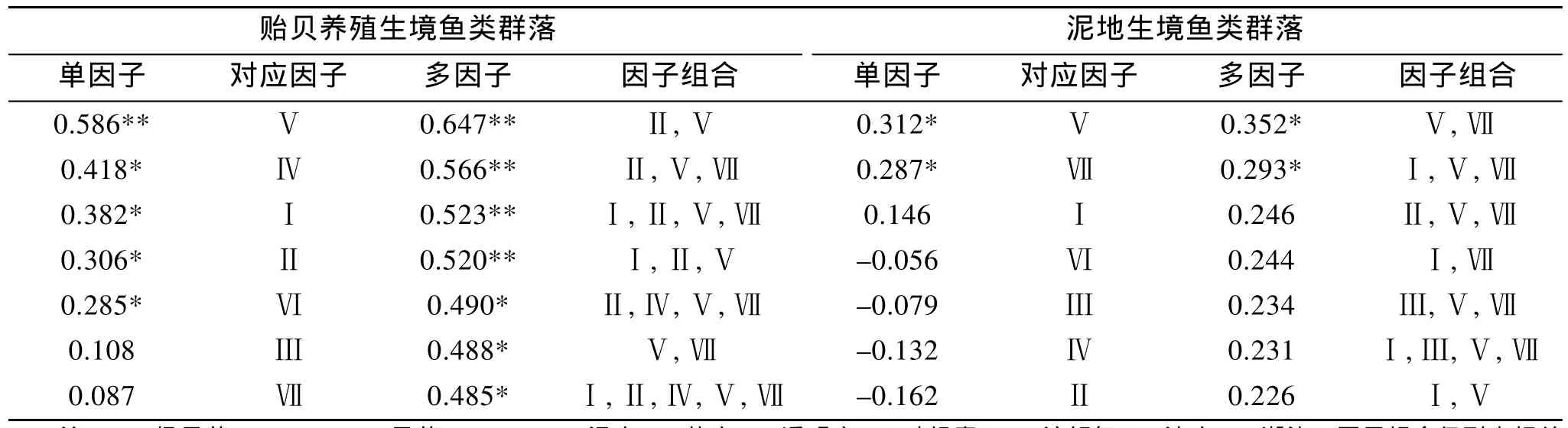
表6 贻贝养殖和泥地鱼类群落组成和环境因子的BIOENV相关分析Tab.6 BIOENV analyses of fish community in mussel farming and soft bottom habitats
针对养殖区底层水体的鱼类组成进行的周年调查表明, 贻贝养殖生境底部聚集的鱼类组成总体上要比自然泥地生境丰富。列牙 鯻 (Pelates quadrilineatus)和带鱼(Trichiurus haumela)等洄游性暖水鱼类, 似乎更趋向于在没有捕捞干扰的养殖浮绳底部活动。在现有的研究尺度上, 两种生境间的水深、温度、盐度、透明度及溶解氧等环境因子并无显著差别(见表1), 因此更多的鱼类出现在贻贝养殖区底部, 除偶然因素外, 饵料和庇护条件很可能起到关键作用[22-23]。虽然有研究认为贻贝养殖形成的碎屑和粪便沉积降低了大型底栖动物的丰度和多样性[1,9], 从而减小了其饵料场作用, 但他们研究的区域皆位于水体交换较差的内弯, 在一些沿岸或开阔水域, 这种影响却非常小[2], 同时也利于养殖环境的良性循环[14]。
通过比较优势种组成, 本研究发现贻贝养殖生境季节性地成为褐菖 鲉 (Sebastiscus marmoratus)和星康吉鳗(Conger myriaster)的聚集地, 同时石首鱼鱼科鱼类的优势度都大于同期的泥地生境。季节性利用贻贝场的褐菖 鲉 个体皆为2~5 cm的幼鱼, 因躲藏在大型海藻的枝叶空隙中而被刺网采集到。Langtry 和 Jacoby (1996)在上个世纪90年代中期就报道过, 漂流海藻成为幼小鱼类和甲壳类的良好栖息场所[24]。因此可能是养殖区底部结构(如桩绳)拦截了裙带菜(Undaria pinnatifida)这类大型底栖漂流海藻, 使 得阶段性栖居在其中的褐菖 鲉 (Sebastiscus marmoratus)幼体大量出现在春季的贻贝养殖区底部。而星康吉鳗(Conger myriaster)在秋季较多出现在贻贝养殖底部水域, 有可能因为此时优良的饵料条件而聚集。每年的夏秋季, 葛氏长臂虾(Palaemon gravieri)和细巧仿对虾(Parapenaeopsis tenella)都会大量聚集在研究海域岛礁附近[25], 无论是产卵群体还是幼体, 皆成为许多鱼类良好的饵料, 而虾类更喜欢在底质富含营养物质的区域活动, 如贻贝养殖区底部。相对泥地生境, 出现在贻贝养殖底部区域的石首鱼科鱼类数量更为丰富, 尤其是皮氏叫姑鱼(Johnius belangerii)和小黄鱼(Larimichthys polyactis)。因此, 贻贝养殖生境对这些鱼类而言是一个更好的栖息地, 由于限制了破坏性网具的作业, 它对这些鱼类的种群还能起到保护并增强的作用。但是, 底栖鱼类 鲬 (Platycephalus indicus)和舌鳎科鱼类却极少在贻贝养殖区采集到, 有可能是因为养殖活动产生的各种沉降限制了其群体的分布范围; 另一方面,这种沉降往往会在底部聚集大量有机物质, 分解这些有机物质会消耗大量氧气从而降低溶解氧含量,使得底部不利于某些鱼类的生存[1]。
3.2 单变量指标分析结果
通过比较 6个单变量指标发现, 两种生境间物种丰富度和多样性并无显著差异。有学者通过这些指标来研究贻贝养殖对底栖生物的影响, 亦发现类似规律[26]。
贻贝养殖生境和泥地生境间各季度鱼类组成相似性皆为中等不相似, 可见两生境的鱼类组成差别较大, 泥地生境随着贻贝养殖设施的加入, 栖息地结构和相应的生境功能发生了变化, 从而导致鱼类组群落结构上的变化。这也进一步解释了“种类组成差异”部分的相关讨论内容。和贻贝养殖生境两个站位之间不同的是, 造成不同生境间差异性的种类是一些数量不多的洄游性种类, 如鲀科鱼类和近岸暖水性鱼类。这有可能因这些鱼类的趋礁性或趋物性所致, 贻贝养殖区因上层结构产生的阴影和底部交错的桩绳起到诱集这些鱼类的作用[10]。目前这方面尚无其他研究案例可供参考或比较, 因此其深层次的原因有待进一步探究。
通过比较相对丰度, 可以发现贻贝养殖区鱼类群落的平均个体密度总体上要高于泥地生境, 但这种差异并不显著。得益于优势鱼类(如石首鱼科的皮氏叫姑鱼(Johnius belangerii)和小黄鱼(Larimichthys polyactis)等, 鳀 科 鱼类的赤鼻棱 鳀 (Thryssa kammalensis), 以 及趋礁性鱼类褐菖 鲉 (Sebastiscus marmoratus)等)在各季节以更高的优势度出现在贻贝养殖底部水域, 其群落密度往往显示出高于泥地的特征。上述鱼类, 除 了褐菖 鲉 (Sebastiscus marmoratus)之外, 其他鱼类的趋礁性都不明显, 但仍然表现出MF比SB更多的数量优势, 可见这些鱼类聚集在这里寻求庇护的可能性并不大, 而很可能是因为出于繁殖或摄食的需要。当地的夏秋季会有渔民在贻贝场垂钓, 其主要钓捕对象即为皮氏叫姑鱼(Johnius grypotus)。但绿华岛贻贝养殖区的饵料条件是否优于周边天然泥地生境, 这一点尚不明晰。目前已有报道,相对周边区域, 一些贻贝养殖区底部的大型无脊椎动物数量会减少, 种类丰富度降低, 但生物量的下降并不显著[6,8]。
本研究发现春夏季群落数量密度和种类数皆高于泥地生境。受其影响, 同期的多样性、丰富度和均匀度指数亦表现出类似规律, 但这些指标在两种生境间的差异几乎都不显著。Clynick 等[10]在研究贻贝养殖区底栖鱼类组成时指出, 养殖区的鱼类丰富度高于周边其他生境, 但这并不能证明这些鱼类的产量就比周边高, 因为不同生境鱼类的生长效率不同。到了秋东季, 贻贝养殖区域的平均鱼类种类数反而要少于或略低于泥地生境, 多样性、均匀度和丰富度指标也相应表现出类似规律。鱼类种数的减少很可能跟贻贝的采收有关。当地每年 8月份开始采收成熟贻贝, 至9月份已基本结束采收并换上幼苗。这样一来, 进入秋季后养殖区贻贝的生物沉降过程大大减弱, 由此形成的一系列营养环境亦产生较大改变,如饵料环境等, 以及栖息地对鱼类的庇护功能降低,从而影响到了鱼类的聚集。
通过以上各个指标的分析, 可见不同指标反映的信息往往不同, 综合考量这些指标的比较效果, 可以全面了解不同生境间鱼类组成特征和群落结构差异。
3.3 多变量分析结果
本研究结果显示相同季节两生境间鱼类群落格局的差异并不显著, 而不同群落格局的形成往往表现在季节变化上, 且差异非常显著。这和 Fabi等[2]研究大型底栖生物群落的结论类似。无论是在贻贝养殖区还是泥地生境, 相同季节控制群落特征的优势种组成总体较为稳定, 且两生境间的差别并不显著, 但随着季节变化, 其优势度发生变化, 受此影响,群落格局相应的表现出季节间的显著差异。这说明贻贝养殖和泥地生境的鱼类群落在同一时期差异较小, 养殖活动并没有从本质上改变原有泥地生境的鱼类群落特征。
通过 ABC分析并结合表4结果, 可以发现在贻贝养殖底层水体中聚集的幼小鱼类密度要高于泥地生境, 且稳定性较泥地生境更佳。泥地生境因为大个体底栖鱼类(如 黄 鮟 鱇(Lophius litulon)和海鳗(Muraenesox cinereus))的季节性聚集, 全年的群落更替现象更为显著, 其稳定性亦不如贻贝养殖区。ABC方法本身存在一定的局限性, 尤其当种类数极少且不是底栖生物的情况下, 会有一定的解释误差[27]。本研究物种数较为丰富, 并且基本为底层鱼类, 因此利用该方法进行数据分析能解读出部分信息, 研究结果一定程度上表明, 贻贝养殖环境对养护幼小鱼类的作用比泥地生境要好, 这显然和养殖区复杂的栖息地结构所提供的各种小生境有关[10]。
3.4 环境因子对贻贝养殖生境的影响
研究发现两生境相关性最高的环境因子相同,皆为溶解氧。在生物沉降剧烈的养殖区域, 溶解氧往往是一些底栖生物分布密度的最大限制因子[1]。有机质的分解消耗大量氧气, 从而对生活在其中的软体类、多毛类和甲壳类等动物的生存产生生理抑制[1],也同时会影响到鱼类。另一方面, 生物沉降也伴随了各种生化反应, 从而影响到养殖水域的酸碱平衡[15],对鱼类的生理产生各种抑制, 因此本文未探讨过的pH等环境因子也必然会有潜在影响。但是在开放海域, 水交换畅通无阻的环境下, 这种影响很可能会被大环境削弱。
在自然的泥地生境, 潮流强度与鱼类群落呈负相关关系, 但到了贻贝养殖区, 成了正相关关系。大潮汛期间, 开阔水域在强潮流的作用下, 除了底栖性鱼类, 其他游泳性鱼类难以在水层长时间停留,很可能会被动顺着潮流方向游动或游向近岸; 但随着贻贝养殖筏的大量铺设, 在浅水区这些设施有可能起到镇流作用, 从而降低潮流流速和强度。但研究中对空间异质性、流态的测定无法准确描述, 而这些因子也可能是决定人工贻贝养殖生境和自然泥地生境生物群落的关键因子之一。这些未知因素需要在将来的研究中深入探讨。
致谢:上海海洋大学许敏、许强、陈清满、陈明超、童武君和刘卫云在现场采样和实验环节做了大量工作, 舟山市嵊泗县渔民张志国协助完成采样, 在此一并致谢!
[1]Christensen P B, Glud R N, Dalsgaard T, et al.Impacts of longline mussel farming on oxygen and nitrogen dynamics and biological communities of coastal sediments[J].Aquaculture, 2003, 218: 567-588.
[2]Fabi G, Manoukian S, Spagnolo A.Impact of an open-sea suspended mussel culture on macrobenthic community (Western Adriatic Sea)[J].Aquaculture,2009, 289: 54-63.
[3]Seaman W Jr, Sprague L M.Artificial Habitats for Marine and Freshwater Fisheries[M].California:Academic Press, 1991: 2-107.
[4]Roycroft D, Kelly T C, Lewis L J.Brids, seals and the suspension culture of mussels in Bantry Bay, a non-seaduck area in Southwest Ireland[J].Estuarine,Coastal and Shelf Science, 2004, 61: 703-712.
[5]La Rosa T L, Mirto S, Favalor E, et al.Impact on the water column biogechemistry of a Mediterranean mussel and fish farm[J].Water Research, 2002, 36: 713-721.
[6]Costa K G, Nalesso R C.Effects of mussel farming on macrobenthic community structure in Southeastern Brazil[J].Aquaculture, 2008, 258: 655-663.
[7]Slater M J, Carton A G.Effect of sea cucumber(Australostichopus mollis) grazing on coastal sediments impacted by mussel farm deposition[J].Marine Pollution Bulletin, 2009, 58: 1123-1129.
[8]Grant J, Hatciier A.A multidisciplinary approach to evaluating impacts of shelfish aquacalture on benthic communities[J].Esturies, 1995, 18: 124-144.
[9]Stenton-Dozey J M E, Jackson L F, Busby A J.Impact of mussel culture on macrobenthic community structure in Saldanha Bay, South Africa[J].Marine Pollution Bulletin, 1999, 39: 357-366.
[10]Clynick B G, McKindsey C W, Archambault P.Distribution and productivity of fish and macroinvertebrates in mussel aquaculture sites in the Magdalen islands(Québec,Canada)[J].Aquaculture, 2008, 283: 203-210.
[11]Ogilvie S C, Ross A H, Schiel D R.Phytoplankton biomass associated with mussel farms in Beatrix Bay,New Zealand[J].Aquaculture, 2000, 181: 71-80.
[12]Trottet A T, Roy S, Tamigneaux E, et al.Impact of suspended mussels(Mytilus edulisL.) on plankton communities in a Magdalen Islands lagoon(Québec,Canada): A mesocosm approach[J].Journal of Experimental Marine Biology and Ecology, 2008, 365:103-115.
[13]Morrisey D J, Cole R G, Davey N K, et al.Abundance and diversity of fish on mussel farms in New Zealand[J].Aquaculture, 2006, 252: 277-288.
[14]杨正先, 孟范平, 朱小山, 等.海水养殖业与可持续发展[J].海洋科学, 2004, 28(10): 63-66.
[15]胡益峰, 蒋红, 李卫丁, 等.嵊泗绿华岛养殖海域环境质量综合评价[J].上海海洋大学学报, 2013, 22(4):603-608.
[16]汪振华, 王凯, 章守宇.马鞍列岛多种生境中鱼类群聚的昼夜变化[J].生态学报, 2011, 31(22): 6912-6925.
[17]汪振华, 龚甫贤, 吴祖立, 等.多网目单层和三重组合刺网在岩礁和沙地生境中的鱼类采集效果比较[J].生态学杂志, 2013, 32(2): 507-514.
[18]郑元甲, 陈雪忠, 程家骅, 等.东海大陆架生物资源与环境[M].上海: 上海科学技术出版社, 2003: 768-782.
[19]Elliott M, Whitfield A K, Potter I C, et al.The guild approach to categorizing estuarine fish assemblages: a global review[J].Fish and Fisheries, 2007, 8: 241-268.
[20]Nicolas D, Lobry J, LePape O, et al.Functional diversity in European estuaries: Relating the composition of fish assemblages to the abiotic environment[J].Estuarine,Coastal and Shelf Science, 2010, 88: 329-338.
[21]汪振华, 章守宇, 陈清满, 等.马鞍列岛岩礁生境鱼类群落生态学Ⅰ种类组成和多样性[J].生物多样性,2012, 20(1): 41-50.
[22]Lubbers L, Boynton W R, Kemp W M.Variations instructure of estuarine fish communities in relation to abundance of submersed vascular plants[J].Marine Ecology Progress Series, 1990, 65: 1-14.
[23]Irlandi E A, Ambrose Jr W G, Orlando B A.Landscape ecology and the marine environment: how spatial configuration of seagrasses influences growth and survival of the bay scallop[J].Oikos, 1995, 72:307-313.
[24]Langtry S K, Jacoby C A.Fish and decapod crustaceans inhabiting drifting algae in Jervis Bay, New South Wales[J].Australian Journal of Ecolgoy, 1996, 21:264-271.
[25]王彝豪.舟山沿海经济虾类及其区系特点[J].海洋与湖沼, 1987, 18(1): 48-54.
[26]Callier M D, McKindsey C W, Desrosiers G.Evaluation of indicators used to detect mussel farm influence on the benthos: Two case studies in the Magdalen Islands,Eastern Canada[J].Aquaculture, 2008, 278: 77-88.
[27]曲方圆, 于子山, 隋吉星, 等.丰度生物量比较法应用局限性[J].海洋科学, 2009, 33(6): 118-121.
