多药耐药基因1和谷胱苷肽-S-转移酶-π在骨软组织肉瘤患者表达及其与化疗耐药关系
2015-12-15孙仁光刘泽淼即墨市中医医院骨一科山东即墨266200
孙仁光 刘泽淼(即墨市中医医院骨一科,山东 即墨 266200)
多药耐药基因1和谷胱苷肽-S-转移酶-π在骨软组织肉瘤患者表达及其与化疗耐药关系
孙仁光刘泽淼1(即墨市中医医院骨一科,山东即墨266200)
〔摘要〕目的探讨骨软组织肉瘤组织中多药耐药基因(MDR)1和谷胱甘肽-S-转移酶(GST)-π与化疗耐药的关系。方法使用免疫荧光法和流式细胞术分别检测MDR1、GST-π的表达;采用甲基偶氮唑盐法检测肿瘤组织对阿奇霉素(ADM)、顺铂(DDP)、5-氟尿嘧啶(FU)、丝裂霉素(MCC)、长春新碱(VCR)及甲氨蝶呤(MTX)的敏感性。结果软骨肉瘤组织对于ADM,DDP,5-FU,MMC,VCR,MTX的敏感率分别为53. 2%,77. 2%,51. 4%,51%,34. 6%,48. 1%。瘤体的P-gp与GST-π的相对荧光强度分别为1. 55和2. 48。P-gp的表达同ADM耐药性,GST-π的表达同ADM,DDP,MMC耐药性均呈显著正相关性(P<0. 05)。MDR1同GST-π的表达同患者基本资料无显著相关性。术前,化疗患者GST-π于升高,术前升高的患者术后复发显著高于术前表达较低的患者。结论骨软组织肉瘤患者MDR1、GST-π表达对化疗的敏感性有个体差异,化疗可导致GST-π升高,GST-π高表达与骨软组织肉瘤耐药有直接关系,且影响预后。
〔关键词〕多药耐药基因1;谷胱甘肽-S;骨肉瘤;软组织肉瘤
1山东大学齐鲁医院关节科
第一作者:孙仁光(1975-),男,主治医师,主要从事骨科创伤及关节疾病研究。
目前化疗是治疗骨软组织肉瘤的有效手段,但多药耐药(MDR)往往对化疗效果造成不良影响。MDR1是常见的耐药基因,它的mRNA蛋白水平增加常见于许多肿瘤〔1〕,被公认为是介导MDR典型的途径。P-gp可以通过能量依赖性ATP泵将化疗药物排除细胞外减少药物在细胞内蓄积,从而形成耐药〔2〕。肿瘤耐药的机制复杂,常是两种耐药机制共同作用〔3〕,不同组织来源的肿瘤,不同病人或是不同的阶段都可能有不同的机制或同一种机制不同程度的表达。骨与软组织化疗具有抗性是否同MDR1、谷胱甘肽-S-转移酶(GST)-π的表达有关尚不清楚〔4〕。本研究探讨骨肉瘤细胞株和恶性骨肉瘤对常用化疗药物的敏感性分析其与MDR、GST-π表达的相关性。
1 资料与方法
1. 1一般资料2009年10月至2012年9月我院手术且术前未经任何治疗的36例骨软组织肉瘤患者。术中取部分组织进行药敏实验,其余置于冰箱内保存。其中男23例,女13例;年龄23~68岁,平均(34. 2±16. 5)岁。均经病理检查确诊。其中6例软骨肉瘤,12例骨肉瘤,4例滑膜肉瘤,14例纤维肉瘤。患者术后化疗,随访15个月以上。选取同期新辅助化疗的15例患者为对照组,检测耐药基因,其中6例纤维肉瘤,5例骨肉瘤,4例滑膜肉瘤。术前化疗方案为阿奇霉素(ADM)+顺铂(DDP)。
1. 2药物敏感性实验组织先使用细胞分离器调节浓度为2×105/ml。将细胞悬浮液滴入96孔板内,受试物包括ADM,DDP,丝裂霉素(MMC),5-氟尿嘧啶(FU),甲氨蝶呤(MTX),长春新碱(VCR),每组5个复孔,48 h后加入噻唑蓝(MTT)(5 mg/ml,10 μl/孔),4 h后加入10%十二烷基硫酸钠(SDS)100 μl/孔,24 h后检测细胞存活率,存活率<30%表示对药物高度敏感,30%~50%为中度敏感,51%~70%为低度敏感,>70%为耐药。
1. 3实时荧光定量基因扩增(FQ-PCR)检测mRNA的表达采用Trizol试剂提取骨与软组织肉瘤组织中的总RNA。首先取冻存组织约0. 1 g,置于研钵中并加入液氮,将其研磨至粉末样,然后将粉末置于预冷经焦碳酸二乙酯(DEPC)处理的Eppendorf管内,加入Trizol 1 ml并吹打混匀,放置5 min,加入200 μl氯仿混匀后放置2 min,12 000 r/min离心10 min,将上层水相导入另一EP管中,加入500 μl异丙醇混匀,放置10 min,12 000 r/min离心10 min,弃去上清液,在沉淀中加入75%乙醇1 ml洗2次,10 000 r/min离心10 min,弃上清,自然干燥10 min后加入DEPC水40 μl,将总RNA溶解。使用核酸蛋白定量分析仪测定RNA在260 nm及280 nm下的吸光度值,同时测定260 nm和280 nm吸光度值的比值为1. 8~2. 0,则证实RNA纯度符合RT-PCR反应要求。采用一步法进行FQ-PCR检测,MDR1,GST-π引物和探针均选自上海生工生物工程公司,β-actin引物和探针为ABI公司生产。RT-PCR反应为25 μl,含总量为RNA 200 ng(5 μl),RT混合物0. 25 μl,2×RT-PCR混合物12. 5 μl,β-actin引物及探针各为1. 5 μl。RT-PCR条件: 50℃下30 min,95℃下15 min,40个循环后在4℃下60 min。采用SDS软件分析循环次数(Ct),mRNA的表达。△Ct=MDR1或GST-π孔中Ct值-β-actin孔Ct值。
1. 4流式细胞仪(FCM)检测蛋白表达将细胞值浓度调为1×106/ml,并设置a,b,c,d 4个管,细胞悬浮液为100 μl/管。a,b管中加入藻红蛋白(PE)标记P-gp鼠抗人单抗,同型对照各10 μl,暗处反应30 min检测。其余细胞经过1%多聚甲醛固定5 min后,再以1%的牛血清白蛋白PBS清洗2次,再加入通透液500 μl,室温下作用10 min使用PBS进行洗涤。c管中加入鼠抗人IgG抗体10 μl,d管中加入鼠抗人GST-π单抗10 μl,室温反应30 min再以PBS洗涤,再加入二抗异硫氰酸荧光素标记抗小鼠IgG单抗5 μl,室温下避光反应30 min后待检测。单抗和FACScalibur型流式细胞仪选自美国B-D公司。蛋白表达采用相对荧光强度表示。
1. 5统计学方法采用SPSS18. 0统计软件进行单因素方差分析,χ2检验。
2 结果
2. 1药物的敏感性检测结果不同患者对于药物敏感性差异较大,其中对于DDP的敏感率(77. 2%)最高,其次为ADM(53. 2%)、5-FU(51. 4%)、MMC(51. 0%)、MTX(48. 1%)、VCR(34. 6%)。耐药率依次为VCR 65. 4%、MTX 51. 9%、MMC 49. 0%、5-FU 48. 6%、ADM 36. 8%、DDP 22. 8%。
2. 2 P-gp、GST-π与药物敏感性的关系P-gp和GST-π蛋白表达见图1、图2。P-gp的表达同ADM耐药性呈正相关(χ2= 9. 442,P<0. 005),GST-π的表达同ADM,DDP,MMC耐药性呈显著正相关性(χ2= 6. 216,8. 023,9. 722,P<0. 05)。同其他化疗药物耐药与否无关。
2. 3 MDR1及GST-π表达同临床病理因素及预后的关系瘤组织MDR1表达低,GST-π的表达较高,且MDR1,GST-π的表达同患者年龄,性别病理类型及肿瘤大小无关(P>0. 05)。术前化疗患者GST-π升高,术后复发者GST-π水平高于无复发者。见表1。
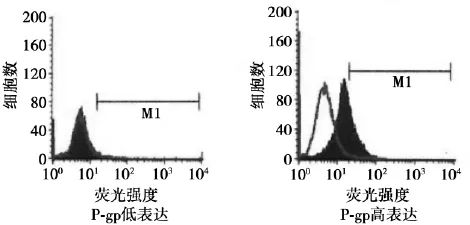
图1 肿瘤组织P-gp表达
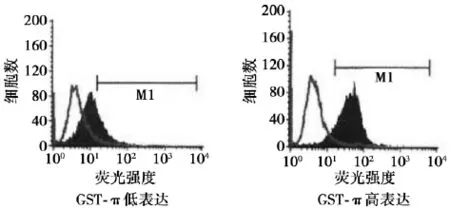
图2 肿瘤组织GST-π表达
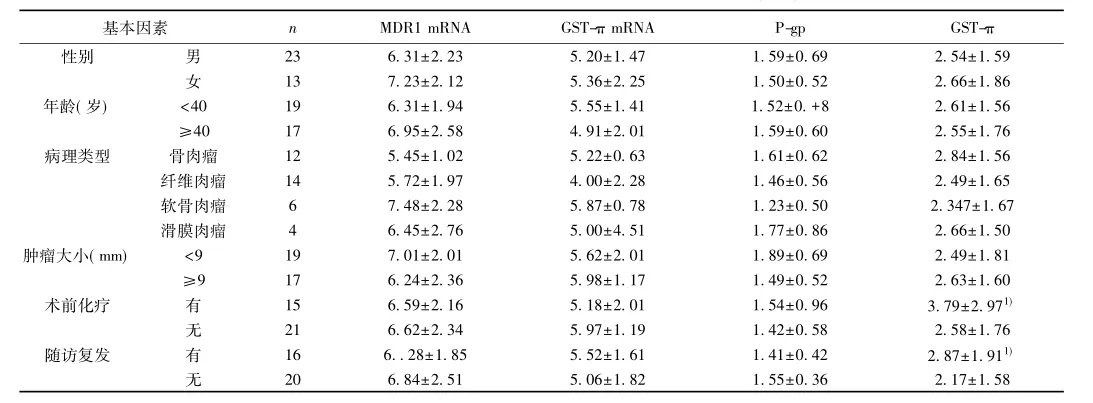
表1 MDR1及GST-π表达同临床病理因素及预后的关系(x±s)
3 讨论
骨软组织肉瘤患者对放化疗药物均具有抗药性。近年来,随着细胞增殖动力学、微小转移灶等肿瘤生物学的研究进展,辅助性化疗已逐渐应用于骨软组织肉瘤患者的治疗中。由于不同个体的肿瘤存在显著性差异,即同一组织学类型、分化程度相同的肿瘤,对同一药物和不同药物的敏感性不同及多重耐药性等因素的影响,使其疗效受到制约。因不同骨软组织肉瘤细胞对化疗药物可产生不同的反应,术后依据病理学肿瘤细胞坏死程度确定化疗敏感性仅能对所应用化疗药物进行综合整体评价,但不能明确是哪一种药物的治疗效果最好。多种基因及其表达产物均对肿瘤化疗的敏感性造成影响,即可能与造成患者耐药性的相关。
目前对肿瘤组织中P-gp表达同患者预后的相关性并无统一定论,有研究认为P-gp高表达是骨肉瘤复发的高危因素〔5,6〕,研究〔7〕报道,P-gp是位于细胞膜上的一类由MDR1基因编码的一种能量依赖性转运蛋白。其MDR机制为,化疗药物进入肿瘤细胞后,P-gp可同时与多种化疗药物集合,通过腺苷三磷酸(ATP)依赖型药物泵将化疗药物排出细胞,从而阻碍药物的作用,即造成肿瘤细胞的耐药性。Baldini等〔8〕研究发现,P-gp高表达患者的生存率明显低于低表达患者,而Ling〔9〕研究同样发现P-gp高表达患者的预后较差,复发率高。而本文未发现MDR1水平与复发有关,不能说明MDR1基因同骨软组织肉瘤预后有关。
GST-π是GSTs家族的主要成员,有学者〔10〕认为GST-π过表达者预后不良,而另有学者〔11〕认为GST-π的表达情况与预后无关。有研究显示无局部淋巴结转移和远处转移原发滑膜肉瘤患者中,GST-π的阳性率同患者性别,年龄,肿瘤位置,活性大小,化疗反应等无明显关系〔12〕,结果与本文一致。本文说明GST-π水平同预后存在关系,是预后的重要因素。对于ADM耐药的患者可以大量检测到P-gp。同时GST-π同ADM,DDP,MMC的耐药程度呈正相关。化疗可能会引起GST-π的表达上调。
4参考文献
1 Tan B,Li Y,Zhao Q,et al.Inhibition of Vav3 could reverse the drug resistance of gastric cancer cells by downregulating JNK signaling pathway 〔J〕.Cancer Gene Ther,2014; 21(12): 526-31.
2 Liu X,Chen L,Feng B,et al.Reversing effect of sorcin in the drug resistance of human nasopharyngeal carcinoma〔J〕.Anat Rec(Hoboken),2014; 297(2): 215-21.
3颜昕,阮文雯,王效民,等.多药耐药对肝癌细胞增殖、凋亡、侵袭活性、耐药机制及丝裂原活化蛋白激酶表达的影响〔J〕.肿瘤,2012; 32(7): 507-15.
4李伟,贺艳,张世权,等.抑凋亡蛋白Survivin及P-糖蛋白在骨肉瘤中的表达与骨肉瘤化疗耐药性关系的研究〔J〕.海南医学,2012; 23(6): 1-3.
5赵明静,马列,王群,等.耐顺铂相关基因MDR1、MRP、LRP及GST-π在非小细胞肺癌中的表达及与生存相关的Meta分析〔J〕.现代肿瘤医学,2012; 20(8): 1596-600.
6 Zhao X,Bai Z,Wu P,et al.S100P enhances the chemosensitivity of human gastric cancer cell lines〔J〕.Cancer Biomark,2013; 3(1): 1-10.
7 Li WJ,Zhong SL,Wu YJ,et al.Systematic expression analysis of genes related to multidrug-resistance in isogenic docetaxel-and adriamycin-resistant breast cancer cell lines〔J〕.Mol Biol Rep,2013; 40(11): 6143-50.
8 Baldini N,Scotlandi K,Barbanti-Bródano G,et al.Expression of P-glycoprotein in high-grade osteosarcomas in relation to clinical outcome〔J〕.N Engl J Med,1995; 333(21): 1380-5.
9 Ling V.Does P-glycoprotein predict response to chemotherapy〔J〕.J Natl Cancer Inst,1989; 81(2): 84-5.
10 Zhang Y,Zhou T,Duan J,et al.Inhibition of P-glycoprotein and glutathione S-transferase-pi mediated resistance by fluoxetine in MCF-7/ADM cells〔J〕.Biomed Pharmacother,2013; 67(8): 757-62.
11李勇,范立侨,檀碧波,等.胃癌原发灶和区域淋巴结转移灶中ZNF139与MRP-1、MDR1/P-gp、GST-π的表达及关系〔J〕.中华普通外科杂志,2014; 29(10): 801-2.
12 Liu X,Ma T,Qu B,et al.Pesticide-induced gene mutations and Parkinson disease risk: a meta-analysis〔J〕.Genet Test Mol Biomarkersl,2013; 17(11): 826-32.
〔2014-07-19修回〕
(编辑苑云杰)
基金项目:青岛市中医科研计划项目(No.2013-zyy032)
〔文章编号〕1005-9202(2015)20-5823-03;
doi:10. 3969/j. issn. 1005-9202. 2015. 20. 067
〔文献标识码〕A
〔中图分类号〕R446
