转化生长因子-α在小鼠颈动脉损伤血管修复中的作用*
2015-12-15代文静张军周敬群向常清王刚
代文静,张军,周敬群,向常清,王刚
转化生长因子-α在小鼠颈动脉损伤血管修复中的作用*
代文静,张军,周敬群,向常清,王刚
目的:研究转化生长因子-α(TGF-α)在颈动脉损伤小鼠血管损伤修复中发挥的作用及其作用机制。
方法:选取130只立特艾比拉特洛波(C57BL/6)小鼠建立颈动脉损伤模型,从中选120只随机分为四组,每组30只,分别注射生理盐水、TGF-α、血管内皮生长因子(VEGF)、TGF-α+VEGF进行干预。流式细胞术检测TGF-α对颈动脉损伤小鼠外周血中内皮祖细胞(EPC)动员的影响;同时酶联免疫吸附方法(ELISA)检测TGF-α对外周血中VEGF、基质细胞衍生因子(SDF-1)、表皮生长因子(EGF)、碱性成纤维细胞因子(bFGF)分泌含量的影响;测定TGF-α处理颈动脉损伤小鼠不同时期外周血中内皮素-1(ET-1)和一氧化氮(NO)含量的变化;依文思蓝染色检测TGF-α对颈动脉损伤小鼠血管再内皮化的作用;苏木素伊红(HE)染色检测TGF-α对颈动脉损伤小鼠血管新生内膜增生的影响。
结果:流式细胞术检测发现TGF-α和VEGF可以显著促进颈动脉损伤小鼠外周血中EPC的动员含量(P<0.05),且TGF-α能与VEGF发生协同作用;ELISA检测发现TGF-α能够显著刺激促血管修复因子VEGF、SDF-1、EGF、bFGF的分泌(P<0.05);随着TGF-α处理时间的延长,颈动脉损伤小鼠外周血中ET-1含量逐渐下降(P<0.05),而NO分泌量逐渐上升(P<0.05);依文思蓝染色发现TGF-α能够显著促进颈动脉损伤小鼠血管再内皮化(P<0.05);HE染色同样发现TGF-α能够显著抑制颈动脉损伤小鼠血管新生内膜的增生(P<0.05)。
结论:TGF-α能够通过促进颈动脉损伤小鼠外周血EPC动员,刺激血管修复因子的分泌和血管的再内皮化并抑制血管新生内膜的增生,从而在血管损伤修复中发挥重要作用。
转化生长因子-α;血管损伤;内皮祖细胞动员;再内皮化;内膜增生
Methods: A total of 130 experimental C57BL/6 mice with carotid artery injury model was established and 120 animals were divided into 4 groups: Control group, the mice received normal saline injection, TGF-α group, the mice received TGF-α intervention, Vascular endothelial growth factor (VEGF) group and TGF-α + VEGF group. n=30 in each group. The endothelial progenitor cells (EPC) mobilization from bone marrow into peripheral circulation was detected by flow cytometry. The effect of TGF-α on vascular repairing factors of VEGF, stromal cell-derived factor-1 (SDF-1), epidermal growth factor (EGF), basic fibroblast growth factor (bFGF) were detected by ELISA, TGF-α caused changes of endothelin-1 (ET-1) and NO at different times were also detected by ELISA. The vascular reendothelialization and intimal hyperplasia were examined by Evans blue staining and HE staining.
Results: In carotid artery injured mice, TGF-α and VEGF could promote the EPCs mobilization from bone marrow into peripheral circulation, P<0.05, TGF-α and VEGF together had synergy effect. TGF-α could stimulate the secretion of VEGF, SDF-1, EGF and bFGF, P<0.05, with longer TGF-α treatment, the content of ET-1 was decreased and NO was increased, P<0.05. TGF-α could improve the vascular reendothelialization, P<0.05 and inhibit the vascular intimal hyperplasia, P<0.05.
Conclusion: TGF-α could promote EPCs mobilization and stimulate the secretion of vascular repair factors in experimental mice which is important for repairing the carotid artery injury.
(Chinese Circulation Journal, 2015,30:384.)
临床上经皮冠状动脉成形术治疗心血管疾病时常会对血管内皮造成损伤,使动脉血管发生增生性再狭窄[1]。血管内皮细胞直接与血液接触,极容易受到各种物理或化学刺激造成细胞损伤脱落,脂质侵蚀,内膜通透性改变,从而构成各种心血管疾病的病理基础[2]。而内皮祖细胞(EPC)作为内皮细胞的前体干细胞,能够从骨髓动员到外周血中在血管损伤修复及抑制新生内膜增生中发挥重要作用[3]。转化生长因子-α(TGF-α)是一种多功能性细胞因子,在胎儿和成人组织中广泛表达,参与细胞增殖、分化功能,在损伤组织中均会表达升高,但其具体作用及机制研究尚少[4]。为探索TGF-α在血管损伤修复中发挥的作用,本文利用立特艾比拉特洛波(C57BL/6)小鼠建立颈动脉损伤模型,通过检测TGF-α对颈动脉损伤小鼠外周血EPC动员、促血管修复因子分泌、血管再内皮化及增生情况以揭示其在血管损伤修复中发挥的作用,对于临床治疗血管损伤心血管疾病具有重要指导意义。
1 材料和方法
实验动物:2月龄健康雄性C57BL/6小鼠130只,体重为20~30 g,购自华中科技大学同济医学院实验动物中心。在本实验室采用常规饲料喂养,自由摄食喂水,适应性喂养1周后应用于实验。
主要试剂:M199细胞培养基,D-Hank’s平衡液,Percol分离液购自美国Hyclone公司;TGF-α、血管内皮生长因子(VEGF)购自美国Sigma公司;CD34-PE鼠抗人单克隆流式抗体、VEGFR-2-APC鼠抗人单克隆流式抗体购自美国B&D公司;VEGF、基质细胞衍生因子(SDF-1)、表皮生长因子(EGF)和碱性成纤维因子(bFGF)的酶联免疫吸附方法(ELISA)检测试剂盒购自武汉华美生物公司;内皮素-1(ET-1)的ELISA检测试剂盒购自厦门慧嘉生物科技公司;一氧化氮(NO)测定试剂盒购自南京建成生物工程研究所;依文思蓝染液、苏木素伊红(HE)染色液购自北京鼎国生物技术公司。
C57BL/6小鼠颈动脉损伤模型的建立:利用导丝损伤法建立C57BL/6小鼠颈动脉损伤模型[5]。选取2月龄C57BL/6健康雄性小鼠130只,用0.3%的戊巴比妥腹腔注射麻醉。小鼠取仰卧位,固定四肢和前上切牙后,碘酒消毒,取颈正中作颈部皮肤切口,钝性分离,打开右侧颈动脉鞘,充分暴露颈总动脉、颈外和颈内动脉;分别在颈总动脉近心端和颈内动脉远心端用丝线打活结结扎阻断血流,结扎颈外动脉远心端,选用弹性导丝经由颈外动脉插入颈总动脉,旋转来回推送导丝三次,使颈总动脉内皮剥落,达到颈总动脉损伤目的。退出导丝,结扎颈外动脉穿刺段,松开颈总和颈内动脉活结,可见血流恢复,缝合小鼠颈部切口。术后30 min后随机取5只小鼠损伤侧颈总动脉近分叉处约5 mm处血管,冲洗固定处理后,电镜扫描观察损伤动脉内皮剥落确保小鼠颈动脉损伤模型建立成功。
颈动脉损伤小鼠分组和干预方法:在颈动脉损伤小鼠中随机选取120只分成4组,每组30只。第一组仅注射生理盐水(0.2 ml/只)作为对照组;第二组注射TGF-α[每只10 nmol/(kg·ml),TGF-α组];第三组注射VEGF[每只10 nmol/(kg·ml),VEGF组];第四组同时注射TGF-α和VEGF[每只各10 nmol/(kg·ml),TGF-α+VEGF组]。
流式细胞术检测EPC动员情况:小鼠接受干预3 d后,每组各取10只,腹腔注射0.3%戊巴比妥溶液麻醉小鼠,经心脏取血约1 ml,用D-Hank’s平衡液等比例稀释。加入1.5倍体积的Percol分离液,1 200 g,离心30 min,取中间细胞层,再用D-Hank’s平衡液洗涤一遍,用M199细胞培养基重悬细胞分别加入PE-CD34和APC-VEGFR-2流式抗体各5
μl,室温避光孵育30 min后,PBS(0.01 M磷酸盐缓冲液,pH=7.4)洗涤2遍后,经流式细胞仪检测双阳性细胞比例。
ELISA方法测定血清VEGF、SDF-1、EGF和bFGF含量:四组小鼠接受干预3 d后,每组各取5只(系重复利用流式细胞术检测EPC动员情况的小鼠),按上述方法麻醉、经心脏取血。不加肝素室温静置30 min后,3 000 g离心20 min,取上清血清备用。分别根据ELISA试剂盒说明,检测各组外周血血清中血管损伤促修复因子VEGF、SDF-1、FGF、bFGF的含量变化。
血清ET-1和NO的检测:四组小鼠(每组20只)每组分别在接受干预3 d、7 d和14 d三个时间点时,各取5只留血清备用。分别用ELISA方法和分光光度法[6]测定各组颈动脉损伤小鼠血清中的ET-1和NO的含量变化,每组剩余5只小鼠备用。
依文思蓝染色检测损伤血管再内皮化情况:四组小鼠接受干预14 d时,每组各取5只(重复利用检测血清ET-1和NO的小鼠),麻醉并经尾静脉注射Evans blue 染液(25 mg/kg)。10 min后取小鼠损伤侧颈总动脉近颈动脉分叉处血管约5 mm。纵向切开小鼠颈总动脉,在显微镜下观察损伤动脉的再内皮化情况。在显微镜下拍照,采用Lucia软件测量染色血管和总血管面积,颈动脉损伤小鼠损伤血管再内皮化情况=内皮化面积/损伤血管总面积。
新生内膜增生情况检测:四组小鼠接受干预14 d时,每组各取5只(重复利用检测血清ET-1和NO的小鼠),按依文思蓝染色检测中的方法麻醉。手术取小鼠损伤侧颈总动脉近颈动脉分叉损伤端血管5 mm。用4%甲醛溶液固定后,进行石蜡包埋切片,HE染色,在显微镜下观察小鼠损伤颈总动脉的新生内膜增生情况,并获取图像。并用Lucia软件测量中膜和新生内膜面积,并计算新生内膜与中膜面积的比值。

2 结果
TGF-α对颈动脉损伤小鼠内皮祖细胞动员的影响:流式细胞分布图显示,干预3 d时,TGF-α能够显著促进EPC动员(图1A)。与对照组相比,TGF-α组小鼠外周血中CD34和VEGFR共同标记的EPC动员量显著增加(P<0.05);VEFG组小鼠外周血中EPC动员量则显著高于TGF-α组(P<0.05);而TGF-α+VEGF组小鼠外周血中EPC动员量均显著高于单独TGF-α组或VEGF组(P均<0.05)。图1B
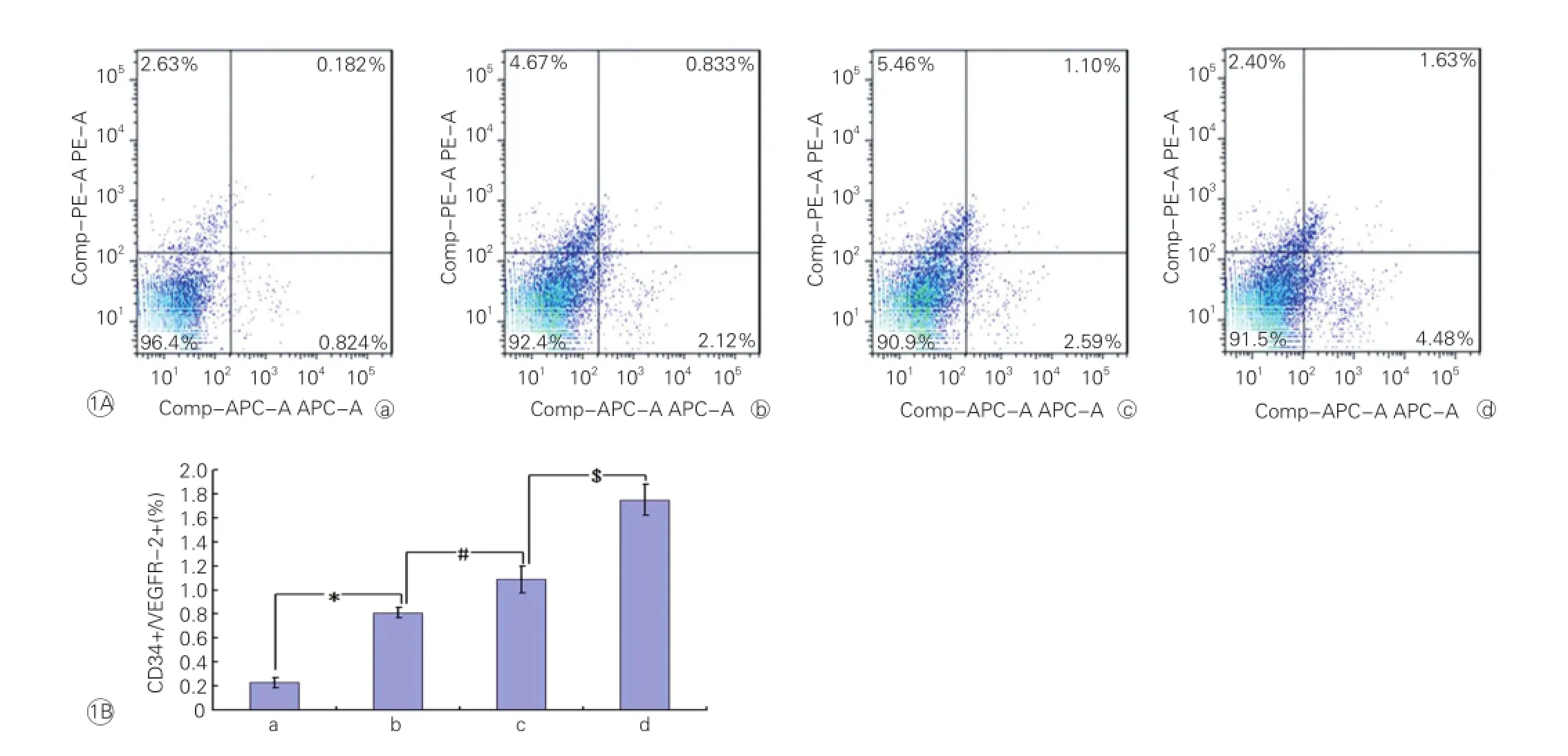
图1 转化生长因子-α对颈动脉损伤小鼠外周血内皮祖细胞动员影响
TGF-α对颈动脉损伤小鼠外周血中VEGF、SDF-1、EGF、bFGF的影响:各组小鼠在接受干预3 d后,与对照组相比,TGF-α组、VEGF组、TGF-α+VEGF组小鼠外周血血清中VEGF、SDF-1、EGF及bFGF含量均显著上升(P均<0.05)。与VEGF组相比,TGF-α+VEGF组小鼠外周血血清中VEGF、SDF-1、EGF及bFGF含量也显著升高(P<0.05)。表1
TGF-α对颈动脉损伤小鼠外周血中VEGF、SDF-1、EGF、bFGF的影响:各组小鼠在接受干预3 d后,与对照组相比,TGF-α组、VEGF组、TGF-α+VEGF组小鼠外周血血清中VEGF、SDF-1、EGF及bFGF含量均显著上升(P均<0.05)。与VEGF组相比,TGF-α+VEGF组小鼠外周血血清中VEGF、SDF-1、EGF及及bFGF含量也显著上升(P<0.05)。
TGF-α对颈动脉损伤小鼠外周血中ET-1和NO含量的影响:颈动脉损伤小鼠在接受干预3 d、7 d、14 d后,与对照组相比,TGF-α组、VEGF组及TGF-α+VEGF组中小鼠血清中ET-1含量均显著下降(P均<0.05),而NO分泌含量均显著上升(P均<0.05)。随着注射时间的延长,各组小鼠的ET-1含量逐渐下降(P均<0.05),NO含量则逐渐上升(P均<0.05),差异均有统计学意义。表2
表1 四组颈动脉损伤小鼠外周血中促血管修复因子含量测定
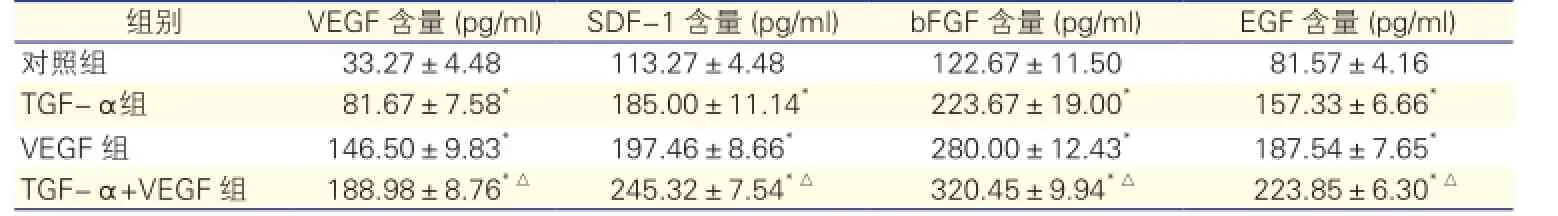
表1 四组颈动脉损伤小鼠外周血中促血管修复因子含量测定
注:与对照组相比*P<0.05;与VEGF组相比△P<0.05。SDF-1:基质细胞衍生因子 bFGF:碱性成纤维因子EGF:表皮生长因子。余注见图1
?
表2 转化生长因子-α对四组颈动脉损伤小鼠血清内皮素-1和一氧化氮水平的影响
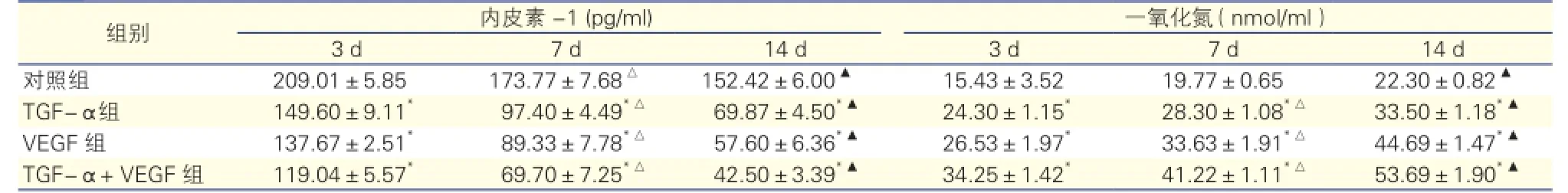
表2 转化生长因子-α对四组颈动脉损伤小鼠血清内皮素-1和一氧化氮水平的影响
注:与对照组相比*P<0.05;与3 d时相比△P<0.05;与7 d时相比▲P<0.05。余注见图1
?
TGF-α对颈动脉损伤小鼠损伤血管再内皮化的影响:颈动脉损伤小鼠在接受干预14 d时,与对照组相比,TGF-α组和VEGF组中血管再内皮化面积均明显增加(P均<0.05);TGF-α+VEGF组中血管再内皮化面积最多,显著高于对照组、TGF-α组和VEGF组,差异有统计学意义(P<0.05)。图2
TGF-α对颈动脉损伤小鼠损伤血管新生内膜增生的影响:颈动脉损伤小鼠在接受干预14 d后,显微镜(200×)下HE染色形态学观察显示,对照组中内膜增生情况较为严重,堵塞血管,孔径变小(图3a);TGF-α组和VEGF组中内膜增生情况变轻,血管孔径较大(图3b、3c);而TGF-α+VEGF组中血管新生内膜增生最少,血管通畅(图3d)。利用软件统计比较发现,与对照组相比,TGF-α组、VEGF组、TGF-α+VEGF组中新生内膜增生面积以及新生内膜与中膜面积相对比值均显著下降,差异有统计学意义(P均<0.05)。图4
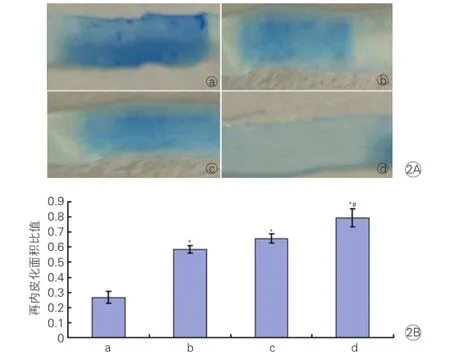
图2 转化生长因子-α对颈动脉损伤小鼠损伤血管再内皮化的影响

图3 苏木素伊红染色检测损伤血管新生内膜增生情况

图4 转化生长因子-α对颈动脉损伤小鼠血管新生内膜增生的影响
3 讨论
血管内皮损伤被认为是动脉粥样硬化和血管成形术后再狭窄的主要病理原因之一,而针对血管内皮的再生及修复是治疗高血压、冠心病等心血管疾病的关键[7]。EPC作为内皮细胞的前体细胞,当血管损伤时可以从骨髓动员至外周血直接分化为血管内皮细胞[8]。研究表明[9],机体外周血中EPC含量增加时可以直接修复损伤血管,其主要通过循环至血管损伤部位加快分化成内皮细胞,从而抑制损伤血管的内膜增生和血栓形成,降低血管再狭窄率。TGF-α作为多功能性的细胞生长因子,其生物学功能广泛而复杂,能根据靶组织和细胞不同生理状态而发挥不同作用。研究表明,TGF-α有利于多种干细胞的生长分化和细胞的修复,在促进损伤愈合及组织修复中均能发挥积极作用[10]。但目前关于TGF-α在血管损伤修复中发挥的作用及其作用机制尚未见研究。本文利用C57BL/6小鼠建立颈动脉损伤模型,通过流式细胞仪检测发现,TGF-α与VEGF均能显著促进小鼠体内EPC从骨髓动员至外周血中。VEGF已被证实可以通过动员EPC促进血管损伤修复和新血管形成[11],本研究中TGF-α的EPC动员作用相对弱于VEGF,但TGF-α+VEGF组中EPC动员作用均高于TGF-α组和VEGF组,说明TGF-α与VEGF在血管损伤EPC动员中能够发挥协同作用。
已有研究[12,13]证明,VEGF、SDF-1、EGF、bFGF等细胞因子均参与血管内皮损伤的修复作用,可以诱导促进血管的新生并能调节EPC的动员、迁移。本研究中利用ELISA方法检测发现,TGF-α组中VEGF、SDF-1、EGF、bFGF细胞因子的浓度均显著高于对照组,说明TGF-α可能通过促进外周血中VEGF、SDF-1、EGF、bFGF等促血管修复因子分泌水平进而刺激EPC动员。ET-1和NO是生物体内与血管相关的十分重要的活性物质,参与血管收缩、舒张和内皮细胞增殖分化等许多生理和病理反应过程。有研究表明[6],血管损伤时ET-1会显著上升,而ET-1含量可以反映血管损伤程度;内皮细胞分泌NO含量可以反映其功能强弱,也可以间接反映血管内皮损伤的修复程度。血管内皮功能的恢复取决于ET-1和NO对血管舒缩功能的平
衡,各种机制导致内皮细胞ET-1的生成和NO的减少被认为是血管内皮功能损伤的机制之一[14]。本研究中TGF-α注射处理颈动脉损伤小鼠后,发现其外周血中ET-1含量会显著下降而NO分泌含量则显著上升,并随着处理时间的延长效应越明显,说明TGF-α有利于血管损伤后的内皮功能修复。
EPC从骨髓动员到外周血后,能够及时迁移到血管损伤部位发生再内皮化对血管损伤修复起着重要作用[15]。本研究中利用依文思蓝染色检测颈动脉损伤小鼠损伤血管段再内皮化情况,发现TGF-α可以增加血管再内皮化相对面积,显著促进损伤血管的再内皮化,说明TGF-α对血管损伤修复再内皮具有积极作用。另有研究证实[16],损伤血管内皮功能受损容易发生增生性再狭窄现象,而血管的再内皮化可以有效抑制血管新生内膜增生。本研究利用HE染色从形态学上观察颈动脉损伤小鼠血管新生内膜增生情况,同时检测血管新生内膜面积、新生内膜与中膜相对面积比对内膜增生进行评价。结果发现,TGF-α组和VEGF组中颈动脉损伤小鼠血管新生内膜面积及内中膜面积比都显著降低,说明TGF-α和VEGF都能够有效抑制损伤血管的内膜增生,对血管进行修复维持血管通畅。
综上所述,通过研究发现,TGF-α能够促进颈动脉损伤小鼠外周血中EPC动员,刺激VEGF、SDF-1、EGF、bFGF等促血管修复因子分泌,增强损伤血管再内皮化能力并抑制新生内膜增生,从而对损伤血管修复发挥积极作用。本研究对于临床治疗心血管疾病中血管内皮损伤修复具有重要参考价值。
[1] Young M, Cuculi F, Erne P. PTCA with drug-coated balloons is associated with immediate decrease of coronary flow reserve. Catheter Cardiovasc Interv, 2013, 81: 682-686.
[2] 郝青青, 张永欢, 于庆涛, 等. 血管紧张素转换酶 2 基因转染对内皮细胞的保护作用. 中国循环杂志, 2014, 10: 841-845.
[3] 董莉, 孙佳音, 康丽娜, 等. 氨氯地平对糖尿病大鼠心肌梗死后骨髓内皮祖细胞动员及血管新生的改善作用. 中国循环杂志, 2014, 9: 718-722.
[4] 李点玲, 张桂英. 瘦素和 TGF-α 在幽门螺杆菌感染慢性胃炎和胃溃疡患者胃黏膜内的表达及意义. 世界华人消化杂志, 2005, 13: 2795-2798.
[5] 尹扬光, 黄岚, 赵晓辉, 等. 非显微外科手术建立小鼠颈动脉损伤模型. 中国应用生理学杂志, 2008, 24: 34-35.
[6] Adiarto S, Heiden S, Vignon-Zellweger N, et al. ET-1 from endothelial cells is required for complete angiotensin II-induced cardiac fibrosis and hypertrophy. Life Sci, 2012, 91: 651-657.
[7] Kohno T, Urao N, Ashino T, et al. Novel role of copper transport protein antioxidant-1 in neointimal formation after vascular injury. Arterioscler Thromb Vasc Biol, 2013, 33: 805-813.
[8] Liu X, Li Y, Liu Y, et al. Endothelial progenitor cells (EPC) mobilized and activated by neurotrophic factors may contribute to pathologic neovascularization in diabetic retinopathy. Am J Pathol, 2010, 176: 504-515.
[9] Briasoulis A, Tousoulis D, Antoniades C, et al. The role of endothelial progenitor cells in vascular repair after arterial injury and atherosclerotic plaque development. Cardiovas Ther, 2011, 29: 125-139.
[10] 陈建国, 孟庆楠, 赵德梅, 等. 胰岛素样细胞生长因子-1, 碱性成纤维细胞生长因子及转化生长因子-a对人表皮干细胞增殖的影响. 医学研究生学报, 2012, 25: 789-792.
[11] Dragoni S, Laforenza U, Bonetti E, et al. Vascular endothelial growth factor stimulates endothelial colony forming cells proliferation and tubulogenesis by inducing oscillations in intracellular Ca2+concentration. Stem Cells, 2011, 29: 1898-1907.
[12] Kuliszewski M A, Kobulnik J, Lindner J R, et al. Vascular gene transfer of SDF-1 promotes endothelial progenitor cell engraftment and enhances angiogenesis in ischemic muscle. Mol Ther, 2011, 19: 895-902.
[13] Sufen G, Xianghong Y, Yongxia C, et al. bFGF and PDGF-BB have a synergistic effect on the proliferation, migration and VEGF release of endothelial progenitor cells. Cell Biol Int, 2011, 35: 545-551.
[14] Kamide T, Kitao Y, Takeichi T, et al. RAGE mediates vascular injury and inflammation after global cerebral ischemia. Neurochem Int, 2012, 60: 220-228.
[15] Asahara T, Kawamoto A, Masuda H. Concise review: circulating endothelial progenitor cells for vascular medicine. Stem Cells, 2011, 29: 1650-1655.
[16] Cui B, Huang L, Fang Y, et al. Transplantation of endothelial progenitor cells overexpressing endothelial nitric oxide synthase enhances inhibition of neointimal hyperplasia and restores endothelium-dependent vasodilatation. Microvasc Res, 2011, 81: 143-150.
Effect of Transforming Growth Factor-α on Vascular Repair in Experimental Mice With Carotid Artery Injury
DAI Wen-Jing, ZHANG Jun, ZHOU Jing-Qun, XIANG Chang-Qing, WANG Gang.
Department of Cardiology, Renhe Hospital, Three Gorges University, Yichang (443000), Hubei, China
Objective: To study the effect of transforming growth factor-α (TGF-α) on vascular repair in experimental mice with carotid artery injury with its mechanism.
Transforming growth factor-α; Vascular injury; endothelial progenitor cell mobilization; Reendothelialization; Intimal hyperplasia
2014-07-22)
(编辑:朱柳媛)
湖北省教育厅自然科学研究计划重点项目(D20091308)
443000 湖北省宜昌市,三峡大学仁和医院 心血管内科(代文静、周敬群、向常清、王刚),重症医学科(张军)
代文静 主治医师 硕士 研究方向为心血管疾病分子机制 Email: daiwenjing08@163.com 通讯作者:周敬群
Email: zhoujingqun-1@medmail.com.cn
R54
A
1000-3614(2015)04-0384-06
10.3969/j.issn.1000-3614.2015.04.020
