内镜下治疗未分化型早期胃癌的临床研究
2015-12-15李华霍志斌吴殿超翟同善肖琦海王淑霞张丽丽
李华 霍志斌 吴殿超 翟同善 肖琦海 王淑霞 张丽丽
内镜下治疗未分化型早期胃癌的临床研究
李华霍志斌吴殿超翟同善肖琦海王淑霞张丽丽
摘要目的:探讨未分化型早期胃癌淋巴结转移的危险因素,从而对未分化型早期胃癌患者行内镜下治疗提供理论依据。方法:回顾性分析河北医科大学附属邢台市人民医院肿瘤外科1996年1月至2008年12月90例未分化型早期胃癌的临床病理资料,按照临床病理特征与淋巴结转移的关系进行统计学分析。结果:通过多因素分析,肿瘤大小>2 cm,淋巴管癌栓和黏膜下癌对淋巴结转移的差异具有统计学意义(P<0.05)。无危险因素的患者,淋巴结转移率为0;3个危险因素均有者,淋巴结转移率高达57.1%。结论:肿瘤大小>2 cm,存在淋巴管癌栓和黏膜下癌是未分化型早期胃癌淋巴结转移的独立危险因素。对于无危险因素的患者,行内镜下切除是可行的。
关键词早期胃癌淋巴结转移临床病理特征内镜下黏膜切除术内镜黏膜下剥离术
自1881年Billroth实施了第1例胃癌手术以来,外科手术一直是胃癌治疗的基本方法和主要手段。由于早期胃癌术后5年生存率可达94%~96%,因此其治疗的目标逐渐由提高患者生存率转向追求生存质量[1-3]。近年,由于内镜治疗技术的迅猛发展和新的内镜下治疗器械的不断开发和应用,使得早期胃癌在内镜下治疗成为可能。早期胃癌内镜下治疗主要有内镜下黏膜切除术(endoscopic mucosal resec⁃tion,EMR)和内镜黏膜下剥离术(endoscopic submu⁃cosal dissection,ESD)。ESD技术是由EMR发展而来,因其具有较高的整块切除率,显著地减少病灶的残留及复发,从而达到对早期胃癌根治切除的效果。EMR和ESD技术的开展实现了消化内镜由早期胃癌的诊断向微创治疗的转变。日本《胃癌治疗指南》(第3版)规定EMR和ESD的绝对适应证为:2 cm以下肉眼可见的黏膜内癌,组织类型为分化型,无论何种大体类型,有无溃疡病灶[4]。而对未分化的早期胃癌须行胃癌根治术,这与淋巴结转移率高有关。然而,对于行胃癌根治手术的96%未分化型早期黏膜内癌患者,术后病理证实淋巴结转移阴性[5]。故对于这部分患者的胃癌根治术是治疗过度。本研究回顾性分析未分化型早期胃癌患者的临床病理特点与淋巴结转移的关系,从而对未分化型早期胃癌患者行内镜下切除提供理论依据。
1 材料与方法
1.1一般资料
河北医科大学附属邢台市人民医院肿瘤外科于1996年1月至2008年12月收治并施行手术治疗胃癌患者2 117例,其中未分化型早期胃癌90例。本组患者男性64例,女性26例;年龄31~80岁,平均年龄51岁。其中贲门胃底癌7例,胃体癌9例,胃窦癌74例。全部病例均经手术、病理组织学证实为未分化型早期胃癌。
1.2方法
1.2.1淋巴结清扫全部病例行D1以上的淋巴结清扫,具体淋巴结清扫范围D1+NO.7胃左动脉干淋巴结、NO.8肝总动脉干淋巴结、NO.9腹腔动脉周围淋巴结和D2清扫。全组病例淋巴结检出数均≥15枚,<15枚视为病例资料不全排除。
1.2.2选取方法本组患者在术前均行胃钡餐透视、CT、胃镜检查及活检,在病灶性质和位置明确后方进行手术。术中切除标本离体后,沿大弯侧将胃纵形剪开(癌灶在大弯侧时沿小弯剪开),摊平,擦净血迹后初步明确病灶部位、范围、数量及边缘情况,经术者认定后送病理,并行以下处理。逐一摘除淋巴结,按组分别装瓶,摊平标本,按U、M、L区测量每个癌灶大小,肉眼观察形态,再将所有标本置入10%福尔马林溶液中固定24~48 h后进行观察,行病理学检查。最终诊断以术后病理学诊断为准(图1,2)。
图1未分化型早期胃癌(H&E×200)Figure1 Pathologicalimageofundifferentiatedearlygastriccancer(H&E×200)

图2未分化型早期胃癌淋巴结转移(H&E×200)Figure 2 Pathological image of lymph node metastasis(H&E×200)
1.2.3临床病理因素探讨不同临床病理特征与淋巴结是否存在转移之间的联系。临床因素:性别、年龄、家族史、肿瘤数目、肿瘤位置、肿瘤大小。病理因素:组织学类型、淋巴管癌栓、浸润深度。组织学分型、大体分型、淋巴结分组参照日本《胃癌治疗指南》(第3版)[4]。
1.3统计学处理
使用SPSS 18.0统计学软件进行数据分析。单因素分析采用χ2检验。采用Logistic回归模型进行多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1临床病理特征与淋巴结转移的关系
通过单因素分析,肿瘤大小(P=0.018)、淋巴管癌栓(P<0.001)和浸润深度(P=0.003)对淋巴结转移率的差异有统计学意义(表1)。性别、年龄、家族史、肿瘤数目、肿瘤位置、大体分型对淋巴结转移率的差异均无统计学意义(P>0.05)。
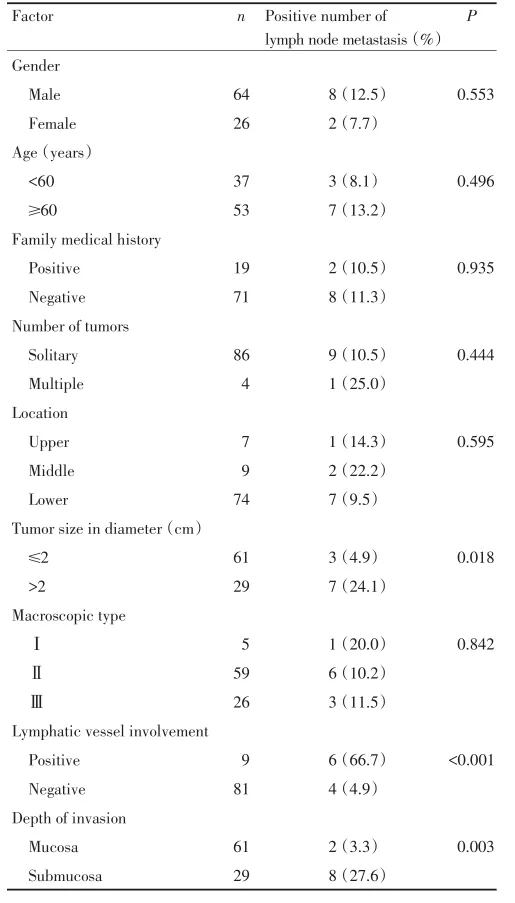
表1单变量分析淋巴结转移的影响因素Table 1 Univariate analysis of factors influencing lymph node metastasis
2.2多因素分析淋巴结转移独立危险因素
经过多因素分析,肿瘤大小>2 cm(OR=2.015,P=0.038)、存在淋巴管癌栓(OR=191.519,P=0.018)和黏膜下癌(OR=102.269,P=0.022)是淋巴结转移独立的危险因素(表2)。
2.3危险因素的数目与淋巴结转移的关系
本组患者11.1%(10/90)发生淋巴结转移。无危险因素(肿瘤大小>2 cm、存在淋巴管癌栓和黏膜下癌)的患者发生淋巴结转移的比例为0(0/28);具有1个危险因素者发生淋巴结转移的比例为4.9%(2/41);具有2个危险因素者发生淋巴结转移的比例高达28.6%(4/14);3个危险因素均有者发生淋巴结转移的比例高达57.1%(4/7)(表3)。
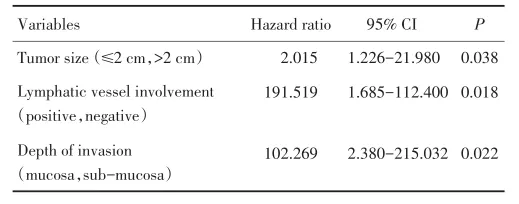
表2多变量分析淋巴结转移的影响因素Table 2 Multivariate analysis of factors influencing lymph node metastasis

表3危险因素数目与淋巴结转移率的关系Table 3 Correlation between the number of risk factors and the rate of nodal metastasis
3 讨论
目前早期胃癌检出率逐年升高,占我国胃癌病例的6%~19%。如何在不影响患者生存率的前提下,采用微创技术使早期胃癌患者既能安全和有效地进行手术治疗,又能减轻手术创伤、改善生存质量,是目前国内外该领域研究的一大热点[6-7]。早期胃癌的治疗可选择手术及内镜下治疗,外科手术虽然可以完全切除病灶,预后良好,但存在创伤大、恢复慢、术后并发症多等缺点。随着近年内镜技术的发展,消化内镜在早期胃癌的早期诊断和治疗中发挥越来越重要的作用,内镜下治疗具有创伤小、并发症少、恢复快、生存质量高、费用低等优点[8-10]。
内镜下治疗早期胃癌的方法有EMR和ESD。随着内镜技术的进步与内镜器械的改进,EMR不断得到改进和创新,透明帽法、套扎法、分片切除法等方法和手段在临床上获得广泛应用。ESD是近年应用于临床的一项新内镜治疗技术,这项技术开始有很多别名,如裁剪型EMR、剥落型EMR和圆周切除型EMR,于2003年正式命名ESD。与既往使用的EMR比较,ESD用一根普通单通道内镜对病变进行整块切除,一次性切除较大病灶,切除病灶的深度达到固有肌层,不但实现了大面积病变的整块切除,并且提供了准确的病理分期以预防复发。根据日本《胃癌治疗指南》(第3版)规定的EMR和ESD绝对适应证,目前对于内镜下治疗应用于未分化型早期胃癌的相关研究甚少。
淋巴结无转移是未分化型早期胃癌接受内镜手术的先决条件。目前国内外学者认为肿瘤大小、淋巴管癌栓、大体和组织学分型是早期胃癌淋巴结发生转移的危险因素[11-13]。本研究结果认为肿瘤大小>2 cm、存在淋巴管癌栓和癌侵及黏膜下层是未分化型早期胃癌淋巴结转移的独立危险因素。
本研究对影响淋巴结转移危险因素的数目与淋巴结转移的关系结果显示:病例无危险因素的患者,淋巴结转移率为0,提示内镜下切除对于此类患者较适合,因此不需要行胃癌根治术。但是对于具有淋巴结转移危险因素的患者,淋巴结转移率为4.9%~57.1%,提示行胃癌根治术也是不可避免的。
早期胃癌的内镜下治疗是基于术前对淋巴结转移状况、病灶浸润深度和大小判断而实施的。确保了手术的根治程度,在保证肿瘤彻底切除的同时最大限度保留正常组织,创伤小、患者易耐受,并可一次进行多部位治疗或接受多次治疗[14]。对存在血管(淋巴管)浸润及侵犯、淋巴结转移等高危因素者可行开腹、腹腔镜等补救手术。术后也可获得完整的病理标本并提供准确的肿瘤分期、分型用于评估预后和指导后续治疗。在严格选择适应证情况下,开腹手术和内镜手术的5年生存率差异无统计学意义,均在90%以上[15]。因此,早期胃癌内镜下切除可以获得与开腹手术同样的效果。EMR、ESD作为一类微创内镜技术、创伤性小、并发症少、疗效可靠,近年来被国内外广泛应用于临床,并取得了良好的效果。随着医学科学的发展,疾病治疗越来越趋向于微创、高效、安全和广泛的适用性,人们对治疗后生存质量的要求也在不断提高,内镜下早期胃癌切除技术的不断发展将为广大患者提供更多的治疗选择,提高我国有限医疗资源的利用率。
综上所述,本研究提示肿瘤大小>2 cm,存在淋巴管癌栓和黏膜下癌是未分化型早期胃癌淋巴结转移的独立危险因素。对于无危险因素的患者,行内镜下切除是可行的;对于具有危险因素的患者,可以实施胃癌根治术治疗。
参考文献
[1]Kwon IG, Cho L, Guner A, et al. Minimally invasive surgery as a treatment option for gastric cancer in the elderly: comparison with open surgeryfor patients 80 years and older[J]. Surg Endosc, 2015, 29(8):2321-2330.
[2]Huo ZB, Chen SB, Zhang J, et al. Risk clinicopathological factors for lymph node metastasis in poorly differentiated early gastric cancer and their impact on laparoscopic wedge resection[J]. World J Gastroenterol, 2012, 18(44):6489-6493.
[3]Sung CM, Hsu CM, Hsu JT, et al. Predictive factors for lymph node metastasis in poorly differentiated early gastric cancer[J]. World J Gastroenterol, 2010, 16(41):5252-5256.
[4]Japanese Gastric Cancer Association. Japanese classification of gastric carcinoma. 3rd English edition[J]. Gastric Cancer, 2011, 14(2):101-112.
[5]Inokuchi Y, Kobayashi M, Kudo K, et al. Outcomes and precautions of endoscopic submucosal dissection for undifferentiated-type early gastric cancer[J]. Therap Adv Gastroenterol, 2015, 8(5):225-262.
[6]Lee JH, Kim JG, Jung HK, et al. Clinical practice guidelines for gastric cancer in Korea: an evidence-based approach[J]. J Gastric Cancer, 2014, 14(2):87-104.
[7]Oka S, Tanaka S, Kaneko I, et al. Advantage of endoscopic sub⁃mucosal dissection compared with EMR for early gastric cancer[J]. Gastrointest Endosc, 2006, 64(6):877-883.
[8]Junq Y, Kato M, Lee J, et al. Effectiveness of circumferential endo⁃scopic mucosal resection with a novel tissue-anchoring device[J]. World J Gastrointest Endosc, 2013, 5(6):275-280.
[9]Ishikawa S, Togshi A, Inoue M, et al. Indications for EMR/ESD in cases of early gastric cancer: relationship between histological type, depth of wall invasion, and lymph node metastasis[J]. Gastric Cancer, 2007, 10(1):35-38.
[10]Oda I, Saito D, Tada M, et al. A multicenter retrospective study of endoscopic resection for early gastric cancer[J]. Gastric Cancer, 2006, 9(4):262-270.
[11]Kim YY, Jeon SW, Kim J, et al. Endoscopic submucosal dissection for early gastric cancer with undifferentiated histology: could we extend the criteria beyond[J]. Surq Endosc, 2013, 27(12):4656-4662.
[12]Lee HJ, Kim GH, Park do Y, et al. Is endoscopic submucosal dis⁃section safe for papillary adenocarcinoma of the stomach[J]? World J Gastroenterol, 2015, 7(21):3944-3993.
[13]Li C, Kim S, Lai JF, et al. Risk factors for lymph node metastasis in undifferentiated early gastric cancer[J]. Ann Surg Oncol, 2008, 15(3): 764-769.
[14]Nakanishi T, Araki H, Ozawa N, et al. Risk factors for pyrexia after endoscopic submucosal dissection of gastric lesions[J]. Endosc Int Open, 2014, 2(3):141-147.
[15]Yoshioka T, Nishida T, Tsujii M, et al. Renal dysfunction is an in⁃dependent risk factor for bleeding after gastric ESD[J]. Endosc Int Open, 2015, 3(1):39-45.
(2015-07-13收稿)
(2015-09-10修回)
(编辑:邢颖)
李华专业方向为早期胃癌微创外科治疗。
E-mail:lihua200626478@126.com

·国家基金研究进展综述·
作者单位:河北医科大学附属邢台市人民医院肿瘤外科(河北省邢台市054001)
Endoscopic therapy in undifferentiated early gastric cancer
Hua LI, Zhibin HUO, Dianchao WU, Tongshan ZHAI, Qihai XIAO, Shuxia WANG, Lili ZHANG
Correspondence to: Hua LI; E-mail: lihua200626478@126.com
The Second Department of Surgical Oncology, Xingtai People's Hospital Affiliated to Hebei Medical University, Xingtai 054001, China.
AbstractObjective: To investigate the clinicopathological factors predictive of lymph node metastasis(LNM)in undifferentiated early gastric cancer(EGC)and to expand the possibility of endoscopic therapy for treating undifferentiated EGC.Methods: The researchers collected the data of 90 undifferentiated EGC patients who had undergone surgery at the Xingtai People's Hospital, Xingtai, China. The relationship between LNM and clinicopathological factors was retrospectively analyzed using univariate and multivariate logistic regression analyses. Results: Univariate analysis showed that tumor size, lymphatic vessel involvement(LVI), and cancer invasion depth were the significant and independent risk factors for LNM. The LNM rate was 57.1% in patients with the three clinicopathological risk factors. LNM was not found in patients without the three risk factors. Conclusion: Tumor size, LVI, and invasion depth are independently associated with the presence of LNM in undifferentiated EGC. Endoscopic therapy can be used to treat the patients without risk factors.
Keywords:early gastric cancer, lymph node metastasis, clinicopathological characteristics, endoscopic mucosal resection, endoscopic submucosal dissection
作者简介
通信作者:李华lihua200626478@126.com
doi:10.3969/j.issn.1000-8179.2015.19.767
