腹腔热灌注化疗对腹腔游离癌细胞杀灭效果的评价*
2015-12-15姬忠贺孙建华武海涛张倩彭开文李雁
姬忠贺孙建华武海涛张倩彭开文李雁②
腹腔热灌注化疗对腹腔游离癌细胞杀灭效果的评价*
姬忠贺①孙建华①武海涛①张倩①彭开文①李雁①②
摘要目的:评估腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)对腹腔游离癌细胞的杀灭作用,探索腹膜癌细胞学根治的可行性。方法:收集45例腹膜转移癌患者HIPEC前、后的腹腔灌洗液(或腹水)样本,分别行腹腔灌洗液细胞学(peritoneal lavage cytology,PLC)检查;普通RT-PCR及实时定量RT-PCR检测CEA mRNA、CK20 mRNA;化学发光法检测HIPEC前、后患者血清肿瘤标志物CEA、CA125、CA19-9;分析各项指标HIPEC前、后的变化特点。结果:HIPEC前、后PLC检查阳性率分别为93.3% vs. 24.4%(P<0.001);CEA mRNA阳性率分别为97.8% vs. 84.4%(P=0.058);CK20 mRNA阳性率HIPEC前、后均为95.6%(P=1.000)。分别有32.5%和30.0%的患者HIPEC后CEA mRNA表达量、CK20 mRNA表达量较HIPEC前显著下降(均P<0.001)。HIPEC前、后CEA、CA125、CA19- 9阳性率分别为50.0% vs. 23.6%(P=0.016)、52.6% vs. 47.4%(P=0.409)、36.8% vs. 26.3%(P=0.121)。结论:HIPEC可有效杀灭腹腔游离癌细胞,为实现腹膜癌的细胞学根治提供了一个可行的方法。
关键词腹膜癌腹腔游离癌细胞腹腔热灌注化疗
腹腔游离癌细胞(intraperitoneal free cancer cells,IFCCs)是胃肠道及卵巢恶性肿瘤腹膜复发转移的病理学基础。腹膜转移癌(peritoneal carcinomatosis,PC)一旦发生,预后极差,中位生存期不足6个月[1]。
传统观点认为,IFCCs阳性的胃肠道肿瘤患者不适用标准根治性手术,简单器官病灶切除术是最佳的治疗策略。近30年来,细胞减灭术(cytoreductive surgery,CRS)加腹腔热灌注化疗(hyperthermic intra⁃peritoneal chemotherapy)综合治疗策略逐渐发展为PC治疗的有效手段,其优势在于通过CRS消除可见肿瘤,通过HIPEC杀灭微转移灶和IFCCs[2]。
本单位自2003年起重点开展CRS+HIPEC治疗PC的新技术研究,证实该策略能延长胃癌[1]、结直肠癌[3]PC患者的生存期。本研究收集HIPEC前、后的腹腔灌洗液,通过检测IFCCs含量变化、肿瘤相关分子及肿瘤标志物表达水平,评估HIPEC对IFCCs的杀灭作用。
1 材料与方法
1.1临床资料
收集2014年10月至2015年6月在武汉大学中南医院肿瘤科接受CRS+HIPEC治疗患者的临床资料。主要纳入标准:1)KPS评分>50分;2)年龄20~75岁;3)血常规、肝、肾功能基本正常;4)心、肺功能正常。主要排除标准:1)年龄<20岁或>75岁;2)术前检查发现肝、肺等远处转移或广泛腹膜后淋巴结转移;3)血常规、肝、肾功能明显异常;4)术前评估不能耐受该手术者。
1.2治疗方法
45例患者均在专门的腹膜癌治疗团队配合下手术。患者全麻后摆截石位或“大”字位,取剑突至耻骨联合的长正中切口,开腹后从膈面腹膜到盆腔腹膜探查肿瘤侵袭程度及PC范围,记录腹水量、原发瘤和(或)PC的大小、部位,进行腹膜癌指数(peritoneal cancer index,PCI)评分。凡能完全缩瘤者行根治性切除,不能完全缩瘤者,行最大程度CRS,手术结束后行细胞减灭程度评分(completeness of cytoreduction,CC)。CRS完成后即行开放式非循环HIPEC,药物为洛铂100 mg联合多西他赛120 mg,分别溶解于6 000 mL生理盐水中,进行HIPEC,灌注温度(43±0.5)℃,流量400 mL/min,时间60 min。HIPEC结束后行消化道重建,减张缝合切口,送ICU监护,稳定后转普通病房。本研究通过本院伦理委员会审核。
1.3标本采集与处理
手术开腹时,有腹水者用注射器直接抽取腹腔深部(脾窝、陶氏腔、结肠旁沟)腹水约50 mL;无腹水者,开腹后立即将100 mL生理盐水灌洗腹腔,轻微搅动后抽取约50 mL灌洗液。HIPEC治疗后直接吸取腹腔深部化疗液约50 mL。所有样本均分为3等份,4℃离心10 min(2 000 rpm),所得沉淀1份立即涂片行腹腔灌洗液细胞学检查(peritoneal lavage cytology,PLC),其余2份于-80℃冻存待行PCR检测。
1.4 PLC检查
取离心后沉淀,直接涂片2张,瑞氏染色法染色后于光镜下观察,使用Olympus BX51显微镜观察染色结果并使用Olympus DP72图像系统采集图像。检查结果由高年资细胞病理学医生判读,发现符合癌细胞形态学特征的细胞即为阳性,如细胞核大、深染、畸形、核浆比失常、异常核分裂像、核仁增大、出现瘤巨细胞等。
1.5 PCR检查
1.5.1 RNA提取与逆转录总RNA的提取采用天根生化科技(北京)有限公司提供的RNAsimpleTotal RNA kit试剂盒,取-80℃冻存样本,解冻后按说明书操作提取总RNA,紫外分光光度法检测含量和纯度,1.5%琼脂糖电泳检测RNA完整性。逆转录采用Thermo Scientific(美国)RevertAid™第一链cDNA Syn⁃thesis试剂盒,按说明书操作,逆转录合成cDNA。
1.5.2普通RT-PCR每例标本均使用癌胚抗原(carcinoembryonic antigen,CEA)、细胞角蛋白20(Cy⁃tokeratin-20,CK20)特异性引物扩增,同时用管家基因GAPDH检测完整性,并分别设置胃癌细胞株SGC7901 RNA样本作为阳性对照,不含RNA的样本作阴性对照。普通RT-PCR反应采用20 μL反应体系:10 μL 2×Taq MasterMix(北京康为世纪生物科技有限公司),1 μL上游引物,1 μL下游引物,1 μL cDNA模板,7 μL RNase-Free Water。特异性引物序列见表1,引物由生工生物工程(上海)股份有限公司合成。反应条件分别为:CEA:94℃变性1 min,72℃退火并延伸2.5 min,35个循环;CK20:94℃变性1 min,60℃退火45 s,72℃延伸45 s,38个循环;GAPDH:94℃变性30 s,58℃退火30 s,72℃延伸45 s,35个循环。取扩增产物6 μL行1.5%琼脂糖凝胶电泳,溴化乙锭染色,凝胶成像系统扫描记录结果。
1.5.3实时定量RT-PCR按照SYBRPremix Ex TaqⅡ(Takara)试剂盒说明书操作,反应体系为20 μL (SYBR Premix Ex TaqⅡ10 μL,cDNA模板1 μL,上游引物1 μL,下游引物1 μL,RNase-Free water 7 μL),引物同上(表1),阴、阳性对照同上。在CFX96 Real-Time PCR Detection System(Bio-Rad)仪器上进行PCR反应,反应条件为:94℃预变性3 min,94℃变性30 s,60℃退火30 s,72℃延伸45 s,40个循环。溶解曲线温度均一,峰的形状锐利,无杂峰,说明扩增产物特异性良好,采用2-ΔΔct法,以GAPDH为参照,定量HIPEC前后CEA mRNA、CK20 mRNA变化。
1.6血清肿瘤标志物检测
分别于术前第3天及术后第7天,采集患者静脉血并立即分离血清,采用罗氏E601型全自动电化学发光分析仪,检测血清CEA、糖类抗原125(carbohy⁃drate antigen 125,CA125)、糖类抗原19-9(carbohy⁃drate antigen,CA19-9)的含量,三者的正常值分别为<5 ng/mL、<35 U/mL、<37 U/mL。

表1引物序列Table 1 Primer sequences
1.7统计学分析
所有数据均采用SPSS 20.0进行统计分析。计量资料用x±s表示,组间比较采用配对t检验;计数资料采用χ2检验、Fisher确切概率法双向检验。P<0.05为差异有统计学意义。
2 结果
2.1主要临床病理特征
本研究共纳入45例患者,其中胃癌13例,结直肠癌17例,卵巢癌9例,阑尾黏液腺癌6例,均经病理确诊(表2)。
2.2 PLC结果
HIPEC前PLC阳性率为93.3%(42/45),HIPEC后阳性率为24.4%(11/45),呈显著下降(P<0.001)。11例无明显PC的患者中,HIPEC前9例(81.8%,9/11)PLC阳性,HIPEC后均转阴性(图1)。
2.3普通RT-PCR检测结果
各样本内参照GAPDH均在相应位置出现明显扩增条带,阳性对照显示清晰(图2)。
45例患者中HIPEC前CEA mRNA阳性率为97.8%(44/45),HIPEC后阳性率为84.4%(38/45),差异无统计学意义(P=0.058)。HIPEC前CK20 mRNA阳性率为95.6%(43/45),HIPEC后阳性率仍为95.6%(43/45)。
2.4实时定量RT-PCR结果
40例患者行实时定量RT-PCR检测,HIPEC前后相对定量分析显示(图3),32.5%(13/40)患者HIPEC后CEA表达量较HIPEC前显著下降(P<0.001);30.0% (12/40)患者HIPEC后CK20表达量较HIPEC前显著下降(P<0.001)。20%(8/40)患者CEA、CK20表达量均下降。
2.5血清肿瘤标志物检测结果
38例患者分别于HIPEC前后检测血清CEA、CA125、CA19-9,结果见表3。HIPEC前、后CEA、CA125、CA19-9阳性率分别为50.0% vs. 23.6%(P=0.016)、52.6% vs. 47.4%(P=0.409)、36.8%vs.26.3%(P=0.121)。

表2 45例腹膜转移癌患者基本临床病理特征Table 2 Major clinicopathologic characteristics of the 45 patients
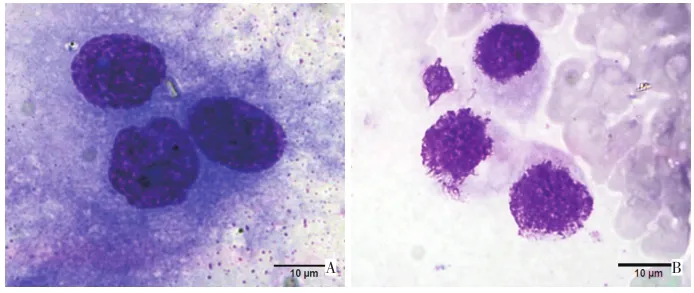
图1腹腔冲洗液脱落细胞学检查结果(Wright's stain×1 000)Figure 1 Peritoneal lavage cytology(Wright's stain×1 000)
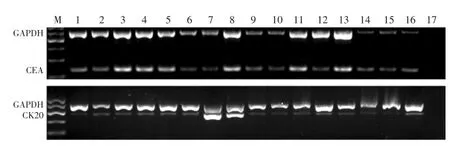
图2 1.5%琼脂糖凝胶电泳Figure 2 Agarose gel(1.5%)electrophoresis of the RT-PCR product
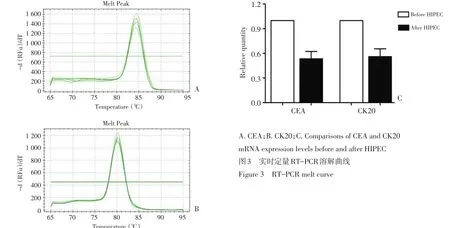
图3实时定量RT-PCR溶解曲线Figure 3 RT-PCR melt curve
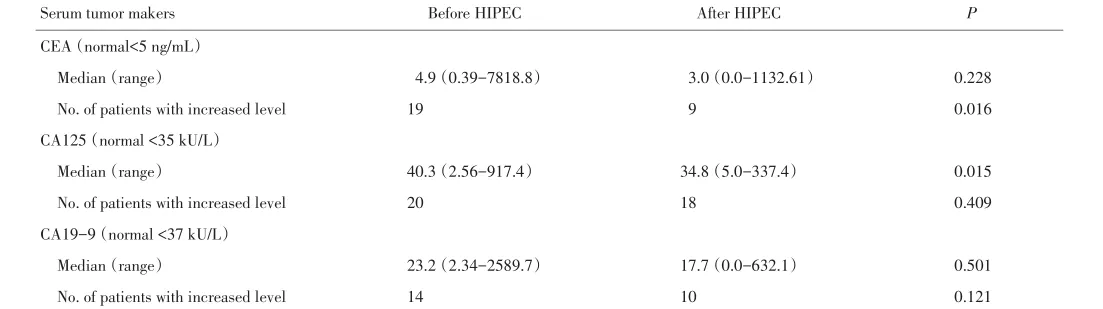
表3 38例腹膜转移癌患者HIPEC前后血清CEA、CA125及CA19-9浓度变化Table 3 Changes in serum CEA, CA125, and CA19-9 levels before and after HIPEC in 38 patients
3 讨论
腹、盆腔内肿瘤浸润生长,穿透浆膜后,癌细胞直接脱落于腹腔,形成IFCCs;除此之外,手术过程中的血管断扎、淋巴结清扫等操作也可导致血管、淋巴管中的癌细胞进入腹腔,形成IFCCs[4]。IFCCs的形成是腹膜转移癌发生的病理学基础,IFCCs可直接依附于腹膜间皮细胞,侵入间皮下层组织,形成有新生血管的转移瘤;亦可通过腹膜上的乳斑结构侵入间皮下淋巴管,形成转移瘤。
IFCCs阳性的患者易发生腹膜转移,预后差。多项大样本临床研究证实了IFCCs是胃癌、结直肠癌和卵巢癌患者预后因素之一。Bando等[5]报道1 297例胃癌患者中,IFCCs阳性的患者5年生存率仅2%,其中30例出现腹膜转移的患者中23例IFCCs阳性。Kano等[6]报道1 039例胃癌,其中IFCCs阳性患者5年生存率为15%,中位生存时间为11个月。Lee等[7]报道172例IFCCs阳性的胃癌患者中76例发生腹膜转移。Nishikawa等[8]报道在410例结直肠癌患者中,IFCCs阳性患者5年生存率为20.6%,腹膜转移的发生率较IFCCs阴性患者高10倍以上。Zuna等[9]报道90例IFCCs阳性的卵巢癌患者,中位生存期为20个月,5年生存率为9.2%。
PLC方法检测IFCCs可有效预测胃癌患者预后,该方法特异性强但敏感性较低,是目前IFCCs检测的金标准[10]。免疫细胞化学法[11]和流式细胞仪法[12],利用肿瘤细胞相关抗原的单克隆抗体标记肿瘤细胞,可在一定程度上提高检测灵敏度和特异性。随着聚合酶链式反应(polymerase chain reaction,PCR)的发明及在血液、骨髓检测中的应用,IFCCs的检测由细胞时代进入分子时代。1997年Nakanishi等[13]首先使用逆转录PCR(RT-PCR)方法,通过扩增CEA mRNA来检测IFCCs,证实了该方法的可行性。Kodera等[14]报道通过RT-PCR方法检测CEA mRNA可有效预测胃癌患者预后。RT-PCR方法大幅提高了IFCCs检测的敏感度,且特异性良好,被广泛应用。不仅如此,CK20[15]、CK19[15]、MMP[16]等新指标的探索也取得了有效的结果,多指标联合检测不仅保持了RT-PCR敏感性高的特点,也提高了检测的特异性,是该领域未来发展的方向。
本研究采用PLC和RT-PCR两种方法检测IFCCs,HIPEC前PLC法检测IFCCs阳性率为93.3% (42/45),RT-PCR法检测CEA mRNA、CK20 mRNA阳性率分别为97.8%(44/45)、95.6%(43/45)。两种方法检测阳性率均在90%以上,这是由于75.6%(34例)的患者纳入本研究时伴有肉眼可见的腹膜转移,无腹膜转移的11例患者中,7例患者肿瘤侵袭浆膜。
目前尚无对IFCCs的标准治疗方案。传统根治术以整块切除癌变器官组织、清除区域淋巴结、病理检查切缘无癌组织为标准,着重于组织学根治,不注重清除IFCCs。研究表明尽管术中严格遵循无瘤原则,由于术中淋巴管的开放、血管的断扎,部分术前IFCCs阴性的患者术后转为阳性[17]。术中腹腔内化疗加广泛腹腔灌洗可显著延长IFCCs阳性患者生存时间[18]。
HIPEC是腹膜癌治疗的有效方法。一系列临床研究表明,CRS+HIPEC可降低腹膜复发转移率[19],延长胃癌[1]、结直肠癌[3]及卵巢癌[20]来源腹膜转移癌患者生存期。HIPEC可利用化疗药物与热效应的协同作用直接杀灭IFCCs,同时大量的热化疗液灌洗腹腔亦可有效减少IFCCs。
本研究中HIPEC前、后PLC检测阳性率分别为93.3%(42/45)、24.4%(11/45),呈显著下降(P<0.001),对IFCCs清除率达73.8%(31/42),其中50.0%(21/42)的患者可直接观察到癌细胞溶解。HIPEC前、后CEA mRNA阳性率分别为97.8%(44/45)、84.4%(38/ 45),CK20 mRNA的阳性率均为95.6%(43/45),两者均差异无统计学意义。实时定量RT-PCR结果显示,尽管无法完全消除CEA mRNA、CK20 mRNA,HIPEC可使近1/3的患者实现该指标的显著下降;血清肿瘤标志物检测得出了类似的结果。这些结果提示HIPEC可有助于部分实现细胞学根治。
在我国腹腔恶性肿瘤患者大多于疾病进展期就诊,传统的根治性手术仅能实现组织学根治,无法清除IFCCs,这可能是腹腔内复发转移的主要原因之一。本研究证实了HIPEC可有效杀灭IFCCs,为实现肿瘤细胞学水平根治提供了一个可行的方法。
参考文献
[1]Yang XJ, Huang CQ, Suo T, et al. Cytoreductive surgery and hy⁃perthermic intraperitoneal chemotherapy improves survival of pa⁃tients with peritoneal carcinomatosis from gastric cancer: final re⁃sults of a phaseⅢrandomized clinical trial[J]. Ann Surg Oncol, 2011, 18(6):1575-1581.
[2]Li Y, Zhou YF, Liang H, et al. Chinese expert concensus statement on cytoreductive surgery plus hyperthermic intraperitoneal che⁃motherapy to treat peritoneal surface oncology[J]. Chin J ClinOncol, 2015, 42(4):198-206.[李雁,周云峰,梁寒,等.细胞减灭术加腹腔热灌注化疗治疗腹膜表面肿瘤的专家共识[J].中国肿瘤临床,2015, 42(4):198-206.]
[3]Huang CQ, Yang XJ, Yu Y, et al. Cytoreductive surgery plus hy⁃perthermic intraperitoneal chemotherapy improves survival for patients with peritoneal carcinomatosis from colorectal cancer: a phaseⅡstudy from a Chinese center[J]. PLoS One, 2014, 9(9):e108509.
[4]Tokumitsu Y, Yoshino S, Iida M, et al. Intraoperative dissemina⁃tion during gastrectomy for gastric cancer associated with serosal invasion[J]. Surg Today, 2015, 45(6):746-751.
[5]Bando E, Yonemura Y, Takeshita Y, et al. Intraoperative lavage for cytological examination in 1,297 patients with gastric carcino⁃ma[J]. Am J Surg, 1999, 178(3):256-262.
[6]Kano Y, Kosugi SI, Ishikawa T, et al. Prognostic significance of peritoneal lavage cytology at three cavities in patients with gastric cancer[J]. Surgery, 2015, doi: 10.1016/j.surg.2015.04.004.[Epub ahead of print].
[7]Lee SD, Ryu KW, Eom BW, et al. Prognostic significance of peri⁃toneal washing cytology in patients with gastric cancer[J]. Br J Surg, 2012, 99(3):397-403.
[8]Nishikawa T, Watanabe T, Sunami E, et al. Prognostic value of peritoneal cytology and the combination of peritoneal cytology and peritoneal dissemination in colorectal cancer[J]. Dis Colon Rectum, 2009, 52(12):2016-2021.
[9]Zuna RE, Behrens A. Peritoneal washing cytology in gynecologic cancers: long term follow-up of 355 patients[J]. J Natl Cancer Inst, 1996, 88(14):980-987.
[10]Rossi Del Monte S, Ranieri D, Mazzetta F, et al.Free peritoneal tu⁃mor cells detection in gastric and colorectal cancer patients[J]. J Surg Oncol, 2012, 106(1):17-23.
[11]Nekarda H, Gess C, Stark M, et al. Immunocytochemically detected free peritoneal tumour cells(FPTC)are a strong prognostic factor in gastric carcinoma[J]. Br JCancer, 1999, 79(3-4):611-619.
[12]Kitayama J, Emoto S, Yamaguchi H, et al. Flow Cytometric Quantification of Intraperitoneal Free Tumor Cells is a Useful Biomarker in Gastric Cancer Patients with Peritoneal Metastasis[J]. Ann Surg Oncol, 2015, 22(7):2336-2342.
[13]Nakanishi H, Kodera Y, Torii A, et al. Detection of carcinoembryonic antigen-expressing free tumor cells in peritoneal washes from pa⁃tients with gastric carcinoma by polymerase chain reaction[J]. Jpn J Cancer Res, 1997, 88(7):687-692.
[14]Kodera Y, Nakanishi H, Yamamura Y, et al. Prognostic value and clinical implications of disseminated cancer cells in the perito⁃ neal cavity detected by reverse transcriptase-polymerase chain re⁃action and cytology[J]. Int J Cancer, 1998, 79(4):429-433.
[15]Fujita Y, Terashima M, Hoshino Y, et al. Detection of cancer cells disseminated in bone marrow using real-time quantitative RTPCR of CEA, CK19, and CK20 mRNA in patients with gastric cancer[J]. Gastric Cancer, 2006, 9(4):308-314.
[16]Yonemura Y, Fujimura T, Ninomiya I, et al. Prediction of perito⁃neal micrometastasis by peritoneal lavaged cytology and reverse transcriptase- polymerase chain reaction for matrix metallopro⁃teinase-7 mRNA[J]. Clin Cancer Res, 2001, 7(6):1647-1653.
[17]Chen R, Cai JL, Liu CB, et al. Clinical significance of detecting in⁃traperitoneal cancer cells before and after surgery in colorectal cancer patients[J]. Clin J Gastrointest Surg, 2005, 8(2):174-175.[陈荣,蔡景理,刘长宝,等.结直肠癌患者手术前后腹腔脱落肿瘤细胞检测的临床意义[J].中华胃肠外科杂志,2005,8(2):174-175.]
[18]Kuramoto M, Shimada S, Ikeshima S, et al. Extensive intraopera⁃tive peritoneal lavage as a standard prophylactic strategy for peri⁃toneal recurrence in patients with gastric carcinoma[J]. Ann Surg, 2009, 250(2):242-246.
[19]Yonemura Y, de Aretxabala X, Fujimura T, et al. Intraoperative chemohyperthermic peritoneal perfusion as an adjuvant to gastric cancer: final results of a randomized controlled study[J]. Hepato⁃gastroenterology, 2001, 48(42):1776-1782.
[20]Spiliotis J, Halkia E, Lianos E, et al. Cytoreductive surgery and HIPEC in recurrent epithelial ovarian cancer: a prospective ran⁃domized phaseⅢstudy[J]. Ann Surg Oncol, 2015, 22(5):1570-1575.
(2015-08-04收稿)
(2015-09-02修回)
(编辑:周晓颖)
姬忠贺专业方向为肿瘤生物学研究。
E-mail:jzh_whu@qq.com

·临床研究与应用·
作者单位:①武汉大学中南医院肿瘤科,肿瘤生物学行为湖北省重点实验室,湖北省肿瘤医学临床研究中心(武汉市430071);②首都医科大学附属北京世纪坛医院肿瘤中心腹膜肿瘤科
*本文课题受湖北省医学领军人才培养工程和教育部博士学科点专项科研基金(编号:20120141110042)资助
Assessment of hyperthermic intraperitoneal chemotherapy in the eradication of intraperitoneal free cancer cells
Zhonghe JI1, Jianhua SUN1, Haitao WU1, Qian ZHANG1, Kaiwen PENG1, Yan LI1,2
Correspondence to: Yan LI; E-mail: liyansd2@163.com
1Department of Oncology, Zhongnan Hospital of Wuhan University, Hubei Key Laboratory of Tumor Biological Behaviors & Hubei Cancer Clinical Study Center, Wuhan 430071, China;2Department of Peritoneal Surface Oncology, Cancer Center of Beijing Shijitan Hospital, Capital Medical University, Beijing 100038, China.
This work was supported by funds from the Hubei Province Outstanding Medical Academic Leader Program and the Science Fund for Doctorate Mentors by China's Ministry of Education(No. 20120141110042).
AbstractObjective: To assess the efficacy of hyperthermic intraperitoneal chemotherapy(HIPEC)in treating intraperitoneal free cancer cells(IFCCs)and the feasibility of the cytological cure for peritoneal carcinomatosis(PC). Methods: Peritoneal lavage liquid(or ascites)from 45 patients with PC were collected before and after intraoperative HIPEC to detect CEA mRNA and CK20 mRNA by peritoneal lavage cytology(PLC)test and simple or real-time reverse-transcription polymerase chain reaction(RT-PCR). The blood samples before and after HIPEC were also collected to detect serum tumor markers, including CEA, CA125, and CA19-9. Results: The positive rates of PLC and the RT-PCR of CEA and CK20 mRNAs before and after HIPEC were 93.3%(42/45)and 24.4%(11/45)(P< 0.001), 97.8%(44/45)and 84.4%(38/45)(P=0.058), and 95.6%(43/45)and 95.6%(43/45)(P=1.000), respectively. After HIPEC, 32.5% and 30.0% of the patients showed a significant decrease in CEA and CK20 mRNA levels, respectively(P<0.001 for both). Moreover, the positive rate of serum CEA, CA125, and CA19-9 before and after HIPEC were 50% vs. 23.6%(P=0.016), 52.6% vs. 47.4%(P=0.409), and 36.8% vs. 26.3%(P=0.121), respectively. Conclusion: HIPEC could effectively eradicate IFCCs and provide a feasible approach to achieve cytological cure for PC.
Keywords:peritoneal carcinomatosis(PC), intraperitoneal free cancer cells(IFCCS), hyperthermic intraperitoneal chemotherapy(HIPEC)
作者简介
通信作者:李雁liyansd2@163.com
doi:10.3969/j.issn.1000-8179.2015.17.848
