高效液相色谱-串联质谱法测定家蚕血液中β-蜕皮激素
2015-12-14唐博志武国华
唐博志,李 龙,武国华,
(1.江苏科技大学生物与化学工程学院,江苏镇江 212018;2.中国农业科学院蚕业研究所,农业部蚕桑产品及食用昆虫质量安全风险评估实验室,江苏镇江 212018)
高效液相色谱-串联质谱法测定家蚕血液中β-蜕皮激素
唐博志1,李 龙2,武国华1,2
(1.江苏科技大学生物与化学工程学院,江苏镇江 212018;2.中国农业科学院蚕业研究所,农业部蚕桑产品及食用昆虫质量安全风险评估实验室,江苏镇江 212018)
建立了高效液相色谱-串联质谱(HPLC-MS/MS)测定家蚕血液中β-蜕皮激素的方法。实验以高油菜素内酯为内标,用乙腈去除家蚕血液样品中的蛋白质;C18反相柱作为分析色谱柱,以乙腈和含0.5%乙酸的水溶液作为流动相,使用梯度洗脱的方法进行液相色谱分离。在优化的仪器条件下,血液中蜕皮激素的加标回收率在83.56%~97.11%之间,相对标准偏差小于5.4%,在3.13~50μg/L浓度范围内,线性相关系数R2为0.996 3,方法的检出限为0.2μg/L。该方法能较好地满足测定家蚕血液中β-蜕皮激素含量的要求,同时也可被推广测定其他昆虫血液中的β-蜕皮激素。
β-蜕皮激素;家蚕;血液;高效液相色谱-串联质谱(HPLC-MS/MS)
β-蜕皮激素又叫20-羟基蜕皮酮,简称20E,是一种能促进甲壳动物蜕皮的激素,分子式为C27H44O7,结构式示于图1。它具有调控甲壳动物生长发育的作用,广泛存在于昆虫、蟹等动物体内[1-2]。此外,蜕皮激素还存在于植物中,某些植物的蜕皮激素含量远高于动物,是提取蜕皮激素的主要来源[3]。目前,蜕皮激素主要应用于家蚕、虾蟹等甲壳动物养殖业中,用于调节甲壳动物的新陈代谢,使甲壳动物快速而顺利地完成蜕皮,促进其生长[4]。近年来,对蜕皮激素的药理和临床研究发现,蜕皮激素具有促进人体肝脏蛋白质的合成和脂肪代谢,以及促进血管内皮细胞分裂增殖等作用[5]。
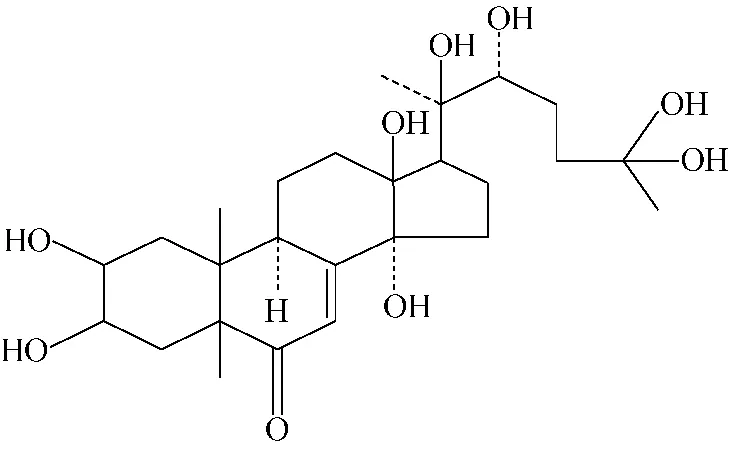
图1 β-蜕皮激素的结构式Fig.1 Structure of 20-hydroxyecdysone
蜕皮激素的定量分析方法主要有分光光度法[6]、高效毛细管电泳法[1]、薄层扫描法[7],放射免疫测定法[8]、液相色谱法[3,9-11]和液相色谱-串联质谱法[12-14]等。其中,高效毛细管电泳法和薄层扫描法的灵敏度低,使用较少;放射免疫测定法可以达到更低的定量限,但因受到放射性污染等实验条件的限制也较少使用;高效液相色谱法的定量分析效果较好,但是检出限高于1mg/L[3,9-11],目前主要用于分析植物样品或者蜕皮激素含量较高的动物样品。尽管液相色谱-串联质谱法因其抗干扰性强、灵敏度高等特点在定量分析中有着较广泛的应用,但对昆虫体内痕量蜕皮激素研究的例子很少[12-14],且尚未见用于家蚕血液中蜕皮激素定量分析的报道。
本研究拟建立高效液相色谱-串联质谱(HPLC-MS/MS)法测定家蚕血液中蜕皮激素,旨在为进一步研究蜕皮激素含量在家蚕生长发育过程中的变化规律以及产生的影响提供有价值的信息。
1 实验部分
1.1 仪器与试剂
TSQ Quantum Access MAX三重四极杆液相色谱-质谱联用仪:美国Thermo-Fisher公司产品,配有电喷雾离子源(ESI)及Xcalibur 2.1数据处理系统;Hypersil Gold C18(50mm× 2.1mm×1.9μm)色谱柱、Hypersil Gold C18(10mm×2.1mm×3μm)保护柱:美国Thermo-Fisher公司产品;R-3旋转蒸发仪:瑞士Buchi公司产品;Mili-Q超纯水系统:法国Milipore公司产品。
供试的家蚕品种为C108:由中国农科院蚕业研究所提供;β-蜕皮激素标准品(纯度98%):上海纯优生物科技公司产品;高油菜素内酯标准品(纯度98%):上海一基实业有限公司产品;苯基硫脲(分析纯),甲酸(色谱纯):上海晶纯实业有限公司产品;乙腈、甲醇(色谱纯):Burdick &Jackson公司产品;水:由Mili-Q超纯水系统制备。
标准储备液:准确称取5.0mgβ-蜕皮激素,用甲醇溶解,配制成500mg/L储备液,于4℃冰箱中避光保存。
1.2 仪器条件
1.2.1 色谱条件 流动相:A为含0.5%乙酸
的水溶液,B为乙腈;梯度洗脱程序:0~4min、15%B,4~7min、15~100%B,7~10min、100%B,10~12min、100~15%B,12~16min、15%B;流速200μL/min;进样量10μL;分析时间16min。
1.2.2 质谱条件 电喷雾离子源正离子模式,喷雾电压5 000V,鞘气流速12L/min,辅助气流速1.5L/min,加热气温度242℃,离子传输管温度204℃。碰撞气(Ar)压力0.21Pa,碰撞能量12eV。在选择反应监测(SRM)模式下,选择m/z481.2作为蜕皮激素的母离子,m/z 445.3作为子离子进行定量分析;选择m/z495.5作为内标高油菜素内酯的母离子,m/z459.5作为子离子进行定量分析;扫描时间0.1s。
1.3 样品前处理
家蚕C108饲养到4龄第1天开始取样,剪破腹足取血,向血液中加入苯基硫脲抗氧化剂,置于-20℃冰箱中保存。样品包括4龄第1天到第5天的家蚕血液,以及5龄第1天到第7天的血液。每份血液样品取3份平行试样。
家蚕血液超声20min后,取0.4mL血液于2mL离心管中,加入1.6mL乙腈,涡旋混合30s后,以12 000r/min离心8min。将2份离心后的上清液(共约4mL)合并至10mL梨形瓶中,加入0.1mL 2mg/L高油菜素内酯,旋转蒸发至干,加入1mL纯水复溶,离心,再用0.22μm滤膜过滤,待测。
2 结果与讨论
2.1 质谱和色谱分离条件的优化
采用注射泵连续进样方式,对1mg/L蜕皮激素和高油菜素内酯进行质谱分析。在正离子模式下,蜕皮激素主要产生3种正离子:m/z481.2([M+H]+),m/z 503.4([M+Na]+)和m/z 519.3([M+K]+),示于图2a;内标高油菜素内酯主要产生3种正离子:m/z 495.5([M+H]+),m/z517.1([M+Na]+)和m/z533.2([M+K]+),示于图2b。由于蜕皮激素中m/z481.2和高油菜素内酯中m/z495.5强度最高,因此选择m/z 481.2和m/z 495.5分别作为选择反应监测模式下蜕皮激素和高油菜素内酯的母离子。对m/z481.2([M+H]+)进行二级质谱扫描,其主要碎片离子为m/z 371.0、m/z 445.3和m/z 165.1,示于图3a。由于碎片离子m/z 445.3(由母离子m/z 481.2脱去2个水分子形成)信号最强,因此选择m/z445.3作为定量离子对中的子离子。对高油菜素内酯的m/z 495.5([M+H]+)进行二级质谱扫描,其主要碎片离子为m/z 459.3、m/z343.1和m/z 109.3,示于图3b。由于碎片离子m/z 459.3信号最强(由母离子m/z 495.5脱去2个水分子形成),故选择m/z 459.3作为SRM模式中的子离子。
对蜕皮激素标准品进行质谱条件优化时发现,在没有加入0.1%乙酸时,m/z 481.2([M+H]+)强度很低,而且不稳定。随后,选用乙腈加0.1%乙酸和甲醇加0.1%乙酸作为流动相进行对比。结果发现,乙腈加0.1%乙酸作为流动相时,质谱峰的峰形更平滑、干扰较少、信号响应强度也更高。
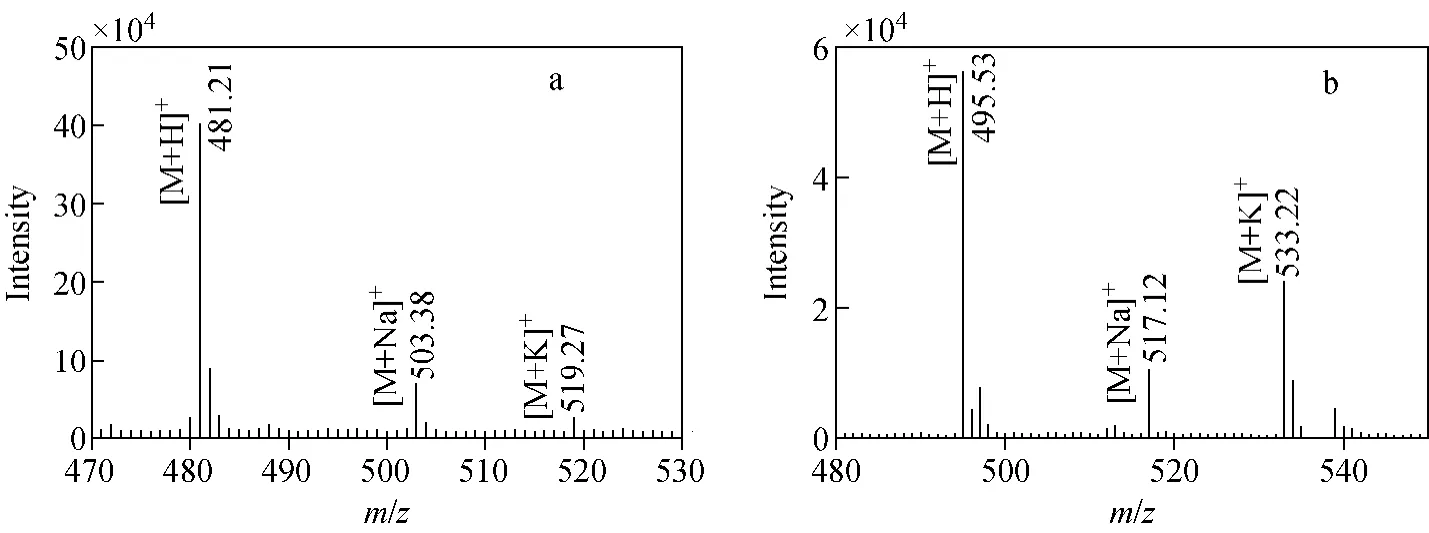
图2 正离子模式下,β-蜕皮激素(a)和高油菜素内酯(b)的质谱图Fig.2 Mass spectrums of 20-hydroxyecdysone(a)and 22(S),23(S)-homobrassinolide(b)in positive mode
乙腈加0.1%乙酸作为流动相时,高油菜素内酯的峰型拖尾严重,只有将乙酸浓度提高
到0.5%时才具有良好的峰型,因此选择0.5%乙酸加乙腈作为流动相。
考虑到本实验所使用的色谱柱直径小、填料粒径小,易被固体颗粒堵塞。因此,配备了保护柱来保护色谱柱。标准品和样品的选择反应监测模式总离子流图示于图4。
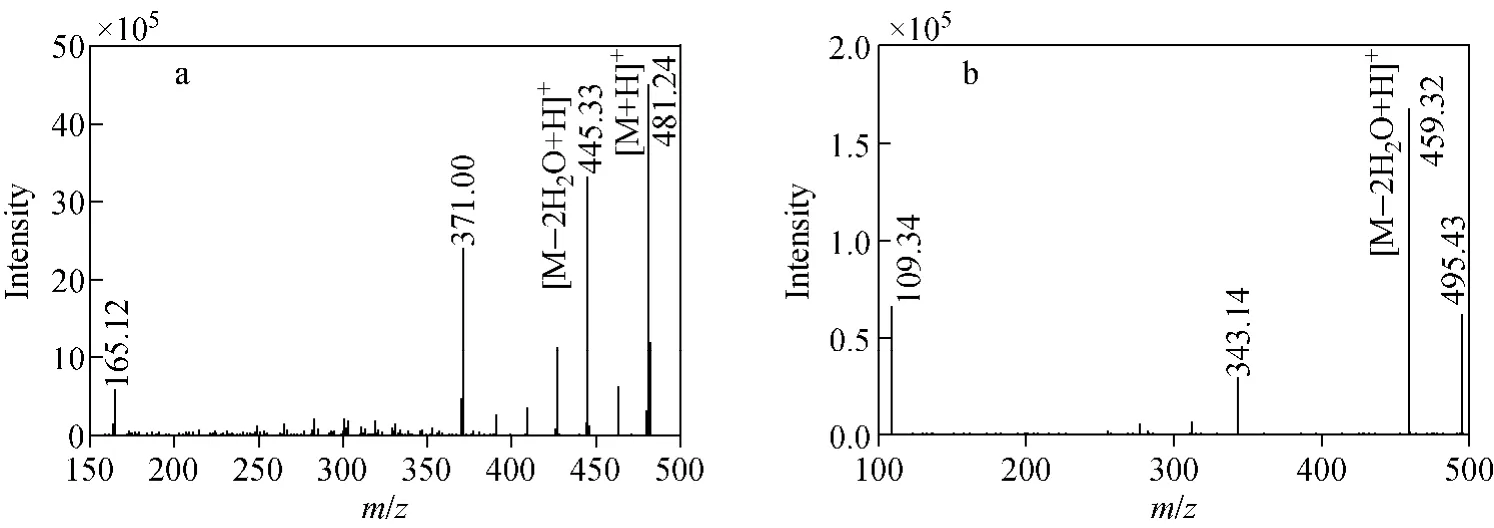
图3 正离子模式下,β-蜕皮激素(a)和高油菜素内酯(b)的子离子全扫质谱图Fig.3 Fragment ion mass spectra of 20-hydroxyecdysone(a)and 22(S),23(S)-homobrassinolide(b)in positive mode

图4 12.5μg/L蜕皮激素标准品(a)和样品(b)的选择反应监测模式总离子流图Fig.4 Selected reaction monitoring chromatograms of 12.5μg/L standard 20-hydroxyecdysone(a)and sample(b)
2.2 标准曲线的建立和检出限
分别配制3.13、6.25、12.50、25、50μg/L蜕皮激素标准溶液,向每份标准溶液中加入高油菜素内酯,使其含量为200μg/L,用LC-MS/MS分析。在3.13~50μg/L范围内,β-蜕皮激素的标准曲线示于图5,线性方程为y=0.219 8x-0.474 8,相关系数(R2)为0.996 3。最低浓度点3.13μg/L和空白样品的总离子流图示于图6。由图6可见,最低浓度点时,峰形已变得较差,同时空白样品也存在一定的干扰。
实验发现,这一线性范围适合大部分待测的家蚕血液样品,只有4龄第4天和第5天的家蚕血液样品中蜕皮激素含量高于50μg/L,因此,用纯水将4龄第4天血液稀释5倍,4龄第5天血液稀释10倍后,再进行样品前处理和质谱检测分析。
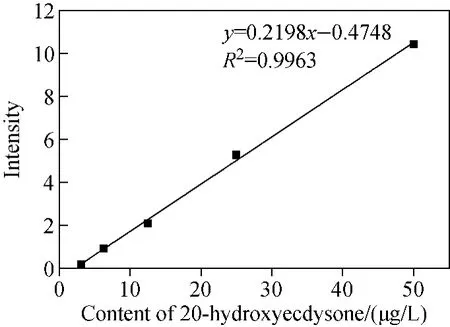
图5 β-蜕皮激素的标准曲线Fig.5 Standard curve of 20-hydroxyecdysone
用10μL 0.4μg/L蜕皮激素标准溶液进行检测分析,测得信噪比S/N=8,按信噪比S/N=3计算得到的蜕皮激素检出限为0.2μg/L。
2.3 样品前处理及回收率和精密度
家蚕血液,又称血淋巴,是家蚕血浆与淋巴
液的混合物。与哺乳动物全血相比,家蚕血液样品中的有机物或干扰离子较少,用乙腈去蛋白后便可直接上机分析。为了保证较高的回收率和平行性,采用超声法对血液中的细胞进行破碎处理。用乙腈去蛋白后的样品中乙腈含量过高,导致色谱峰形较差,可通过将样品蒸干、纯水复溶的前处理方法,消除乙腈对色谱分离的影响。
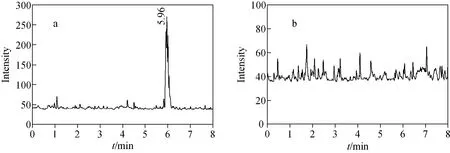
图6 3.13μg/L蜕皮激素标准品(a)和空白样品(b)的选择反应监测模式总离子流图Fig.6 Selected reaction monitoring chromatogram of 3.13μg/L standard 20-hydroxyecdysone(a)and blank sample(b)
将5龄第6天的家蚕C108血液超声提取20min,取0.4mL血液于2mL离心管中,加入1.6mL乙腈,涡旋混合30s后,以12 000r/min离心3min。
低浓度组:将1份离心后的上清液(约2mL)移入梨形烧瓶中,加入0.1mL 2mg/L高油菜素内酯,再分别加入0.1mL 50、60和70μg/L标准品,旋转蒸发至干后,加入1mL纯水复溶,用0.22μm滤膜过滤,待测。
中浓度组:将2份离心后的上清液(约4mL)移入梨形烧瓶中,加入0.1mL 2mg/L高油菜素内酯,然后分别加入0.1mL 100、120和140μg/L标准品,旋转蒸发至干后,加入1mL纯水复溶,用0.22μm滤膜过滤,待测。
高浓度组:将3份离心后的上清液(约6mL)移入梨形烧瓶中,加入0.1mL 2mg/L高油菜素内酯,再分别加入0.1mL 150、180和210μg/L标准品,旋转蒸发至干后,加入1mL纯水复溶,用0.22μm滤膜过滤,待测。
每种浓度的样品做3次平行实验,每次平行实验重复测定5次,计算方法的回收率和精密度,结果列于表1。由表1可见,由于受离子干扰等因素的影响,方法的精密度较差。
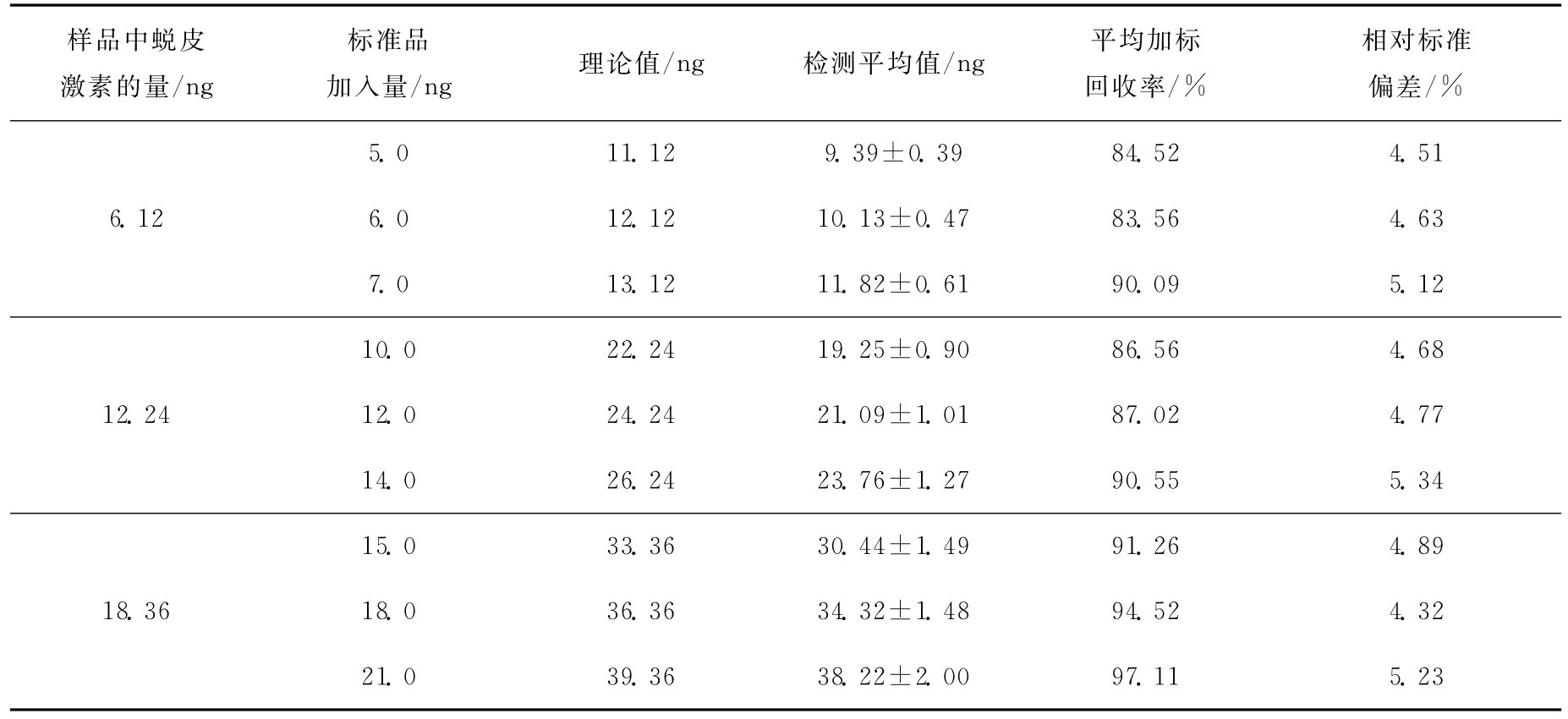
表1 β-蜕皮激素的加标回收率(n=5)Table 1 Recoveries of 20-Hydroxyecdysone
2.4 家蚕不同生长时期蜕皮激素含量的变化
使用上述方法定量测定了4龄第1天至第5天、5龄第1天至第7天家蚕血液中蜕皮激素的含量,检测结果示于图7。

图7 家蚕不同生长时期蜕皮激素的含量Fig.7 Contents of 20-hydroxyecdysone in silkworms’hemolymph in different instars
由图7可以看出,家蚕4龄第1天到第5天,血液中的蜕皮激素含量从检测不出递增到239.3μg/L,表明家蚕从4龄第2天便开始分泌蜕皮激素,为4龄蜕皮做准备。家蚕4龄第5天到5龄第1天,血液中蜕皮激素含量迅速下降,表明家蚕蜕皮后,其血液中的蜕皮激素含量迅速减少。从5龄第4天到第7天,家蚕血液中蜕皮激素含量呈现递增趋势,表明家蚕分泌蜕皮激素为结茧和蜕皮等做准备,但有趣的是,结茧前家蚕血液中蜕皮激素含量远低于4龄最后一天。4龄和5龄家蚕血液中蜕皮激素含量的变化规律表明,蜕皮激素对家蚕的生长发育具有重要的调节作用。罗坚等[15]、赵凌艺等[16]在研究添食蜕皮激素对5龄家蚕的影响时发现,过早地添食蜕皮激素虽然可以使家蚕提前成熟,但会影响家蚕的产茧量和茧质;而5%家蚕在见熟的时候添喂蜕皮激素对蚕茧产量和茧质没有明显影响,且便于集中上蔟。他们的实验表明,在5龄第5天前给家蚕添食蜕皮激素虽然可以提高家蚕血液中蜕皮激素的含量,加速家蚕的生长,使家蚕提前成熟,但同时也影响了蚕茧的产量和茧质,由于存在个体差异,可能导致家蚕上簇不齐;如果在5龄第7天、第8天给家蚕添食蜕皮激素,可加速其生长,便于集中上蔟,对蚕茧生产是有帮助的。
3 结论
本研究建立了高效液相色谱-串联质谱法测定家蚕血液中蜕皮激素的含量。以高油菜素内酯作为内标,用乙腈去除家蚕血液中蛋白质,对质谱参数及色谱分离条件进行了优化,检出限为0.2μg/L,线性范围为3.13~50μg/L,相关系数R2为0.996 3,加标回收率为83.56%~97.11%。采用该方法检测4龄和5龄家蚕血液中蜕皮激素的含量,发现在蜕皮前,家蚕血液中蜕皮激素含量逐渐升高,蜕皮后,血液中蜕皮激素含量迅速下降。该方法可为研究蜕皮激素对家蚕生理和生化影响提供一种高灵敏的分析手段,为家蚕育种提供直接的实验数据。
[1] 周梅仙,陈舒泛,朱文娴.高效毛细管电泳法测定桑叶中β-蜕皮激素[J].淮阴师范学院学报:自然科学版,2005,4(4):311-313.ZHOU Meixian,CHEN Shufan,ZHU Wenxian.The study on the determination of phytoecdysone in folium mori by capillary electrophoresis[J].Journal of Huaiyin Teachers College:Natural Science Edition,2005,4(4):311-313(in Chinese).
[2] 赵一璐,邢朝云,陈晶磊,等.植物蜕皮激素药理活性研究进展[J].抗感染药学,2010,7(3):147-152.ZHAO Yilu,XIN Chaoyun,CHEN Jinglei,et al.Research advances in pharmacological effects of phytoecdysone[J].Anti-Infection Pharmacy,2010,7(3):147-152(in Chinese).
[3] 惠玉虎,张立,李健.RP-HPLC法测定珍珠露水草提取物中蜕皮激素的含量[J].中草药,2002,33(5):426.HUI Yuhu,ZHANG Li,LI Jiang.The study on the determination of phytoecdysone in arachnoid cyanotis root by RP-HPLC[J].Chinese Traditional and Herbal Drugs,2002,33(5):426(in Chinese).
[4] 陈树桥,陈勇,周国勤,等.蜕皮激素对克氏原螯虾蜕皮和生长的影响[J].南京师大学报:自然科学版,2012,35(1):80-83.CHEN Shuqiao,CHEN Rong,ZHOU Guoqin,
et al.Effects of ecdysterone on the molt and growth of procambarus clarkii[J].Journal of Nanjing Normal University:Natural Science Edition,2012,35(1):80-83(in Chinese).
[5] 李国芳,吴旭,付小兵,等.蜕皮甾酮体外促进人表皮干细胞增殖的实验研究[J].感染、炎症、修复,2009,10(2):74-77.LI Guofang,WU Xu,FU Xiaobing,et al.Experimental study on the effects of ecdysterone in promoting proliferation of human epidermal stem cells in vitro[J].Infection Inflammation Repair,2009,10(2):74-77(in Chinese).
[6] 鲁马媚,陆春渡.蜕皮激素溶液含量测定方法比较[J].国外畜牧学-猪与禽,2010,30(3):70-71.LU Mamei,LU Chundu.The comparison of ecdysterone detection method[J].Pigs and Poultry,2010,30(3):70-71(in Chinese).
[7] 毕昊容.薄层板扫描法测定虾蟹脱壳促长素中蜕皮激素的含量[J].中国兽医杂志,1999,33(1):27-29.BI Haorong.The study on the determination of phytoecdysone in shrimp and crab diver accelerator by TICS[J].Chinese Journal of Veterinary Drug,1999,33(1):27-29(in Chinese).
[8] OEH U,LORENZ M W,HOFFMANN K H.Ecdysteroid release by the prothoracic gland of Gryllusbimaculatus(Ensifera:Gryllidae)during larval-adult development[J].Journal of Insect Physiology,1998,44(10):941-946.
[9] 徐慧.高效液相色谱法测定蓝耳草中β-蜕皮激素含量[J].广西科学院学报,2010,26(3):239-241.XU Hui.Determination ofβ-ecdysone in Cyanotis vaga(Lour.)Roem.et Schult by HPLC[J].Journal of Guangxi Academy of Sciences,2010,26(3):239-241(in Chinese).
[10]卞岑云,卢保秀,王俭,等.高效液相色谱法测定虾蟹脱壳促长散中β-蜕皮激素的含量[J].兽药与饲料添加剂,2005,10(6):27-29.BIAN Cenyun,LU Baoxiu,WANG Jian.The study on the determination of phytoecdysone in shrimp and crab diver accelerator by HPLC[J].Veterinary Pharmaceuticals &Feed Additives, 2005,10(6):27-29(in Chinese).
[11]范作卿,邹德庆.高效液相色谱法测定柞蚕雄蛾营养液中β-蜕皮激素含量[J].山东农业科学,2012,44(5):114-115.FAN Zuoqin,ZHOU Deqing.20-Hydroxyecdysone determination in nutrient liquid of male tussah moths by HPLC[J].Shandong Agricultural Sciences,2012,44(5):114-115(in Chinese).
[12]赵鹏,徐继林,亓一舟,等.高效液相色谱-三重四级杆质谱分析海洋甲壳动物淋巴和肌肉中的20-羟基蜕皮酮[J].分析化学,2011,39(1):57-61.ZHAO Peng,XU Jilin,QI Yizhou,et al.Determination of 20-hydroxyecdysone in several marine crustaceans by liquid chromatography-mass spectrometry[J].Chinese Journal of Analytical Chemistry,2011,39(1):57-61(in Chinese).
[13]BLANDINE D,GAUD P,FABRICE M,et al.Detection and identification of 20-hydroxyecdysone metabolites in calf urine by liquid chromatography-high resolution or tandem mass spectrometry measurements and establishment of their kinetics of elimination after 20-hydroxyecdysone administration[J].Analytica Chimica Acta,2009,637(1):178-184.
[14]YUTAI L,JAMES T W,GUNNAR B,et al.Profiling of ecdysteroids in complex biological samples using liquid chromatography/ion trap mass spectrometry[J].Rapid Communications in Mass Spectrometry,2006,20(2):185-192.
[15]罗坚,闭立辉,苏红梅,等.家蚕添食蚕用蜕皮激素的试验[J].广西蚕业,2008,45(2):4-9.LUO Jian,BI Lihui,SU Hongmei,at al.Study on the effect of the ecdysterone on growth of bombyx mori[J].Guangxi Sericulture,2008,45(2):4-9(in Chinese).
[16]赵凌艺,王叶元,张俊涛,等.五龄蚕添食蜕皮激素对原蚕繁育及其后代的影响[J].广东蚕业,2013(1):32-37.ZHAO Lingyi,WANG Yeyuan,ZHANG Juntao,et al.The effect of the ecdysterone on growth and fecundity of Bombyx mori and its’offspring[J].Guangdong Sericulture,2013(1):32-37(in Chinese).
Determination of 20-Hydroxyecdysone in Hemolymph of Bombyx mori by HPLC-MS/MS
TANG Bo-zhi1,LI Long2,WU Guo-hua1,2
(1.School of Biological and Chemical Engineering,Jiangsu University of Science and Technology,Zhenjiang212018,China;2.Laboratory of Quality &Safety Risk Assessment for Sericultural Products and Edible Insects,Ministry of Agriculture,Sericultural Research Institute,Chinese Academy of Agricultural Sciences,Zhenjiang212018,China)
A method for the determination of 20-hydroxyecdysone in hemolymph of Bombyx mori was developed by high performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS).22(S),23(S)-homobrassinolide was used as an internal standard,and acetonitrile was used to precipitate the proteins in the hemolymph of Bombyx mori to eliminate the interference.The gradient elution program was performed on a C18column using a mobile phase consisting of acetonitrile and 0.5%acetic acid solution.Under the optimum working conditions of the instrument,the analytical results show that the recoveries of 20-hydroxyecdysone in hemolymph of Bombyx mori
20-hydroxyecdysone;Bombyx mori;hemolymph;high performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS)
O 657.63
A
1004-2997(2015)01-0052-07
10.7538/zpxb.youxian.2014.0057
2014-02-20;
2014-05-30
“十二五”现代农业产业技术体系建设专项(CARS-18);江苏特聘教授科研基金(16112000625)资助
唐博志(1987—),男(汉族),广东湛江人,硕士研究生,应用化学专业。E-mail:tang.brody@gmail.com
武国华(1963—),男(汉族),安徽人,研究员,从事质谱在生物学中的应用研究。E-mail:georgew511@hotmail.co.uk
时间:2014-12-02;
http:∥www.cnki.net/kcms/doi/10.7538/zpxb.youxian.2014.0057.html
are in the range of 83.56%-97.11%,and the relative standard deviation is below 5.4%.Linearity of the method in the range 3.13-50μg/L is good with the correlation coefficients(R2)of 0.996 3.The detection limit of the method is 0.2μg/L.The method can meet the need for the determination of 20-hydroxyecdysone in the hemolymph of Bombyx mori,which may also be applied to determine 20-hydroxyecdysone in the hemolymph of other insects.
