活性化糙米富集γ-氨基丁酸的雾化液组分优化
2015-12-13耿程欣杨润强顾振新
耿程欣,杨润强,顾振新*
(南京农业大学食品科技学院,江苏 南京 210095)
活性化糙米富集γ-氨基丁酸的雾化液组分优化
耿程欣,杨润强,顾振新*
(南京农业大学食品科技学院,江苏 南京 210095)
通过单因素试验和正交试验,优化了糙米湿润活性化富集γ-氨基丁酸(γ-aminobutyric acid,GABA)的雾化液pH值、VB6及CaCl2浓度,同时研究了最优条件下活性化糙米谷氨酸脱羧酶活力及主要物质含量变化。结果表明:最优培养条件为雾化液pH 3.5、VB6浓度2 mmol/L和CaCl2浓度10 mmol/L;在此条件下,活性化糙米中GABA含量可达7.67 mg/100 g,为原料糙米的2.74 倍。随着活性化时间的延长,糙米中游离氨基酸、还原糖含量及谷氨酸脱羧酶活力呈现逐渐增加的趋势,可溶性蛋白及淀粉含量呈现逐渐下降趋势。相关性分析表明,GABA含量与谷氨酸、游离氨基酸、可溶性蛋白含量之间均显著相关。
活性化糙米;γ-氨基丁酸;pH值;VB6;CaCl2
糙米是砻去谷壳后的稻米,具有生命活力。糙米由皮层、种皮、糊粉层、胚和胚乳等部分构成,经碾白后得到精白米,剔除的米糠包括种皮、糊粉层和部分胚。糙米富含淀粉、蛋白质、维生素、膳食纤维和矿物质等营养素[1],其中维生素、膳食纤维、矿物质和大部分蛋白质存在于米糠中,淀粉则主要存在于胚乳中[2]。流行病学研究表明,长期食用精白米易导致人体营养素缺乏,造成心血管病等慢性疾病的发生。虽然食用糙米有助于人体健康,但由于其皮层的存在,糙米的蒸煮性与适口性差。发芽除了可以改善糙米的营养品质外,还可以显著提高γ-氨基丁酸(γ-aminobutyric acid,GABA)等功能性物质的含量[3]。
GABA是一种非蛋白质氨基酸,作为哺乳动物脑和脊髓中的一种抑制性神经传导递质而存在,广泛存在于植物[4]、动物[5]和微生物[6]体内,具有镇定神经、降低血压、改善脑机能等作用[7]。以往的糙米采用浸泡发芽的方式富集GABA[8],浸泡液pH值、磷酸吡哆醛(pyridoxal phosphate,PLP)及Ca2+浓度等因素显著影响谷氨酸脱羧酶(glutamic acid decarboxylase,GAD)活力,从而影响GABA的生成[9-10]。但是,将糙米浸泡于水中发芽,因其吸水速率过快[11],发芽糙米干燥后大量爆腰,碾米时则碎米率高。对浸泡发芽后的糙米用蒸煮的方式使溶解的胚乳胶凝结,可降低碾米时碎米率,但是其工艺复杂[12]。在发芽过程中采用缓慢吸水方法[11],不仅可以降低糙米吸水过快造成的裂纹,而且可以激活糙米内源酶,以此富集功能成分。本实验采用雾化吸水方式,研究了由柠檬酸缓冲液、VB6(PLP替代物)和CaCl2组成的雾化液对糙米活性化及其富集GABA的影响,为开发富含GABA的可碾白活性化糙米提供理论依据。
1 材料与方法
1.1 材料与试剂
粳稻种子品种为“武运粳”,产自江苏省南京市溧水区,收获后于—20 ℃保存;实验前用砻谷机除去稻壳,得到糙米,然后剔除碎米粒、霉变粒、异色粒、无胚粒和未成熟籽粒,经发芽率测试合格后,备用。
丙酮(色谱纯) 山东禹王实业有限公司;4-二甲氨基偶氮苯磺酰氯(色谱纯) 美国西格玛公司;乙酸、乙醇、茚三酮、考马斯亮蓝G-250、酒石酸钾钠等(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
JLMZJ砻米实验检测组合机 上海嘉定粮油检测仪器厂;P YX-9030A型隔水电热恒温发芽箱 上海跃进医疗器械厂;1200液相色谱仪 美国安捷伦科技公司;402AI超声波雾化器 江苏鱼跃医疗设备股份有限公司;BG-LJ30OA多功能活氧机 北理国科臭氧应用技术有限公司。
1.3 方法
1.3.1 试材处理
定量称取糙米(水分含量14%),用酸性雾化液在恒温发芽箱内雾化加湿,水分达到20%之前,培养箱温度设定为24 ℃,吸水速率控制在0.5%/h以下,环境湿度控制在75%以上(阶段A);之后设定培养箱温度为30 ℃,加湿至含水量26%,吸水速率控制在0.5%/h~1.2%/h,环境湿度控制在90%以上(阶段B);整个加湿时间为17~21 h。在加湿过程中,通入臭氧,以防止杂菌感染。
1.3.2 雾化液pH值的选择
采用50 mmol/L的柠檬酸缓冲液为雾化加湿液:调节pH值分别为2.5、3.5、4.5、5.5和6.5,固定VB6浓度2 mmol/L、CaCl2浓度10 mmol/L,研究雾化液pH值对糙米活性化过程中GABA富集的影响。
1.3.3 VB6浓度的选择
固定pH 3.5、CaCl2浓度10 mmol/L,设置VB6浓度为0、2、4、6、8 mmol/L,研究VB6浓度对活性化糙米GABA富集的影响。
1.3.4 CaCl2浓度的选择
固定pH值及VB6浓度分别为3.5 mmol/L和2 mmol/L,设置CaCl2浓度为6、8、10、12、14 mmol/L,研究CaCl2浓度对活性化糙米GABA富 集的影响。
1.3.5 正交试验
在单因素试验获得雾化液最适pH值、VB6最适浓度和CaCl2最适浓度的基础上,进行三因素三水平L9(33)正交试验。
1.3.6 动力学实验
采用上述试验中优化出的条件对糙米加湿至水分含量为26%时需18.5 h,每隔4 h取样一次,研究活性化过程中GABA、谷氨酸(glutamic acid,Glu)、游离氨基酸、可溶性蛋白含量及GAD活力等指标的变化。
1.3.7 指标测定
含水率:采用质量恒定法测定,以每克干基含水量表示;淀粉含量:按GB/T 5009.9—2008《食品中淀粉的测定》[13]方法测定;可溶性蛋白含量:采用考马斯亮蓝G-250法[14]测定,以牛血清白蛋白为标准;还原糖含量:采用3′5-二硝基水杨酸(3′5-dinitrosalicylic acid,DNS)法[14]测定;游离氨基酸含量:采用茚三酮比色法[14]测定。
GABA及Glu含量:采用高效液相色谱法[15-16]测定:称取糙米2.5 g→加入7%乙酸1 mL于研钵中→研成匀浆→转移到10 mL离心管中→再用7%乙酸提取液洗涤研钵2 次,每次2 mL,洗涤液亦转入离心管→提取1 h→4 000 r/min的转速离心10 min→取上清液+5 mL无水乙醇(沉淀多糖,4 ℃,至少2 h)→4 000 r/min离心20 min→上清液转移至50 mL烧杯内→于90 ℃水浴中蒸干(40 min)。溶于1 mol/L Na2CO3-NaHCO3缓冲液(pH 9.0)中,取适量样品溶液与等体积的氨基酸衍生剂(4 mg/mL的4-二甲氨基偶氮苯磺酰氯丙酮溶液)混合,于67 ℃水浴中反应10 min后立即置于冰浴中终止反应,反应液于6 000×g离心20 min,上清液经0.45 μm滤膜过滤后备用。
GAD活性:在文献[17]基础上略作修改。取1 g鲜样,用5 mL 70 mmol/L的磷酸钾缓冲溶液(pH 5.8,含有2 mmol/L β-巯基乙醇、2 mmol/L EDTA、0.2 mmol/L PLP和10%丙三醇)研磨成匀浆后,于4 ℃、10 000×g离心20 min,上清液即为酶粗提液。取200 μL粗酶液和100 μL底物(1% Glu,pH 5.8),40 ℃反应2 h后,90 ℃水浴10 min终止反应。混合物经离心后,测定上清液中GABA含量。以每小时生成1 μmol GABA作为1 个活力单位(U)[16-17]。
1.4 数据统计与分析
实验设3 次重复,各重复测定3 次,用Excel、SigmaPlot及SAS软件进行数据处理和分析,结果以±s表示。
2 结果与分析
2.1 雾化液pH值对活性化糙米中GABA含量的影响

图1 不同雾化液pH值条件下活性化糙米中GABA含量变化Fig.1 Change in GABA contents of activated brown rice at different pH values
由图1可知,随着雾化液pH值升高,GABA含量呈现先增加后逐渐下降的趋势,当pH值为3.5时,活性化糙米中GABA的富集量最大,为原料的2.69 倍,比pH 5.5时高1.53 mg/100 g。GABA的生成需要消耗H+,因而H+浓度较高时有利于GABA生成[18]。植物中GAD最适pH值为5~6,浸泡发芽时将缓冲液的pH值调节至5~6有利于刺激植物体中GAD活性,以富集GABA;在此较低的pH值条件下,GABA转氨酶(最适pH>8)[10]活性较低,不利于GABA的转氨,这有利于抑制GABA的分解。本实验采用微量吸水湿润发芽方法时,雾化液被缓慢渗入糙米内部,因而需要更高的H+浓度来激发GAD活性,使Glu脱羧,生成GABA。可见,雾化液pH 3.5时有利于更多H+进入糙米内部。尽管pH 2.5时H+浓度较高,但酸度过大影响糙米的生命活力及GAD活性,因而pH 3.5为雾化液的适宜pH值。
2.2 VB6浓度对活性化糙米中GABA含量的影响
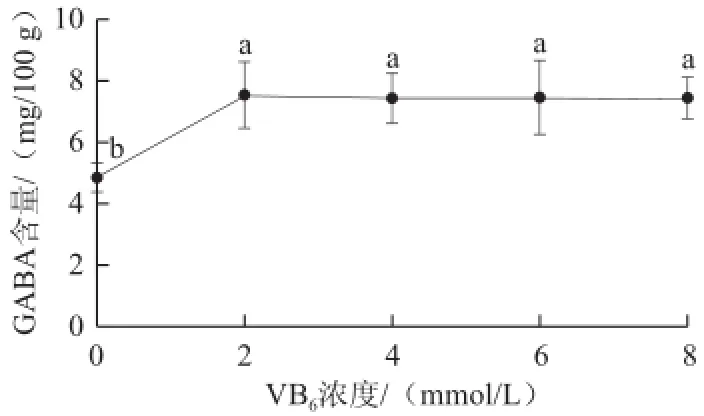
图2 不同VVBB6浓度条件下活性化糙米GABA含量变化Fig.2 Change in GABA contents of activated brown rice at different VB6concentrations
由图2可知,在柠檬酸雾化液中添加VB6有显著提高活性化糙米中GABA含量的作用。VB6是磷酸吡哆醇、PLP及磷酸吡哆胺的复合物,与PLP对合成GABA的GAD活性有着同样的作用[18]。GAD为PLP与蛋白质的复合体,为PLP依赖型酶[10]。由于采用微量雾化吸水法,雾化液中的组分多停留在糙米粒表面,无法像浸泡发芽一样快速进入糙米中发挥作用。
2.3 CaCl2浓度对活性化糙米中GABA含量的影响

图3 不同CCaaCCll2浓度条件下活性化糙米中GABA含量变化Fig.3 Change in GABA contents of activated brown rice at different CaCl2concentrations
由图3可知,当CaCl2浓度为10 mmol/L时GABA含量最高,而当浓度为6、8、12、14 mmol/L时无显著差异,且均 比浓度10 mmol/L略低。GABA支路中GAD为Ca2+/钙调蛋白(CaM)依赖性酶,Ca2+有调节其活性、促进GABA合成的作用[19]。
2.4 培养条件优化
2.4.1 正交试验结果
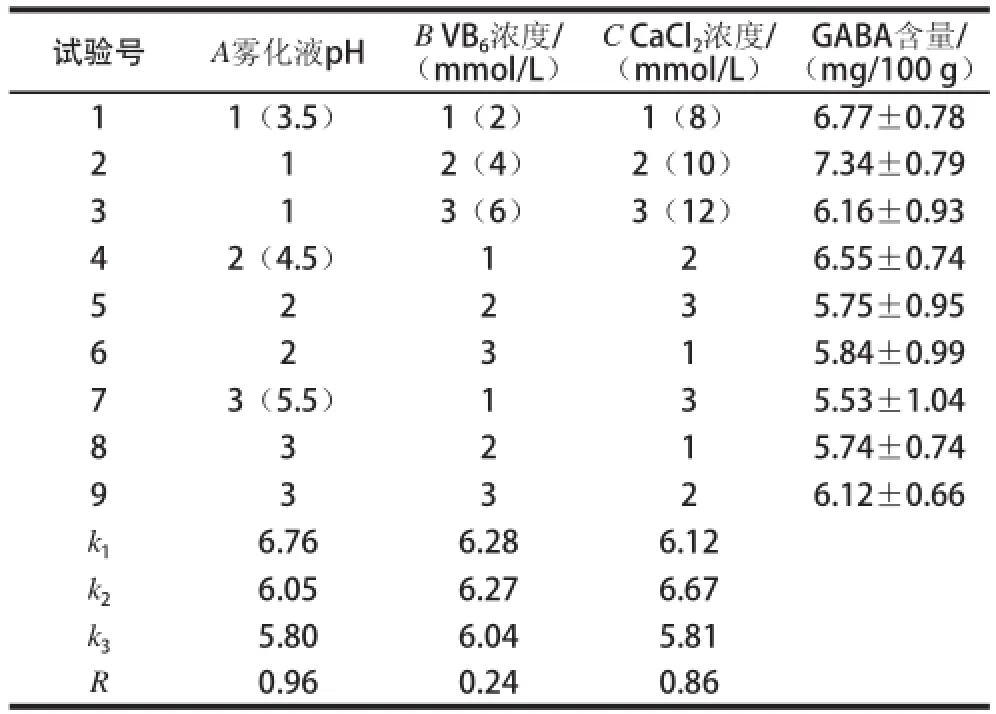
表1 正交试验设计与结果Table1 Orthogonal array results and analysislysis

表2 方差分析表Table2 Analysis of varianceiance
由表1可见,雾化液的pH值、VB6浓度、CaCl2浓度三因素对糙米发芽富集GABA影响大小顺序依次为雾化液pH值>CaCl2浓度>VB6浓度。雾化液pH值对GABA含量影响在0.01水平上显著,CaCl2浓度对GABA含量影响在0.05水平上显著(表2)。糙米微量吸水富集GABA最适培养条件为:雾化液pH 3.5、VB6浓度2 mmol/L、CaCl2浓度10 mmol/L。
2.4.2 验证实验
以雾化液pH 5.5、VB6浓度2 mmol/L、CaCl2浓度10 mmol/L的随机组合为对照,验证正交试验结果的准确性,结果见表3。经最佳组合处理得到的活性化米中GABA含量高于随机组合,表明实验结果可靠。

表3 验证实验及结果Table3 Results of validation experimentsments
2.5 动力学实验
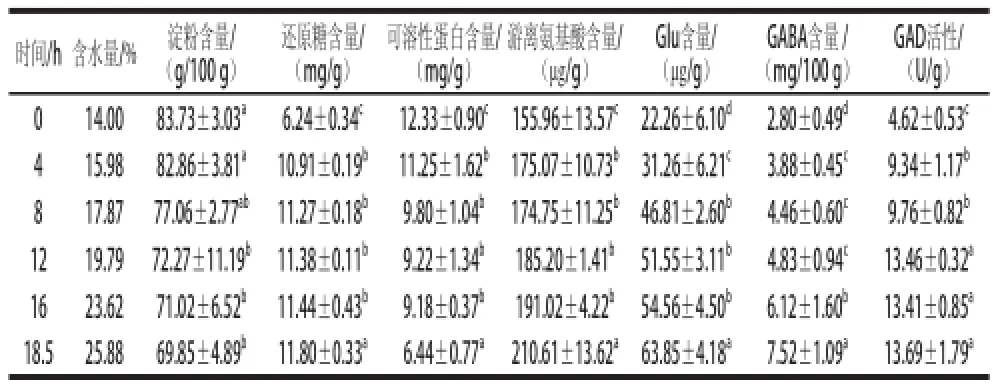
表4 糙米活性化过程中主要物质含量和GAD活性变化Table4 Changes in main components contents and GAD activity during brown rice activaattiioonn
如表4所示,随着加湿时间的延长,糙米中GABA、Glu含量和GAD活性均呈上升的趋势,GAD活性最后趋于平缓。大分子物质如淀粉和蛋白质逐渐分解成生命活动需要的小分子物质,呈现下降趋势,游离氨基酸和还原糖含量变化比较平缓,总体呈上升趋势。糙米发芽过程中,大量酶原被激活和释放[20],催化一系列生化反应,将糙米中淀粉、蛋白质、脂肪等大分子物质分解,同时合成新的物质,供生长之用。本研究中仅对糙米进行了雾化增湿处理,得到的活性化糙米吸水量远低于浸泡发芽的糙米,未长出幼芽,因而淀粉和还原糖等碳水化合物、蛋白质和游离氨基酸等含氮物质的消耗较少。
2.6 活性化糙米中生理生化变化的相关性
从表5可以看出,糙米活性化过程中GABA、Glu、游离氨基酸、可溶性蛋白主要物质含量之间均呈显著相关,说明 糙米在微量吸水活性化过程中,大分子物质逐渐分解成小分子物质,以供糙米籽粒生命活动,在此过程中芽体萌动,酶源被激活,其中GABA由Glu在GAD的作用下脱羧形成,相关性分析 表明它们含量为正相关关系。这是因为糙米活性化过程中蛋白酶被激活,氨基酸代谢加强,而Glu为氨基酸代谢中枢纽[21],在其被GAD催化脱羧的同时,也被大量生成。还原糖和淀粉含量之间无显著相关性,可能原因 是糙米微量吸水活性化过程仅为芽体萌动的过程,物质消耗并不明显;此外,在活性化过程中淀粉亦可分解为α-界限糊精等物质[22],由于活性化时间较短,未能完全将淀粉酶活性激活,因而未能将其分解为还原性糖。

表5 糙米活性化过程中主要物质含量之间的相关性Table5 Correlation analysis of biochemical indicators in activated brown rice under the optimum condition of culture solution
3 结 论
糙米采用湿润吸水的活性化过程中富集GABA的最优雾化液pH 3.5、VB6浓度2 mmol/L、CaCl2浓度10 mmol/L;在此条件下,活性化糙米中GABA含量可达7.67 mg/100 g,为原料糙米的2.74 倍;随着活性化时间的延长,糙米中游离氨基酸、还原糖含量和GAD活力呈现逐渐增加的趋势,可溶性蛋白及淀粉含量呈现逐渐下降趋势,部分大分子物质分解成小分子物质,以供糙米生命活动之需。
[1] WATCHARARPARPAIBOON W LAOHAKUNJIT N KERDCHOECHUEN O et al An improved process for high quality and nutrition of brown rice production[J]. Food Science and Technology International′2010′16(2): 147-158.
[2] LAMBERTS L de BIE E VANDEPUTTE G E et al Effect of milling on colour and nutritional properties of rice[J]. Food Chemistry′2007′100(4): 1496-1503.
[3] PATIL S B KHAN M K Germinated brown rice as a value added rice product a review[J]. Journal of Food Science and Technology′2011′48(6): 661-667.
[4] DEE WATTHANAWONG R ROWELL P WATKINS C B et al. γ-Aminobutyric acid (GABA metabolism in CO2treated tomatoes[J]. Postharvest Biology and Technology′2010′5 7(2): 97-105.
[5] IVERSEN L GABA pH armacology-what prospects for the future[J]. Biochemical Pharmacology′2004′68(8): 1537-1540.
[6] TSUKATANI T MATSUMOTO K Sequential fl uorometric quantification of γ-aminobutyrate and l-glutamate using a single line flow-injection system with immobilized enzyme reactors[J]. Analytica Chimica Acta′2005′546(2): 154-160.
[7] OBATA K HIRONO M KUME N et al GABA and synaptic inhibition of mouse cerebellum lacking glutamate decarboxylase 67[J]. Biochemical and Biophysical Research C ommunications′2008′370(3): 429-433.
[8] 韩永斌′顾振新′蒋振晖. Ca2+浸泡处理对发芽糙米生理指标和GABA等物质含量的影响[J]. 食品科学′2006′27(10): 58-61.
[9] SHELP B J BOWN A W MCLEAN M D et al Metabolism and functions of gamma-am inobutyric acid[J]. Trends in Plant Science′1999′4(11): 446-452.
[10] 蒋振晖′顾振新. 高等植物体内γ-氨基丁酸合成′代谢及其生理作用[J]. 植物生理学通讯 ′2003′39(3): 249-254.
[11] 王京厦. 发芽糙米工艺研究[D]. 雅安: 四川农业大学′2006.
[12] 蒋晨虹′顾颖娟′薛梅′等. 一种发芽糙米白米的制备方法: 中国′201110383546.6[P]. 2012-06-13.
[13] 卫生 部. GB/T 5009.9—2008 食品中淀粉的测定[S]. 北京: 中国标准出版社′2008.
[14] 李合生. 植物生理生化实验原理与技术[M]. 北京: 高等教育出版社′2000: 182-197.
[15 ] YANG Runqiang GUO Qianghui GU Zhenxin et al GABA shunt and polyamine degradation pathway on γ-aminobutyric acid accumulation in germinating fava bean under hypoxia[J]. Food Chemistry′2013′136(1): 152-159.
[16] BAI Qingyun CHAI Me iqing GU Zhenxin et al Effects of components in culture medium on glutamate dec arboxylase activity and γ-aminobutyric acid accumulation in foxtail millet during germination[J]. Food Chemistry′2009′116(1): 152-157.
[17] GUO Yingjuan YANG Runqiang CHEN Hui et al Accumulation of γ-aminobutyri c acid in germinated soybean (Glycine max L.) in relation to glutamate decarboxylase and diamine oxidase activity induced by additives under hypoxia[J]. European Food Research and Technology′2012′234(4): 679-687.
[18] 陈惠. 发芽蚕豆γ-氨基丁酸富集与调控技术研究[D ]. 南京: 南京农业大学′2012.
[19] TOKUNAGA M NAKANO Y KITAOKA S et al The GABA shunt in the callus cells derived from soybean cotyledon[J]. Agricultural and Biological Chemistry′1976′40(1): 115-120.
[20] 孙向东. 发芽糙米研究最新进展[J]. 中国稻米′2005(3): 5-8.
[21] 杨志敏. 生物化学[M]. 2版. 北京: 高等教育出版社′2010: 325-327.
[22] 蒋振晖. Ca2+和通气处理对糙米发芽过程中主要物质变化的影响及γ-氨基丁酸富集技术研究[D]. 南京: 南京农业大学′2003.
Optimization of Atomized Liquid Components for γ-Aminobutyric Acid Accumulation in Activated Brown Rice
GENG Chengxin YANG Runqiang GU Zhenxin*
(College of Food Science and Technology Nanjing Agricultural University Nanjing 210095′China)
The VB6and CaCl2concentration and pH of citric acid atomized liquid for γ-aminobutyric acid (GABA accumulation in activated brown rice were optimized by single-factor and orthogonal array experiments Besides the changes in glutamate decarboxylase (GAD activity and main component conten ts of activated brown rice were studied Results showed that the optimum atomized liquid contained 2 mmol/L VB6and 10 mmol/L CaCl2at pH 3.5. Under these conditions GABA content of activated brown rice reached 7.67 mg/100 g which was a 2.74-fold increase over that of raw brown rice During the activation process the contents of free amino acids reducing sugar and GAD activity were all increased while the contents of both soluble protein and starch were decreased Correlation analysis showed that the content of GABA was significantly correlated with the contents of Glu free amino acids and soluble protein respectively.
activated brown rice; γ-aminobutyric acid pH VB6; CaCl2
TS255.1
A
1002-6630(2015)06-0035-05
10.7506/spkx1002-6630-201506007
2014-08-02
粮食公益性行业科研专项(201313011-4)
耿程欣(1990—),女,硕士研究生,研究方向为食品中功能成分的富集技术。E-mail:2012108018@njau.edu.cn
*通信作者:顾振新(1956—),男,教授,博士,研究方向为生物技术与功能食品。E-mail:guzx@njau.edu.cn
