人工培育蝉花虫草的抗肿瘤活性
2015-12-13陈安徽李继武蒋昭志陈宏伟
陈安徽,邵 颖,李继武,蒋昭志,陈宏伟
(1.徐州工程学院 江苏省食品资源开发与质量安全重点建设实验室,江苏 徐州 221008;2.亳州千草药业有限公司,安徽 亳州 236800)
人工培育蝉花虫草的抗肿瘤活性
陈安徽1,邵 颖1,李继武2,蒋昭志2,陈宏伟1
(1.徐州工程学院 江苏省食品资源开发与质量安全重点建设实验室,江苏 徐州 221008;2.亳州千草药业有限公司,安徽 亳州 236800)
以天然蝉花虫草生药为对照,以中国仓鼠卵巢肿瘤(Chinese hamster ovary,CHO)细胞株为模型,采用刃天青染色法检测人工培育蝉花虫草的抗肿瘤活性。结果表明:人工培育蝉花虫草和天然蝉花虫草生药都具有抗肿瘤活性,且活性成分均为中等极性化合物。对人工培育蝉花虫草中的抗肿瘤活性成分进行分离制备,得到两种化合物,命名为化合物1和化合物2。化合物1经鉴定为虫草素,化合物2经纯度验证为纯品,活性验证结果发现当其质量浓度为50 μg/mL时,对CHO细胞抑制率高达(94.55±2.33)%。
人工培育蝉花虫草;抗肿瘤活性;CHO细胞;虫草素
蝉花(Cordyceps cicadae)又名蝉茸、蝉草等,是蝉拟青霉(Paecilomyces cicadae)等真菌寄生于一些蝉若虫后形成的菌虫复合体,是我国传统中药材[1-4]。蝉花具有多种药用价值,古代和现代医书《证类本草》、《本草纲目》、《中华药物大全》和《中华药海》中就记载蝉花有主治小儿天吊、夜啼心悸、解痉、散风热,治疗麻疹、多泪、目赤等功效[5],近代沪上名医陈以平教授还最早使用蝉花代替冬虫夏草治疗慢性肾功能衰竭,并取得显著成效[6]。但是近年来天然野生蝉花资源短缺,使得蝉花的人工培育及其人工培养物的功效价值受到了广泛关注[7-11]。陈祝安等[12]于自然基物上对蝉拟青霉进行人工培养获得了类似虫体生的孢梗束,并发现人工培养物具有明显的镇痛、镇静、解热等作用,毒理学实验还表明人工培育蝉花还具有低毒的特性;徐红娟等[13]对蝉拟青霉进行液体深层发酵,并从发酵菌丝体中分离得到具有抗真菌活性的多球壳菌素;蝉花人工培养菌丝体经系统翔实研究显示其具有与天然蝉花相似的改善肾功能的功效[14-18];许多学者对蝉拟青霉多糖进行了系统研究,佐证了其明显提高机体免疫力[19-22]、调节脂类代谢[23]、促进造血、提升营养状况[24]的作用;陈柏坤等[25]曾提出蝉拟青霉多糖可能具有直接抑制白血病细胞株U937、K562的能力,但至今未见有关蝉花人工培养孢梗束及培养基质抗肿瘤活性的研究。本研究以天然蝉花虫草生药为对照,以中国仓鼠卵巢肿瘤(Chinese hamster ovary,CHO)细胞株为模型,研究人工培育蝉花孢梗束及其培养基质的抗肿瘤活性,并对人工培育蝉花孢梗束中的抗肿瘤活性成分进行分离,以期为人工培育蝉花替代野生资源及人工培养物的应用提供参考。
1 材料与方法
1.1 材料与培养基
天然蝉花虫草采集自安徽省萧县皇藏峪风景区;无性型菌株保存于徐州工程学院食品学院实验室。
液体种子培养基:马铃薯200 g(煮汁后4 层纱布过滤)、葡萄糖20 g、纯水1 L,121 ℃灭菌20 min。
虫草栽培培养基:每只栽培瓶中装小麦粒30 g、蝉幼虫干粉5 g、纯水50 mL,121 ℃灭菌30 min。
细胞培养基:DMEM/F12液体培养基(含10%小牛血清以及100 μg/mL青霉素和100 μg/mL链霉素),121 ℃灭菌20 min。
1.2 方法
1.2.1 虫草栽培及样品制备
蝉拟青霉固体斜面种子接入灭菌后冷却至室温的三角瓶种子培养基中(500 mL三角瓶装液量为100 mL、接种量为10%),置入25 ℃恒温振荡培养箱,培养5 d备用。虫草栽培采用圆柱形培养瓶(直径15 cm、高18 cm)进行,固体物料混匀后按照比例加水,浸泡2 h后进行高温灭菌(121 ℃,30 min),灭菌结束后冷却至室温,将制备好的液体种子按照每瓶10 mL的接种量接入固体培养基表面。接种后的栽培瓶放入20 ℃培养箱避光培养5 d,培养箱温度调整为25 ℃、光照时间为12 h/d,待培养瓶中产生大量孢梗束,并且孢梗束顶部产生大量孢子时即可采收虫草部分及收集基质(虫草采集后剩下的培养基部分)备用。
干燥后的蝉花虫草孢梗束及基质(粉碎后过10 目筛)分别用石油醚、二氯甲烷、乙酸乙酯,甲醇进行提取,提取条件:料液比为1∶10(m/V),超声波(功率300 W,频率20 kHz)浸提40 min后过滤收集滤液,各提取相脱除溶剂后采用12.5%二甲基亚砜(dimethyl sulfoxide,DMSO)溶液配成100 μg/mL的样品溶液,采用0.15 μm孔径的一次性除菌过滤器过滤后备用。
1.2.2 细胞毒性实验
细胞培养:将进入对数分裂期的CHO细胞从培养瓶中转移到96 孔板中培养,以4.0×104个/孔接种,每孔接种量100 μL,接种后的酶标板置于CO2培养箱(CO2体积分数为5%)中37 ℃培养24 h,同时留出3 个空白孔(不加细胞)。待细胞贴壁后,用移液器移出培养液,然后逐孔加入90 μL新鲜培养液和10 μL样品溶液,同时设置100%阳性对照组、0%空白对照组,100%和0%对照孔中分别加入90 μL新鲜培养液和10 μL 12.5% DMSO(其中100%阳性对照组是3 个无细胞的空白孔),每组设3 个重复,置入5% CO2培养箱中37 ℃培养72 h后,每孔加20 μL 0.05%刃天青,于培养箱中继续培养2 h,用酶标仪在激发波长530 nm,发射波长590 nm条件下检测荧光强度。按下式计算肿瘤细胞抑制率。

式中:FLU100%为阳性对照组荧光强度;FLU0%为溶剂空白对照组的荧光强度。
1.2.3 抗肿瘤成分的分离纯化和制备
将人工培育蝉花虫草的乙酸乙酯提取物配成30 mg/mL的甲醇溶液,用0.22 μm孔径的滤膜过滤后,直接进行高效液相色谱(high performance liquid chromatography,HPLC)法分析。色谱条件为:色谱柱依利特Hypersil ODS2;进样量50 μL;洗脱速率3mL/min;流动相0~5 min 100%水,5~20 min 30%乙腈,20~40 min 60%乙腈,40~50 min 100%乙腈,50~60 min 100%水;检测波长210 nm。采用样品管按峰收集洗脱相,先在减压环境下蒸发掉甲醇,然后真空冷冻干燥。干燥后每管加20 μL 12.5%的DMSO溶解后,取10 μL按照1.2.2节方法进行活性测定,确定活性物质的出峰时间,然后多次进样后收集活性物质色谱峰中间位置的洗脱相。
1.2.4 活性物质的纯度及活性验证
利用薄层层析法和HPLC法进行纯度鉴定。
2 结果与分析
2.1 蝉花虫草的抗肿瘤活性
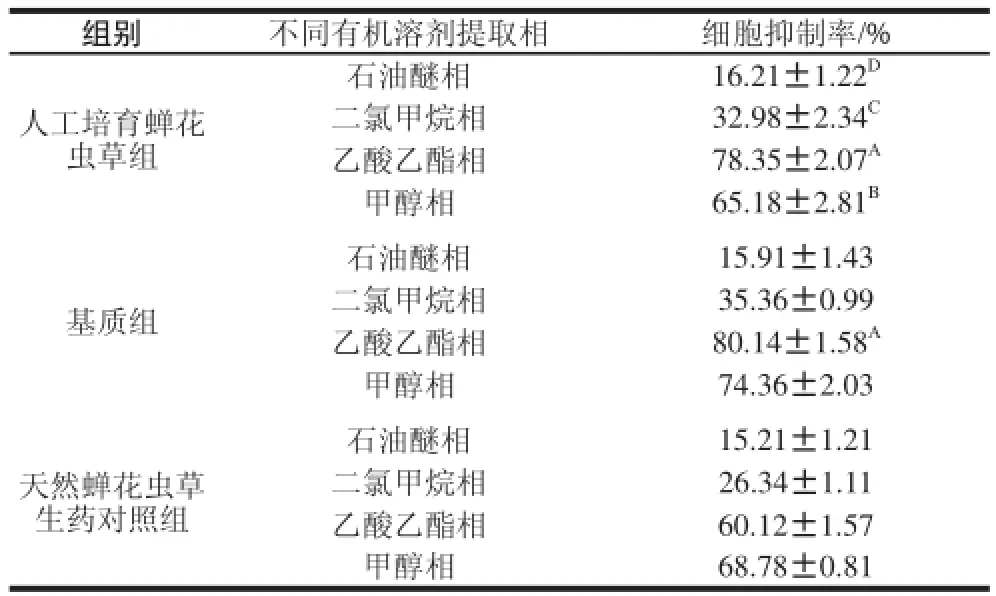
表1 蝉花虫草及基质不同有机溶剂提取物对CHO细胞的毒性Table 1 Cytotoxicity of different organic solvent extracts from fruiting bodiess ooff Cordyceps cicaaddaaee and the compost
由表1可知,人工培育蝉花虫草和野生天然蝉花生药均具有一定的抗肿瘤活性,并且两样品的抗肿瘤成分主要存在于乙酸乙酯提取相和甲醇提取相中,这说明蝉花虫草中抗肿瘤活性物质主要是中等极性偏强的成分。实验结果表明,不同有机溶剂提取相抗肿瘤活性差异非常显著,如人工培育蝉花虫草乙酸乙酯提取相的抗肿瘤活性极显著高于石油醚相(P<0.01),其对肿瘤细胞抑制率达到78.35%,是石油醚相的4.9 倍。另外,发现人工培育蝉花虫草和基质的不同溶剂提取相均具有一定抗肿瘤活性,其最强活性成分均存在于乙酸乙酯提取相中,经统计分析,人工培育蝉花虫草和基质的乙酸乙酯提取相对肿瘤细胞的抑制率无显著差异(P>0.05)。由实验结果可以看出,人工培育蝉花虫草、基质、天然蝉花虫草生药均有一定的抗肿瘤活性,为抗肿瘤药物的开发提供了新药源。结果发现人工培育蝉花虫草及基质的甲醇相亦具有很强的抑制肿瘤活性,但是物质的极性相对较强,不利于后期的分离纯化,本实验仅对样品乙酸乙酯提取相中抗肿瘤活性成分进行进一步的分离纯化。
2.2 蝉花虫草抗肿瘤活性成分的分离制备结果
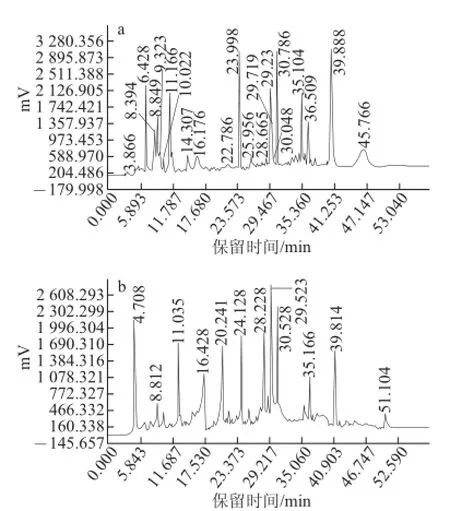
图1 人工培育蝉花虫草(a)和基质(b)乙酸乙酯提取相的HPLC图Fig.1 Chromatograms of ethyl acetate extracts from cultured fruiting bodies of Cordyceps cicadae (a) and the compost (b)
由图1可知,人工培育蝉花虫草和基质乙酸乙酯提取相中成分均较多,并且两图色谱峰并不完全一致,但是有些成分的保留时间几乎完全一致,如在8.8、11、16、24、30 min等多处保留时间均有洗脱主峰出现。

表2 不同HPLC馏分的抗肿瘤活性Table 2 Cytotoxicity assay of HPLC eluates
由表2可知,人工培育蝉花虫草和基质乙酸乙酯提取相中多个成分均具有一定抗肿瘤活性,其中虫草乙酸乙酯提取相的抗肿瘤活性成分色谱峰保留时间主要是23.998 min和39.888 min;基质乙酸乙酯提取相抗肿瘤活性成分色谱峰保留时间主要是24.128 min和39.814 min,即两种提取物中抗肿瘤活性成分的保留时间几乎一致,为进一步验证两样品中24 min处的洗脱物是否为同种成分,进行薄层层析,发现两样品在薄层板上Rf值完全一致,混合后记为样品1进行点样,在薄层板上均出现一个斑点,初步判定两样品为同一种成分。进一步验证40 min左右处的两样品洗脱相,合并记为样品2,分析发现两洗脱组分亦为同种成分,出现这种情况的可能原因是基质样品中的培养基成分几乎已被消耗殆尽,其中主要是蝉拟青霉菌丝体,可能菌丝体代谢物中抗肿瘤活性主要成分和子实体中的主要抗肿瘤活性成分是一致的。下一步实验主要针对人工培育蝉花虫草乙酸乙酯提取相中抗肿瘤活性成分进行分离。
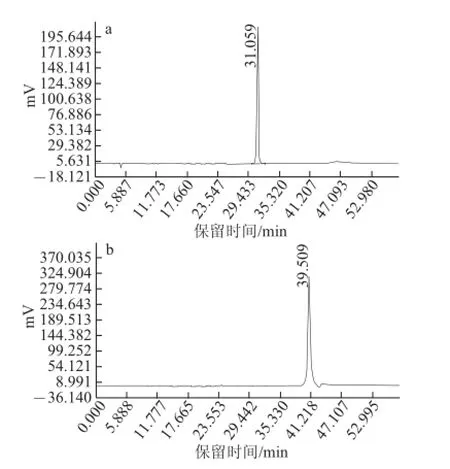
图2 样品1(a)和样品2(b)的HPLC图Fig.2 Chromatograms of sample 1 (a) and sample 2 (b)
将人工培育蝉花虫草乙酸乙酯提取相按照1.2.3节所述方法采用HPLC进行制备,主要收集23.998 min和39.888 min处的洗脱液,为保证样品纯度,主要收集色谱峰中间处的洗脱液,多次收集合并后备用。如图2所示,将保留时间在30、40 min左右的化合物分别命名为化合物1和化合物2。经与虫草产品中常见化合物标准品比对,发现化合物1的HPLC峰和薄层色谱(thin layer chromatogram,TLC)图中Rf值都与虫草素标准品完全一致。另外,化合物1的紫外光谱具有典型的核苷类260 nm波长处特征峰,因此可确定化合物1的成分为虫草素。虫草素是已知的对肿瘤细胞有毒性的物质,但其活性较低,本实验结果与相关文献报道一致。化合物2与虫草产品中常见化合物标准品比对,未发现色谱条件完全一致的成分,初步判定此化合物可能为一种新的化合物或一种已知但不常见的化合物。
2.3 制备样品纯度及活性验证结果
将制备得到的化合物2经HPLC进行进一步纯度验证,结果见图3。

图3 化合物2的纯度验证HPLC图Fig.3 Chromatogram of compound 2
由图3可知,采用不同流动相进行洗脱,色谱图中均只有一个主峰出现,可初步判定该化合物为纯品。进一步采用TLC(展开剂为乙酸乙酯-甲醇(8∶2,V/V))对化合物2进行纯度分析,结果如图4所示,薄层板上采用不同显色剂显示,均出现一个样品斑点,由此可初步判定该化合物为纯品。

图4 化合物2的TLC图Fig.4 TLC chromatogram of compound 2
对收集到的化合物2,脱除溶剂后真空冷冻干燥。干燥样品以12.5% DMSO溶解稀释,使样品质量浓度为500 μg/mL(检测终质量浓度50 μg/mL),样品经0.15 μm孔径一次性过滤器过滤除菌,进行活性验证。结果发现化合物2在质量浓度为50 μg/mL时,对CHO细胞的抑制率达到(94.55±2.33)%。
3 讨 论
蝉花虫草为一种传统的滋补佳品,在我国有悠久的应用历史。近年来,随着蝉花虫草应用范围的扩大,天然蝉花虫草生药已经不能满足市场需求,人工培育的蝉花虫草已逐步替代天然蝉花虫草生药解决了药源紧缺的问题。目前对人工培育蝉花虫草的研究报道相对较少,尤其是对人工培育蝉花虫草抗肿瘤活性的系统研究更是未见报道。本研究发现人工培育蝉花虫草及天然蝉花虫草生药均具有较强的抗肿瘤活性,并且人工培育蝉花虫草采收后的基质也具有较强的抗肿瘤活性,这说明单纯从抗肿瘤活性来说,可以将人工培育蝉花虫草和培养基质共同使用,不需要单独分开采收。实验对蝉花虫草中抗肿瘤活性成分进行了研究,发现人工培育蝉花虫草和基质中主要抗肿瘤活性成分为同种化合物。对样品中的抗肿瘤成分分离过程中发现,人工培育蝉花虫草抗肿瘤成分主要为两种,其中一种为虫草素,另一种化合物在质量浓度为50 μg/mL时对CHO细胞的抑制率达到(94.55±2.33)%。该研究不仅充分证明蝉花虫草可以作为抗肿瘤药物或保健品的较佳原料,同时也为蝉花虫草资源的开发与应用提供了研究基础。
[1] 张红霞, 高新华, 陈伟, 等. 人工培育蝉花与天然蝉花中化学成分的比较[J]. 食用菌学报, 2012, 19(3): 59-62.
[2] 彭凡, 李春如, 耿德贵. 传统中药蝉花退化菌种虫体复壮的初步研究[J]. 安徽农业大学学报, 2014, 41(2): 1-5.
[3] 王琪, 刘作易. 药用真菌蝉花的研究进展[J]. 中草药, 2004, 34(4): 469-471.
[4] 王琼, 王春雷, 何福根, 等. 地方药材金蝉花的研究进展[J]. 肿瘤学杂志, 2013, 19(3): 227-230.
[5] 王春雷, 芦柏震, 侯桂兰. 中国蝉花的研究进展[J]. 中国药学杂志, 2006, 41(4): 244-247.
[6] 王海颖, 陈以平. 陈以平教授巧用蝉花经验[J]. 中国中医药信息杂志, 2000, 7(10): 71.
[7] 胡海燕, 邹晓, 罗力, 等. 传统中药蝉花的活体家蚕人工培养[J]. 中国中药杂志, 2009, 34(17): 2140-2143.
[8] 刘广玉, 胡菽英. 天然蝉花与人工培养品的镇静镇痛作用的比较[J].现代应用药学, 1991, 8(2): 5-8.
[9] 刘森琴, 温鲁, 夏敏, 等. 人工培育蝉花的活性成分含量测定[J]. 安徽农业科学, 2008, 36(2): 429; 467.
[10] 温鲁, 唐玉玲, 张平. 蝉花与有关虫草活性成份检测比较[J]. 江苏中草药, 2006, 27(1): 45-46.
[11] 葛飞, 夏成润, 李春如, 等. 蝉拟青霉菌丝体与天然蝉花中化学成分的比较分析[J]. 菌物学报, 2007, 26(1): 68-75.
[12] 陈祝安, 刘广玉, 胡菽英. 蝉花的人工培养及其药理作用研究[J]. 真菌学报, 1993, 12(2): 138-144.
[13] 徐红娟, 莫志宏, 余佳文, 等. 蝉花抗真菌活性成分的分离纯化研究[J].天然产物研究与开发, 2010(22): 794-797.
[14] 金周慧, 陈以平, 邓跃毅. 蝉花菌丝延缓肾小球硬化的作用机制研究[J]. 中国中西医结合肾病杂志, 2005, 6(3): 132-136.
[15] 王琳, 陈以平. 人工培育蝉花菌丝对人系膜细胞增殖及细胞外基质合成的影响[J]. 中医研究, 2006, 19(10): 9-11.
[16] 朱戎, 陈以平, 邓跃毅, 等. 固体培育蝉花菌丝延缓肾小球硬化作用及其机制的实验研究[J]. 中国中西医结合肾病杂志, 2005, 6(2): 70-74.
[17] 闵旸, 戚蓓茵, 谢炜, 等. 蝉花菌丝体抗肾功能衰竭药效学研究[J].中国药理通讯, 2004, 21(3): 19.
[18] 朱戎, 邓跃毅, 陈以平. 蝉花菌丝有效组分延缓慢性肾功能衰竭进程的研究[C]//第四届国际中西医结合肾脏病学术会议论文汇编. 天津: 中国中西医结合学会肾脏病专业委员会, 2006: 40.
[19] 陈秀芳, 金丽琴, 吕建新, 等. 蝉拟青霉对大鼠腹腔及肺泡巨噬细胞的激活作用[J]. 中国病理生理杂志, 2002, 18(6): 694-697.
[20] 金丽琴, 吕建新, 杨介钻, 等. 蝉拟青霉总多糖对大鼠非特异性免疫调节作用的研究[J]. 中国病理生理杂志, 2001, 17(12): 1232-1235.
[21] 金丽琴, 吕建新, 杨介钻, 等. 蝉拟青霉总多糖对老龄大鼠组织器官免疫功能调节的实验研究[J]. 中国老年学杂志, 2005, 25(1): 82-84.
[22] 金丽琴, 吕建新, 杨介钻, 等. 蝉拟青霉总多糖对老龄大鼠巨噬细胞的激活作用[J]. 中国病理生理杂志, 2006, 22(1): 116-119.
[23] 杨介钻, 金丽琴, 吕建新, 等. 蝉拟青霉多糖抗衰老作用的实验研究[J].中国老年学杂志, 2004, 24(4): 343-344.
[24] 陈秀芳, 金丽琴, 吕建新, 等. 蝉拟青霉对大鼠营养状况的影响[J].温州医学院学报, 2005, 35(1): 13-15.
[25] 陈柏坤, 杨介钻, 卓佳, 等. 蝉拟青霉多糖对人外周血单个核细胞及白血病细胞株U937、K562增殖的调节作用[J]. 温州医学院学报, 2006, 36(4): 341-344.
Antitumor Activity of Cultured Fruiting Bodies of Cordyceps cicadae
CHEN Anhui1, SHAO Ying1, LI Jiwu2, JIANG Zhaozhi2, CHEN Hongwei1
(1. Jiangsu Key Construction Laboratory of Food Resource Development and Quality Safe, Xuzhou Institute of Technology,Xuzhou 221008, China; 2. Bozhou Qiancao Pharmaceutical Co. Ltd., Bozhou 236800, China)
The antitumor activity of the cultured fruiting bodies of Cordyceps cicadae on Chinese hamster ovary (CHO) cells was investigated by measuring cell viability using a resazurin reduction assay in comparison with that of wild Cordyceps cicadae. The experimental results showed that both samples had antitumor activity and contained mid-polar compounds. Two bioactive compounds, namely components 1 and 2, were separated from the cultured fruiting bodies of Cordyceps cicadae. Component 1 was identifi ed as cordycepin. Component 2 (50 μg/mL) was identifi ed as a purifi ed compound that could inhibit the viability of CHO cells by up to (94.55±2.33)%.
cultivated Cordyceps cicadae; antitumor activity; Chinese hamster ovary (CHO) cells; cordycepin
Q939
A
1002-6630(2015)09-0194-04
10.7506/spkx1002-6630-201509036
2014-06-30
安徽省科技计划项目(1301C063011)
陈安徽(1979—),男,副教授,博士,研究方向为应用微生物学。E-mail:chenah201@163.com
