壶瓶碎米荠中含硒蛋白结构特性及其缓解运动性疲劳的作用
2015-12-13刘坤媛田秀丽秦治国潘思轶徐晓云
刘坤媛,田秀丽,秦治国,潘思轶,徐晓云,*
(1.华中农业大学 环境食品学教育部重点实验室,湖北 武汉 430070;2.恩施州天然植物硒研究所,湖北 恩施 445000)
壶瓶碎米荠中含硒蛋白结构特性及其缓解运动性疲劳的作用
刘坤媛1,田秀丽1,秦治国2,潘思轶1,徐晓云1,*
(1.华中农业大学 环境食品学教育部重点实验室,湖北 武汉 430070;2.恩施州天然植物硒研究所,湖北 恩施 445000)
目的:以纯化的壶瓶碎米荠含硒蛋白(selenium-containing protein from Cardamine hupingshanensis,S PCH)为研究对象,对其结构特性和缓解运动性疲劳作用进行评价。方法:采用聚丙烯酰胺凝胶电泳(polyacrylam ide gelelectrophoresis,PAGE)和十二烷基硫酸钠-PAGE(sodium dodecyl sulfate-PAGE,SDS-PAGE)、氨基酸组成分析、基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)分析,对SPCH的纯度、亚基组成、氨基酸组成及含量进行评价并初步预测SPCH的匹配蛋白。采用小鼠负重游泳实验,通过检测游泳时间、血乳酸(blood lactic acid,BLA)、肝糖原和血尿素氮(blood urea nitrogen,BUN)水平,评价SPCH对小鼠运动性疲劳的影响。结果:SPCH可能由3个分子质量分别为37、39、40 kD的亚基组成,与之相匹配的蛋白可能是DING protein、Predicted protein和Chalcone synthase。SPCH能显著延长小鼠负重游泳时间(P<0.01),同时增强清除乳酸的能力(P<0.01),增加肝糖原含量(P<0.01),还具有降低BUN水平的能力(P<0.05)。结论:SPCH对小鼠具有较好的缓解运动性疲劳作用,可考虑将其开发成为缓解运动性疲劳的营养补充剂。
壶瓶碎米荠;含硒蛋白;纯化;结构分析;缓解运动性疲劳
壶瓶碎米荠(Cardamine hupingshanensis)是一种富硒能力极强的十字花科植物。硒在植物体内的存在形态比较复杂,人们把通过密码子UGA编码蛋白质,即硒以Se—Cys形式存在的蛋白称为硒蛋白,若以其他方式(如Se—Met)存在的蛋白则称为含硒蛋白[1-2],由于植物蛋白中一般都会含有Se—Met和Se—Cys,因此本实验将统一称之为含硒蛋白。
含硒蛋白是富硒植物中大分子硒的主要存在形式[2-3],含硒蛋白的分离分析对防治缺硒而引起的疾病有重要意义。自1973年Rotruck等[4]初次证实硒参与组成了谷胱甘肽过氧化物酶的活性组分以来,含硒蛋白逐渐被关注并成为研究热点[5]。彭振坤等[6]对富硒地区的大豆进行研究,发现以蛋白形式存在的硒含量最高,约占总硒含量的63%。目前,植物含硒蛋白的分离纯化大多同时采用几种方 法,如采用分段盐析与柱层析结合分离得到纯化含硒蛋白[7]。
疲劳是一种涉及许多生理和生化因素的综合性过程,是人体精神或体力活动达到一定程度时不可避免的一种正常生理反应[8]。近年来研究发现自由基与运动性疲劳有着密切的关系[9-13]。Davies等[14]证实运动疲劳后肝脏及肌肉中的自由基数量显著增加,由此说明自由基可由运动产生。而含硒蛋白对脂质过氧化物的清除效果较亚硒酸钠和不含硒蛋白组极其明显,同时该研究显示含硒蛋白可降低γ辐射对人红细胞的损伤,并且在清除羟自由基方面效果显著[15]。雷红灵[16]也发现恩施碎米荠中纯化含硒蛋白具有较好的氧自由基清除能力及抗脂质过氧化能力,同时还可以保护动物的线粒体、肝脏及红细胞免受过氧化损伤。因此,推测壶瓶碎米荠纯化含硒蛋白有可能通过清除机体由于运动而产生的自由基而发挥缓解运动性疲劳的活性,这一猜想尚需进一步实验进行验证。
本实验以小鼠负重游泳为模型,以力竭游泳时间、血乳酸(blood lactic acid,BLA)含量、肝糖原储备量、血尿素氮(blood urea nitrogen,BUN)含量为生化测定指标,研究壶瓶碎米荠纯化含硒蛋白(seleniumcontaining protein from Cardamine hupingshanensis,SPCH)的缓解运动性疲劳作用,为拓展含硒蛋白的用途提供实验依据,促进硒资源的开发和利用。
1 材料与方法
1.1 材料、试剂与动物
壶瓶碎米荠水提物(以下简称为水提物)由盛硒生物有限公司提供,为壶瓶碎米荠全植株水提物的喷雾干燥粉末,呈深褐色。其中,总蛋白质含量为(30.53±0.66) mg/g,硒含量为(856.36±17.94) μg/g。
红景天西洋参胶囊 广州市赛健生物科技有限公司,主要原料为红景天提取物、西洋参、精氨酸、微晶纤维素,每100 g含红景天苷300 mg、总皂苷1.12 g、精氨酸12 g。
BLA测定试剂盒、肝糖原测定试剂盒、BUN试剂盒南京建成试剂有限公司;G-100葡聚糖凝胶柱、DEAE-FF阴离子交换柱 武汉鼎国昌盛生物科技有限公司;亚硒酸钠 美国Amresco公司;其他试剂均为分析纯 国药集团化学试剂有限公司。
140 只4 周龄SPF级昆明小鼠,体质量18~22 g,雌雄各半,购自武汉生物制品研究所有限公司,批号为42000400001247,许可证号为SCXK(鄂)2008-0003。
1.2 仪器与设备
BT-2245电子天平 德国Sartorius公司;Multiskan Go酶标仪 美国Thermo Fisher公司;5804R高速冷冻离心机 德国Eppendorf公司;LGJ-185冷冻干燥机北京松源华兴科技发展有限公司;HH-4恒温水浴箱国华电器有限公司;BSZ-100自动收集器、HL-2S恒流泵上海沪西分析仪器有限 公司;AFS-8220原子荧光光度计吉天仪器有限公司;DYY-Ⅱ-28A垂直夹芯式电泳槽、DYY-Ⅲ4高压双稳电泳仪 北京六一仪器厂。
1.3 方法
1.3.1 壶瓶碎米荠纯化含硒蛋白样品的制备
水提物按料液比1∶20(m/V)加入蒸馏水使其充分溶解,添加(NH4)2SO4至饱和度55%,4 ℃放置12 h,6 000 r/min离心10 min,收集沉淀,真空冷冻干燥48 h,得到粗蛋白粉末。
粗蛋白经柱层析(Sephadex G-100凝胶柱层析和DEAE-FF阴离子交换柱层析)分级纯化得壶瓶碎米荠纯化含硒蛋白(SPCH)。
Sephadex G-100柱层析条件为:26 mm×500 mm层析柱,以缓冲液洗脱,上样质量浓度200 mg/mL,上样体积2 mL,调节恒流泵转速至5 r/min,洗脱的溶液用部分收集器分步收集,每管收集2.0 mL。280 nm波长处紫外跟踪检测,洗到蛋白洗脱曲线几乎与基线一致时停止收集。将同一组分收集合并,透析72 h后浓缩冷冻干燥,得到组分1(F1)和组分2(F2),采用凯氏定氮法和氢化物发生-原子荧光光谱法测定不同级分的蛋白质含量和硒含量。
F1蛋白含量、硒含量较高,作为进一步纯化样品上纤维素DEAE-FF柱,以0~1 mol/L NaCl溶液梯度洗脱,上样质量浓度10 mg/mL,上样体积2 mL,调节恒流泵转速至3.8 r/min,每管收集1.5 mL,得到分子质量分布更加集中的含硒蛋白。以收集时间为横坐标,蛋白质吸光度为纵坐标作图,得到洗脱曲线。将同一组分收集合并,得到4 种蛋白分离组分F11、F12、F13、F14,透析72 h后浓缩冷冻干燥,得到纯化含硒蛋白粉末,采用凯氏定氮法和氢化物发生-原子荧光光谱法分别测定不同级分的蛋白质含量和硒含量。本实验中选用蛋白质含量及硒含量均比较高的纯化含硒蛋白F14为研究对象。
1.3.2 壶瓶碎米荠纯化含硒蛋白的结构定性
通过聚丙烯酰胺凝胶电泳(polyacrylamide gelelectrophoresis,PAGE)和十二烷基硫酸钠-PAGE(sodium dodecyl sulfate-PAGE,SDS-PAGE)检测分析纯化含硒蛋白F14(SPCH)的纯度及亚基组成。利用SDS不连续体系垂直板电泳检测,采用10%分离胶和5%浓缩胶。按照常规电泳操作步骤进行,取纯化含硒蛋白F14溶液0.5 mL溶于0.1 mL样品缓冲液,混匀后进样,每孔15 ☒L。电泳初始时,浓缩胶电流为15 mA,进入分离胶后电流加大到80 mA,待指示液距离下端1~2 cm时关闭电源。将胶小心取出,室温条件下染色(染色液为考马斯亮蓝R-250)1 h,然后用脱色液脱色,每半小时换1 次脱色液,至少换3 次脱色液至凝胶背景透明即可。在SDS-PAGE中,样品缓冲液中添加β-巯基乙醇和SDS,且上样液于沸水浴中煮沸3~5 min后迅速冷却,其余操作与PAGE相同。
SPCH经盐酸水解后,使用氨基酸自动分析仪测定其氨基酸组成及含量[17]。
氨基酸的水解:准确称取一定量的纯化含硒蛋白,置于离心管中,用l mL 6 mol/L HCl溶解,充完氮气马上盖上盖子,在110 ℃条件下酸解1 d,冷却至室温,干燥酸解后样品,以少量水溶解样品,再干燥1 次,如此反复3 次,最后以1mL 0.1 mol/L HCl溶解,过0.45 ☒m孔径微孔滤膜,备用。
使用基质辅助激光解吸电离飞行时间质谱仪(matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)分析纯化含硒蛋白的匹配蛋白[14]。MALDI-TOF-MS相关参数设置如下:检索类型:二级质谱;酶:胰蛋白酶;可修饰方式:氧化反应;质量值:单一同位素;蛋白质质量:不限;肽段质量公差:±100 ppm;碎片离子质量公差:±0.8 D;酶切位点数:1;查询次数:32。
1.3.3 壶瓶碎米荠缓解运动性疲劳活性研究
1.3.3.1 实验动物分组及给药剂量
小鼠按体质量随机分成7 组,每组20 只,雌雄各半,设纯化含硒蛋白SPCH(F14)低、中、 高3 个剂量组(含硒量分别为8.3、16.6、83.3 ☒g/(kg•d)),另设空白对照组(生理盐水)、阳性对照组(红景天西洋参胶囊240 mg/(kg•d),为产品说明书推荐用量经折算后的小鼠用量)、水提物组(含硒量16.6 ☒g/(kg•d))及亚硒酸钠组(含硒量6.84 ☒g/(kg•d),为小鼠谷胱甘肽过氧化物酶活性达到饱和所需补充的硒元素含量的2/3)。经口灌胃,连续灌胃30 d,小鼠灌胃量10 mL/kg。所有小鼠实验期间给予鼠维持饲料,自由摄食。
1.3.3.2 力竭游泳实验
灌胃给予受试物30 min后,将小鼠尾部负重5%体质量的铅皮,将各组小鼠放入游泳箱中,水深>30 cm,水温(25±0.5) ℃,进行力竭游泳实验。期间观察小鼠游泳情况,并不时用玻璃棒挥动小鼠使其始终保持游泳状态。计小鼠入水后开始游泳到濒死状态的时间(小鼠头不浮出水面8 s为指标)为小鼠力竭游泳时间[18]。
1.3.3.3 BLA含量测定
末次灌胃给予受试物30 min后,将小鼠尾部负重2%体质量的铅皮,于(30±0.5) ℃水中游泳60 min后停止,休息15 min后,摘眼球采血,使用抗凝管收集血液,用于BLA含量的测定,BLA具体测定方法详见试剂盒说明书。
1.3.3.4 BUN和肝糖原含量测定
末次灌胃给予受试物30 min后,小鼠在温度为(30±0.5) ℃的水中游泳90 min,休息60 min后摘眼球采血(不加抗凝剂),37 ℃放置0.5 h,然后4 ℃放置3 h,血液凝固后,3 000 r/min离心15 min,分离血清用于BUN含量测定。
取血完毕后立即将小鼠处死,摘取肝脏,以生理盐水洗净表面血水,滤纸吸去多余水分,称取75 mg肝脏组织用于肝糖原含量的测定。
肝糖原、BUN含量的具体测定方法详见试剂盒说明书。
1.4 数据统计分析
2 结果与分析
2.1 壶瓶碎米荠含硒蛋白的鉴定及结构分析
2.1.1 PAGE和SDS-PAGE结果
对纯化含硒蛋白组分进行PAGE和SDS-PAGE,结果见图1。


图1 纯化含硒蛋白的变性(a)和非变性(b)电泳图谱Fig.1 SDS-PAGE (a) and PAGE (b) profiles of purified seleniumcontaining protein
由图1可知,PAGE图中只有一个条带,表明纯化含硒蛋白具有较高的相对纯度;SDS-PAGE图中显示有3 个条带,这是由于变性电泳中β-巯基乙醇将蛋白结构中的二硫键打开,形成了多个亚基,推测该蛋白由3 种分子质量不同的亚基构成。经计算3 种亚基的分子质量约为37、39、40 kD。
2.1.2 氨基酸组成分析
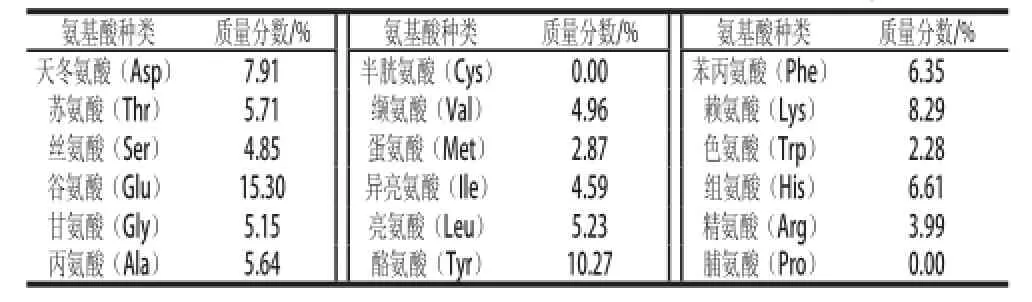
表1 纯化含硒蛋白的氨基酸组成分析Table 1 Amino acid compositions of selenium-containing protein
由表1可知,SPCH中半胱氨酸、蛋氨酸含量极低,几乎为0。推测可能是由于硒以Se—Met和Se—Cys的形式存在于蛋白质中形成植物含硒蛋白因而未被检测出来,与雷红灵[16]关于含硒蛋白的研究结论一致。
2.1.3 MALDI-TOF-MS图谱分析

图2 Mascot检索结果Fig.2 Mascot search results
纯化含硒蛋白经PAGE检测为单一蛋白条带,说明样品蛋白已达电泳纯,但与候选蛋白肽段覆盖率并不是很高(图2),可能是由于硒与硫的代谢路径具有相似性,硒在进入蛋白前要先经过有机化,即以Se—Met和Se—Cys的形式[19-20]代替Met和Cys,参与含硒蛋白的合成。
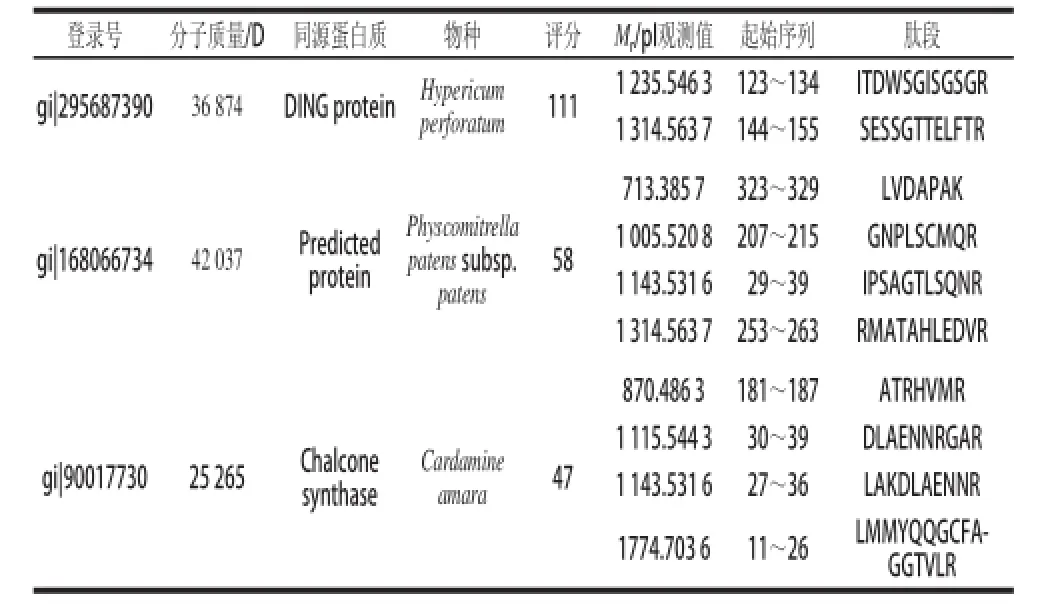
表2 MALDI-TOF-MS分析结果Table 2 Proteins analyzed by MALDI-TOF-MS
附录检索数据(表2)进一步验证了上述推断:纯化含硒蛋白与候选蛋白(gi|295687390)肽段相同序列中均不含Met和Cys残基,与候选蛋白(gi|168066734、gi|90017730)肽段相同序列中共有5 个Met残基,其中2 个均被氧化,间接表明蛋白中原有Met和Cys中的硫被硒所代替,形成对应的含硒氨基酸,从而进入到蛋白质中形成含硒蛋白。
经MALDI-TOF-MS鉴定分析,与纯化含硒蛋白相匹配的蛋白可能是DING protein、Predicted protein和Chalcone synthase。
2.2 壶瓶碎米荠提取物的缓解运动性疲劳活性研究
2.2.1 力竭游泳实验结果
实验过程中,小鼠体质量持续增加,实验结束时,小鼠体质量较实验初始时显著增加;雌鼠的体质量增加量小于雄鼠,差异显著;实验组间,空白对照组、各实验组雌鼠体质量增加量无显著差异;空白对照组、各实验组雄鼠体质量增加量无显著差异。
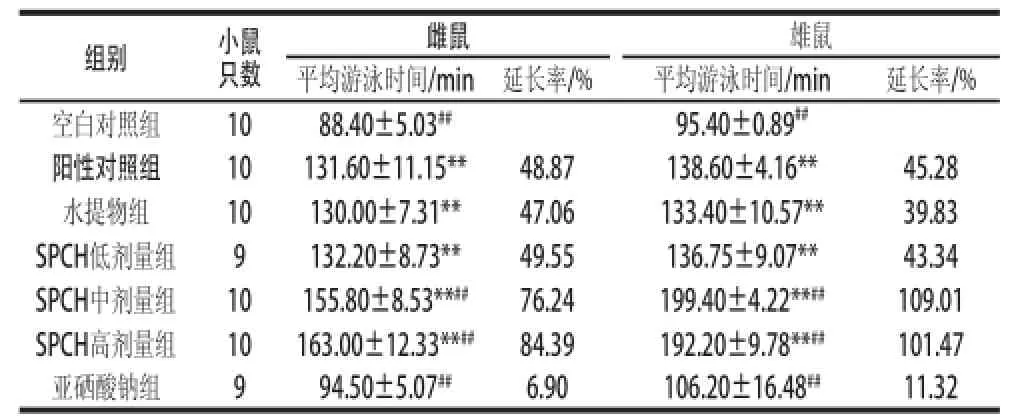
表3 纯化含硒蛋白对小鼠负重游泳时间的影响Table 3 Effect of selenium-containing protein on loaded-swimming time in mice ice
疲劳的最主要表现是运动耐力的下降,运动耐力是反映机体疲劳最直接、最客观的指标[21]。由表3可知,SPCH可延长小鼠负重游泳时间,除亚硒酸钠组外,各实验组与空白对照组比较,均表现出明显差异(P<0.01);与阳性对照组相比,SPCH中、高剂量组差异均极显著(P<0.01);同时SPCH在延长小鼠运动耐力方面较水提物组具有明显优势,且SPCH中剂量组即具有较好的效果。与其他相关文献[22-23]的数据相比,各组的负重游泳时间均低于文献中对应值,这可能与有些文献中小鼠尾部负重质量不同,或游泳环境不同有关。
2.2.2 BLA含量测定结果
若机体进行连续剧烈运动时间超过10 s,则肌肉将不能获得足够氧气,这时大部分能量需要通过糖原的无氧酵解来产生,从而生成许多乳酸,乳酸积累太多会打破内环境的稳定,机体不能进行正常生理代谢,最终导致疲劳[10]。机体乳酸的堆积由乳酸的生成速率和清除速率共同决定,因此减少乳酸的生成或加速乳酸的清除都可起到缓解运动性疲劳的效果,乳酸含量可作为衡量机体有氧代谢能力、减缓疲劳产生和加速疲劳消除的指标[24]。
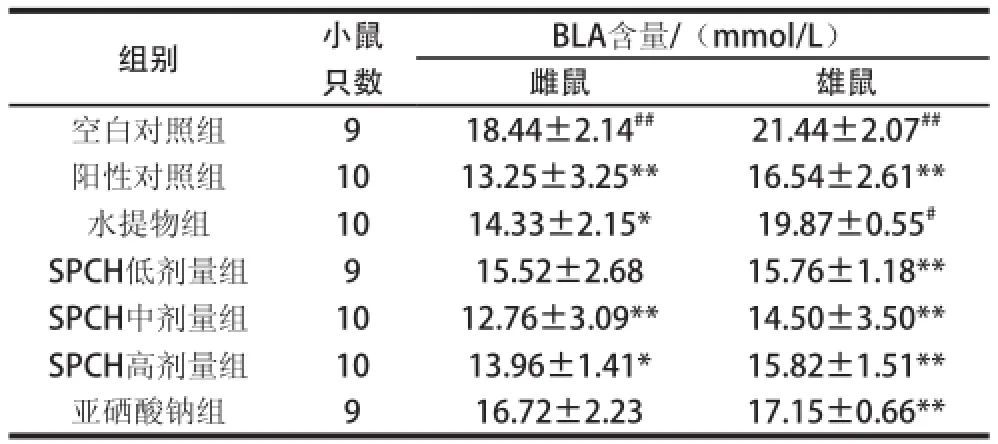
表4 纯化含硒蛋白对小鼠运动后BLA含量的影响Table 4 Effect of selenium-containing protein on blood lactic acid in mice after exercise
由表4可知,与空白对照组相比,雌鼠的SPCH中、高剂量组的BLA含量下降(P<0.01或P<0.05);雄鼠的SPCH低、中、高剂量组BLA含量极显著降低(P<0.01);与阳性对照组比较,雌鼠、雄鼠的SPCH各剂量组在加速乳酸消除方面均无显著差异;雄鼠的水提物组与空白对照组相比,BLA含量差异不显著,SPCH较水提物显示出更强的减少代谢产物(乳酸)堆积的能力,延缓疲劳的产生。
2.2.3 肝糖原含量测定结果
机体之所以产生疲劳的原因之一是由于体内消耗了过多的能量,糖原可以为机体提供大量能量,因此可以把机体内糖原含量的多少作为衡量疲劳产生快慢或疲劳程度的指标[7]。
由表5可知,与空白对照组相比,SPCH中、高剂量组的肝糖原含量升高,显著极差异(P<0.01);而水提物和亚硒酸钠对小鼠肝糖原含量无显著影响。以上结果表明SPCH水提物能够更好地为机体维持运动时的血糖水平,从而更好地达到缓解运动性疲劳的目的。

表5 纯化含硒蛋白对小鼠运动后肝糖原含量的影响Table 5 Effect of selenium-containing protein on hepatic glycogen in mice after exercise
2.2.4 BUN含量测定结果

表6 纯化含硒蛋白对小鼠运动后BUN含量的影响Table 6 Effect of selenium-containing protein on BUN in mice after exercise
由表6可知,在降低BUN含量方面,水提物组效果更好,与空白对照组、阳性对照组比较,均具有显著或极显著差异(P<0.05或P<0.01)。水提物能更有效地减轻运动时机体利用蛋白质供能的状况,这可能是由于水提物中其他含硒物质或者其他成分与含硒蛋白产生协同效应的结果。
3 讨 论
含硒蛋白的分离纯化是一个非常复杂而繁琐的过程,通过硫酸铵沉淀、柱层析(葡聚糖凝胶柱层析、阴离子交换柱层析)分级纯化得到含硒蛋白,经SDS-PAGE检测,该蛋白组分呈现单一条带,样品达到电泳纯,为后续研究碎米荠含硒蛋白的结构和生物活性奠定了基础,经计算纯化含硒蛋白3 个亚基的分子质量大约为37、39、40 kD。
对纯化含硒蛋白进行氨基酸组成分析,半胱氨酸、蛋氨酸含量极低,几乎为0,推测可能是由于硒以Se—Met和Se—Cys的形式进入蛋白质中,形成含硒蛋白,从而未被检测出。含硒蛋白经MALDI-TOF-MS鉴定分析,与纯化含硒蛋白相匹配的蛋白可能是DING protein、Predicted protein和Chalcone synthase。
硒的成人推荐摄入量每天最少50 ☒g,人体体质量以60 kg计,即每天硒需要量为0.83 ☒g/kg,按照小鼠与人的换算系数10,则小鼠硒的最低需要量为8.3 ☒g/(kg•d),将该剂量作为低剂量组,分别提高2、10 倍作为中、高剂量组;阳性对照组使用剂量也是根据该药的成人推荐使用量再乘以小鼠与人的换算系数计算而得。
无机硒生物利用率低,易在肝脏、心脏、脾脏、肾脏等组织中积累,过量会引起中毒[25],日本在1993年已禁止向食品中添加无机硒。田俊梅[26]以缺硒Sprague-Dawley(SD)大鼠为动物模型,研究硒强化剂的生物利用效果,采用的分组剂量为2、4、8、16 μg/(kg•d),结果显示亚硒酸钠组即使在硒含量仅为2 μg/(kg•d)时,较硒蛋白在肝肾组织存在更高程度的硒积累,易引起过量中毒。姚昭等[27]研究硒的抗氧化作用时,以SD大鼠为动物模型,采用的硒元素用量为人体血液中谷胱甘肽过氧化物酶活性达到饱和所需补充的硒元素含量折算后的大鼠用量,在该浓度下无机硒能影响大鼠抗氧化能力。2001年,Combs[28]研究发现硒的摄入量只需达到谷胱甘肽过氧化物酶活性饱和值的2/3左右即可使谷胱甘肽过氧化物酶活性充分表达。本实验以昆明小鼠负重力竭游泳实验为模型,着重研究补充SPCH对缓解运动性疲劳的作用,参考的亚硒酸钠组在实验设计时兼顾亚硒酸钠安全性与功能活性,硒含量取小鼠谷胱甘肽过氧化物酶活性达到饱和所需补充硒元素含量的2/3,即6.84 μg/(kg·d)。
由实验结果可知,SPCH各剂量组中,低剂量组含硒蛋白的活性作用并不明显,而中、高剂量组效果显著,通过对纯化蛋白补硒剂量的研究,可知中剂量(16.6 ☒g/(kg•d))SPCH即可达到较好的缓解运动性疲劳效果;比较各项测定指标,发现SPCH活性作用明显优于亚硒酸钠组,在实验条件下有机硒(含硒蛋白组)与无机硒(亚硒酸钠组)相比,具有更好地缓解运动性疲劳作用,但是由于硒元素含量的不同,实验结果并不具备直接的可比性;SPCH能通过显著延长小鼠负重游泳时间、提高运动后肝糖原含量、降低血尿素氮水平、减缓乳酸产生或增强乳酸清除能力,从而发挥出较壶瓶碎米荠水提物更有效的缓解运动性疲劳作用。实验结果表明将水提物中含硒蛋白进行分离纯化有助于提升其活性作用。
[1] STADTMAN T C. Selenocysteine[J]. Annual Review of Biochemistry,1996, 65(1): 83-100.
[2] 黄峙, 向军俭, 郭宝江. 硒蛋白的分子生物学研究进展[J]. 生物化学与生物物理进展, 2001, 28(5): 642-645.
[3] 吴军, 刘秀芳, 徐汉生. 硒在植物生命活动中的作用[J]. 植物生理学通讯, 1999, 35(5): 417-423.
[4] ROTRUCK J T, POPE A L, GANTHER H E, et al. Selenium: biochemical role as a component of glutathione peroxidase[J]. Science,1973, 179: 588-590.
[5] 左银虎. 环境与植物中硒形态研究进展[J]. 植物学通报, 1999,16(4): 378-380.
[6] 彭振坤, 周大寨. 大豆蛋白中硒分布的研究[J]. 湖北民族学院学报:自然科学版, 2001, 19(1): 10-12.
[7] 吴永尧, 罗泽民, 彭振坤. 不同供硒水平对水稻生长的影响及水稻对硒的富集作用[J]. 湖南农业大学学报: 自然科学版, 1998, 24(3): 176-179.
[8] 金宗濂. 保健食品的功能评价与开发[M]. 北京: 中国轻工业出版社,2001: 39-75.
[9] DILLARD C J, LITOV R E, SAVIN W M, et al. Effects of exercise,vitamin E, and ozone on pulmonary function and lipid peroxidation[J]. Journal of Applied Physiology, 1978, 45(6): 927-932.
[10] 方允中, 李文杰. 自由基与酶[M]. 北京: 科学出版社, 1989: 147-160.
[11] 方允中. 自由基生命科学进展[M]. 北京: 原子能出版社, 1993: 77-79.
[12] AOI W, NAITO Y, TAKANAMI Y, et al. Oxidative stress and delayed-onset muscle damage after exercise[J]. Free Radical Biology and Medicine, 2004, 37(4): 480-487.
[13] de LISIO M, KACZOR J J, PHAN N, et al. Exercise training enhances the skeletal muscle response to radiation-induced oxidative stress[J]. Muscle & Nerve, 2011, 43(1): 58-64.
[14] DAVIES K J A, QUINTANILHA A T, BROOKS G A, et al. Free radicals and tissue damage produced by exercise[J]. Biochemical and Biophysical Research Communications, 1982, 107(4): 1198-1205.
[15] 陈春英, 张劲松. 烟叶硒蛋白对人红细胞的辐射溶血及自由基的作用[J]. 中国药理学通报, 1996, 21(4): 357-359.
[16] 雷红灵. 恩施碎米荠富硒生理生化及其含硒蛋白的研究[D]. 长沙:湖南农业大学, 2010: 83-85; 100-111.
[17] GB/T 5009.124—2003 食品中氨基酸的测定[S].
[18] THOMAS D P, MARSHALL K I. Effects of repeated exhaustive exercise on myocardial subcellular membrane structures[J]. International Journal of Sports Medicine, 1988, 9(4): 257-260.
[19] NG B H, ANDERSON J W. Synthesis of selenocysteine by cysteine synthases from selenium accumulator and non-accumulator plants[J]. Phytochemistry, 1978, 17(12): 2069-2074.
[20] BROWN T A, SHRIFT A. Exclusion of selenium from proteins of selenium-tolerant Astragalus species[J]. Plant Physiology, 1981, 67(5): 1051-1053.
[21] 张建国, 陈良金. 扶正化瘀补肾法对老年小鼠耐力运动中抗缺氧和抗疲劳作用[J]. 中国临床康复, 2002, 6(3): 351-352.
[22] 沈晨, 蒋立勤, 顾小燕, 等. 红景天复合饮料的抗疲劳作用研究[J].现代食品科技, 2011, 27(5): 520-523.
[23] 姜迎. 富硒麦芽对尼古丁缓解小鼠体力疲劳作用及致氧化性损伤作用影响的研究[D]. 济南: 山东大学, 2013: 18-19.
[24] 原海晓, 邓虹珠, 姚晖, 等. 神来片抗疲劳作用的研究[J]. 现代中西医结合杂志, 2010, 19(34): 4404-4405.
[25] 胡滨, 陈一资. 亚硒酸钠的急性, 蓄积性, 亚急性毒性研究[J]. 食品科学, 2011, 32(5): 258-262.
[26] 田俊梅. 低硒大鼠对上那种硒强化剂生物利用效果的比较[D]. 郑州: 郑州大学, 2010: 15-16.
[27] 姚昭, 李红艳, 张云龙, 等. 有机硒, 无机硒, VE单独使用及有机硒与VE联用对大鼠体内抗氧化能力的影响[J]. 食品科学, 2013, 34(15): 272-276. doi: 10.7506/spkx1002-6630-201315056.
[28] COMBS G F, Jr. Impact of selenium and cancer-prevention findings on the nutrition-health paradigm[J]. Nutrition and Cancer, 2001, 40(1): 6-11.
Structure Characteristics and Anti-motor Fatigue Activity of Selenium-Containing Protein from Cardamine hupin gshanensis
LIU Kunyuan1, TIAN Xiuli1, QIN Zhiguo2, PAN Siyi1, XU Xiaoyun1,*
(1. Key Laboratory of Environment Correlative Dietology, Ministry of Education, Huazhong Agricultural University,Wuhan 430070, China; 2. Enshi Research Institution of Natural Plant Selenium, Enshi 445000, China)
This study evaluated the structure characteristics and anti-motor fatigue activity of selenium-containing protein purified from Cardamine hupingshanensis (SPCH). The purity, subunit composition, amino acid composition and matching protein of SPCH were analyzed by using PAGE, SDS-PAGE, amino acid analyzer and matrix-assisted laser desorption/ ionization time of flight mass spectrometry (MALDI-TOF-MS). The anti-motor fatigue activity of SPCH was investigated by measuring swimming time, blood lactic acid, hepatic glycogen and serum urea nitrogen in mice in weight-loaded swimming test. Results showed that SPCH had three subunits with molecular weights of 37, 39 and 40 kD respectively. The matching protein might be DING protein, predicted protein or chalcone synthase. The results also showed that SPCH significantly prolonged the swimming time of mice (P < 0.01), decreased blood lactic acid content (P < 0.01), increased hepatic glycogen content (P < 0.01), and reduced serum urea nitrogen content (P < 0.05). In conclusion, SPCH has a good anti-motor fatigue activity as a dietary supplement.
Cardamine hupingshanensis; selenium-containing protein; purification; structure analysis; anti-motor fatigue activity
TS201.4
A
1002-6630(2015)09-0160-06
10.7506/spkx1002-6630-201509029
2014-06-24
“十二五”国家科技支撑计划项目(2012BAD31B00;2012BAD31B08)
刘坤媛(1991—),女,硕士研究生,研究方向为天然产物开发与利用。E-mail:15927361532@163.com
*通信作者:徐晓云(1970—),女,教授,博士,研究方向为天然产物化学及农产品精深加工技术。E-mail:xuxiaoyun@mail.hzau.edu.cn
