腌虾蛄中优势乳酸菌的分离筛选与鉴定
2015-12-13刘正行岳喜庆
刘正行,岳喜庆
(沈阳农业大学食品学院,辽宁 沈阳 110866)
腌虾蛄中优势乳酸菌的分离筛选与鉴定
刘正行,岳喜庆*
(沈阳农业大学食品学院,辽宁 沈阳 110866)
从腌虾蛄中分离49 株疑似乳酸菌株,通过菌株的形态学观察和生理生化实验,初步筛选出L14、L22、L28这3 株乳酸菌菌株。再通过16S rDNA序列测定和分析进一步验证,结果表明,菌株L14与屎肠球菌(Enterococcus faecium)的相似性达到99%,菌株L22与短乳杆菌(Lactobacillus brevis)的相似性达到98%,菌株L28与棒状乳杆菌扭曲亚种(Lactobacillus coryniformis subsp. torquens)的相似性达到99%。对3 株菌株的生长情况、产酸、耐温和耐盐等性能进行测定,结果表明,3 株菌株在24 h内生长情况OD600nm值均超过1.0,测定24 h内菌株产酸pH值均在4.0左右,菌株L22最低可达到pH 3.97,3 株菌株在25~35 ℃之间生长性能良好,均能在食盐质量浓度为60 g/L的情况下正常生长。
腌虾蛄;筛选;乳酸菌;16S rDNA
虾蛄(mantis shrimp)俗称虾爬子、螳螂虾、虎虾等,隶属节肢动物门,口足目、虾蛄科品种,是常见的海产经济动物[1]。腌虾蛄是以虾蛄为主料,以食盐和其他调味品为辅料腌制而成的一种食品。其口感咸鲜适宜,肉质细嫩爽滑,一直以来深受沿海地带人们的喜爱,是当地人们餐桌上一道必不可少的美食。在腌虾蛄生产制作过程中会存在着不同的微生物区系,其中有些优良微生物可以促进产品品质的形成,例如乳酸菌、葡萄球菌、酵母菌等。在短期发酵水产品中,乳酸菌往往更容易成为优势菌株,其对虾蛄的作用要远大于葡萄球菌和酵母菌[2]。因此,本实验对乳酸菌进行研究。乳酸菌具有改善产品的品质和风味、提高产品质量和稳定性的作用[3]。乳酸菌通过发酵产生有机酸,降低体系pH值,从而抑制腐败菌和致病菌的生长[4]。乳酸菌还可以促使亚硝酸盐向一氧化氮肌红蛋白转化,减少了腌虾蛄制品中亚硝酸盐的残留量。由此可见,乳酸菌是虾蛄腌制过程中的关键性因素。
目前,对乳酸菌的研究着重于发酵乳制品、泡菜、鱼及肉制品加工等方面,罗靓芷等[5]从臭鳜鱼中分离出4 株乳酸菌株,陈学云等[4]从盐干带鱼中分离13 株乳酸菌株,但关于腌虾蛄中乳酸菌的研究还鲜有报道。从腌虾蛄中分离乳酸菌,之后再应用于其他的腌制水产品中,最终获得质量稳定,口感极佳的腌制水产品。这对腌制水产品的工业化生产有着不同的意义。本实验对腌制虾蛄中的乳酸菌进行筛选、分离和纯化,并对其进行生理生化鉴定及16S rDNA序列比对和分析,以确定其属种。以期获得适合用于腌制虾蛄的乳酸菌菌株,为开发研制出新型发酵剂提供参考依据。
1 材料与方法
1.1 材料、培养基与试剂
腌虾蛄,购于丹东林江名城菜市场。
主要培养基:MRS培养基[6-8];生理生化鉴定培养基[9-13]:耐盐性培养基、耐亚硝酸盐培养基、耐酸性培养基、葡萄糖产酸产气培养基、石蕊牛奶培养基、产氨培养基、硝酸盐还原培养基、M.R.培养基、V.P.培养基、明胶液化培养基、产H2S培养基、淀粉水解培养基。
糖醇发酵管[11]、细菌基因组DNA提取试剂盒(离心柱型) 沈阳鼎国生物技术有限公司。
1.2 仪器与设备
SD-JKⅠ型无菌操作台 苏净集团安泰公司制造;手提式不锈钢蒸汽压力灭菌锅 上海申安医疗器械;CT14RD型冷冻离心机、电热恒温培养箱 上海精宏实验设备有限公司;E-201-C型pH计 上海精密仪器有限公司;DYY-8C型稳流稳压电泳仪 普阳科学仪器研究所;聚合酶链式反应(polymerase chain reaction,PCR)扩增仪 美国Bio-Rad公司。
1.3 方法
1.3.1 菌株的筛选、分离及纯化
在无菌操作台中,准确称取腌虾蛄10 g,用医用手术剪将其剪碎,倒入到盛有90 mL的无菌生理盐水的锥形瓶中,将其剧烈振动摇晃30 min左右,在室温下静置5 min。此样品液的稀释度为10—1,取其稀释液1 mL,连续做6 个梯度稀释。采用倾注法,每个稀释度分别吸取0.5 mL稀释液移置平板中,再加入含有质量分数为3% CaCO3的MRS固体培养基,轻轻摇晃使其混合均匀,冷却后倒置,于37 ℃条件下培养48 h,每个梯度做3 个平行[14-15]。
挑取有溶钙圈,颜色为乳白色或淡黄色,直径大约为1~2 mm大小的单菌落在MRS固体培养基中反复进行划线(3~4 次左右)培养。将分离纯化培养后的菌株,接种到MRS斜面培养基中,并在37 ℃的条件下培养24 h后放置4 ℃的冰箱保藏[7]。
1.3.2 菌株的菌落形态和个体形态学观察
将菌株进行镜检和过氧化氢酶实验[5]。
1.3.3 生理生化鉴定及菌株的筛选
对疑似乳酸菌菌株分别进行产黏性实验、耐亚硝酸盐实验、硝酸盐还原性实验、葡萄糖产气实验、运动性实验、耐高低温实验、产H2S实验、明胶液化实验、淀粉水解实验、V.P.实验、M.R.实验、产氨实验、耐酸性实验、耐盐性实验、石蕊牛奶实验[16]。
1.3.4 基因测序及序列分析
1.3.4.1 DNA的提取
为了进一步验证生理生化鉴定实验结果,对疑似乳酸菌株进行16S rDNA测序并分析其序列。按照细菌基因组DNA提取试剂盒中附带说明书的方法提取菌体中的DNA,之后用1%的琼脂糖凝胶电泳检测提取出来的DNA产物。
1.3.4.2 16S rDNA基因序列的聚合酶链式反应扩增
对提取出来的DNA基因序列进行PCR扩增,扩增所用引物为细菌通用引物:正向引物为27F:5’-AGAGTTTGATCCTGGCTCAG-3’,反向引物为1492R:5’-CTACGGCTACCTTGTTACGA-3’。在1 μL的DNA模板中分别加入正向引物27F和反向引物1492R各1.5 μL,1.0 μL Taq聚合酶(5 U/μL),5.0 μL 10×Buffer(含2.5 mmol/L Mg2+),超纯水39.0 μL,扩增体系的总体积为50 μL[7]。PCR扩增反应过程条件设置为:94 ℃预变性5 min,94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸90 s,72 ℃终延伸7 min,以上总反应过程需经过45 次循环[17]。PCR的阴性对照基因组DNA用超纯无菌水来代替。
将PCR扩增终产物用1%的琼脂糖凝胶电泳进行检测。送北京擎科新业生物技术有限公司测定其16S rDNA序列。得到DNA序列后,登陆(www.ncbi.nlm.gov/ blast/)网站进行序列的比对和序列的同源性分析[19]。进入GenBank数据库查找与测定菌株亲缘关系最近的标准菌株的16S rDNA序列。应用MEGA5.0软件构建系统发育树,获得测定菌株的系统进化位置[18]。
1.3.5 菌株生理性能的测定
1.3.5.1 生长曲线的绘制
将通过生理生化实验鉴定得到的菌株,分别接种到MRS液体培养基中进行培养。37 ℃培养24 h。每隔4 h用紫外分光光度计在600 nm波长处测定一次光密度(OD)值[19],并绘制曲线。
1.3.5.2 产酸曲线的绘制
将通过生理生化实验鉴定得到的菌株,分别接种到MRS液体培养基中进行培养。37 ℃培养24 h。每隔4 h用pH计测定其pH值[20],并绘制曲线。
1.3.5.3 在不同食盐质量浓度条件下生长情况的测定
将通过生理生化实验鉴定得到的菌株,分别接种到含有质量浓度为40、60、80、100、120 g/L的食盐的MRS液体培养基中进行培养。37 ℃培养24 h。用紫外分光光度在波长为600 nm波长处测定其OD值[21],并绘制曲线。
1.3.5.4 耐温性能的测定
将通过生理生化实验鉴定得到的菌株,分别接种到MRS液体培养基中,在15、25、35、45 ℃的条件下分别培养24 h。用紫外分光光度计在600 nm波长处测定其OD值[22],并绘制图表。
2 结果与分析
2.1 菌株的形态学观察结果
本实验从腌虾蛄中分离出49 株疑似乳酸菌菌株,其中有8 株菌株有溶钙圈,菌落直径大小在1~2 mm,革兰氏染色为阳性,过氧化氢酶为阴性。结果见表1。
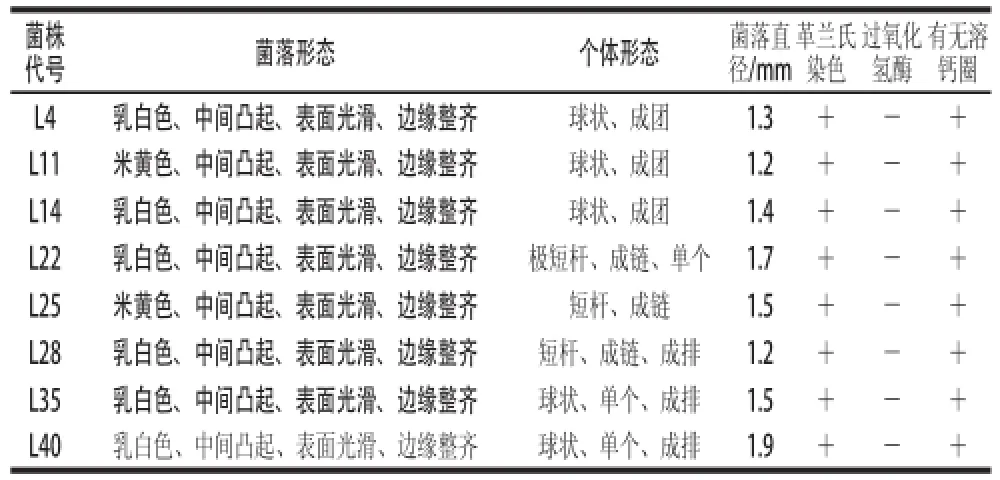
表1 菌株的形态学观察结果Table 1 Morphological identification of 8 strains suspected of being lactic acid bacteria
由表1可知,通过形态学观察筛出的8 株疑似乳酸菌菌株,颜色均为米黄色或乳白色,形状有球状或杆状,排列方式有成团、单个、成链等。
2.2 生理生化实验结果及优良菌株的筛选
将通过菌株形态学观察筛选出的8 株疑似乳酸菌菌株进行生理生化鉴定实验,结果如表2所示。筛选出L14、L22、L28这3 株菌株均不产黏性,在含有1 500 mg/L NaNO2培养基中都能正常生长,硝酸盐还原实验、石蕊牛奶实验、M.R.实验都为阳性,产氨实验、产H2S实验、明胶液化实验、淀粉水解实验、V.P.实验都为阴性,葡萄糖不产气,无运动性,3 株菌株都能耐受60 g/L食盐并在15、45 ℃和pH 4.5的条件下生长。因此,L14、L22、L28符合食品发酵菌株的要求。再对菌株L4、L22、L28进行糖醇发酵实验,实验结果见表3。参考《常见细菌手册》[12]和《伯杰氏细菌手册》[13]第八版确定其种属,菌株L14为屎肠球菌,菌株L22为短乳杆菌,菌株L28为棒状乳杆菌扭曲亚种。

表2 生理生化实验鉴定结果Table 2 Results of physiological and biochemical identification
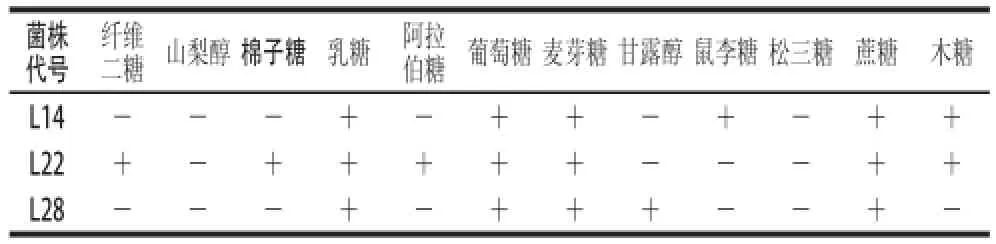
表3 糖醇发酵鉴定结果Table 3 Results of glycolysis identification
2.3 菌株基因组DNA的提取
采用1%的琼脂糖凝胶电泳对基因组试剂盒提取出的DNA片段进行检测并在凝胶成像仪下成像,检测结果见图1。可以看到条带清晰,主带明显,所有条带都在同一水平线上。

图1 菌株基因组DNA检测电泳图Fig.1 Electrophoretograms of DNA from three lactic acid bacterial isolates
2.4 16S rDNA基因序列PCR扩增产物及序列对比
PCR扩增后的产物再用1%的琼脂糖凝胶电泳检测,同时进行PCR阴性对照实验如图2所示。在约1 500 bp处有特异性条带,并且条带清晰、明显、单一。因此,16S rDNA基因序列扩增产物满足测序的要求[23]。
将测定菌株的16S rDNA序列输入到NCBI(http:// www.ncbi.nlm.nih.gov/BLAST)数据库中,与数据库中已知菌株的基因序列进行对比。查找与测定菌株亲缘关系最近的已知分类地位的标准菌株。比对结果是,菌株L14的16S rDNA序列与屎肠球菌(Enterococcus facium)16S rDNA/RNA序列的相似性最高为99%,菌株L22的16S rDNA序列与短乳杆菌(Lactobacillus brevis)的16S rDNA/RNA序列的相似性最高为98%,菌株L28的16S rDNA序列与棒状乳杆菌扭曲亚种(Lactobacilluscoryniformis subsp. torquens)的16S rDNA/RNA序列的相似性最高为99%。结果如图2。
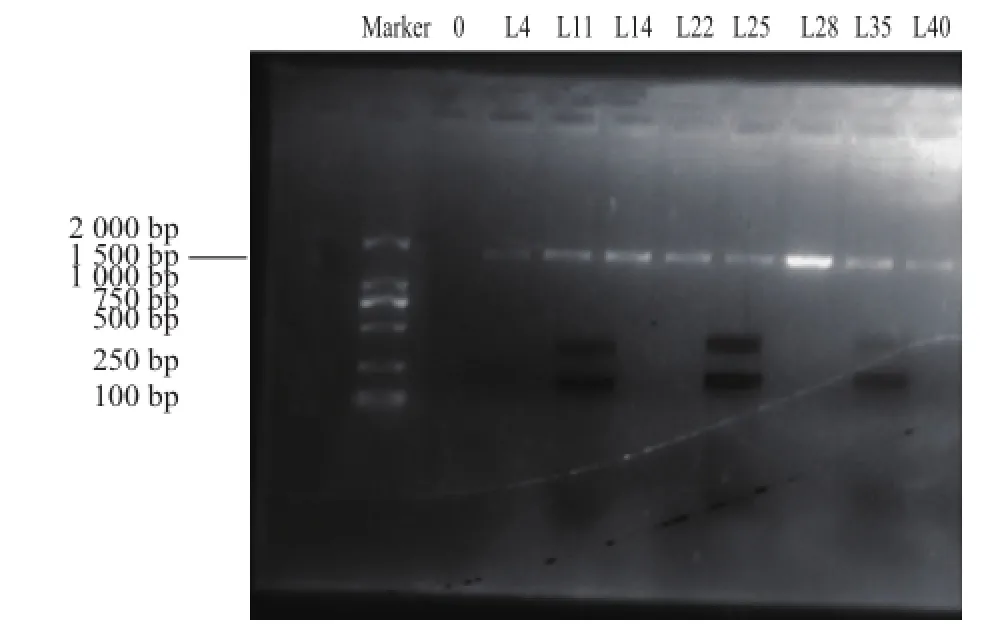
图2 菌株PCR扩增产物检测电泳图Fig.2 Electrophoregrams of the PCR amplification products from three lactic acid bacterial isolates
2.5 系统发育树的构建
登陆GenBank数据库,查找与测定菌株亲缘关系最近的标准菌株的16S rDNA/RNA序列,使用MEGA 5.0软件,采用Neighbor-Joining法构建系统发育树,获得测定菌株的系统进化地位[24-25]。由图3可知,L14与屎肠球菌(Enterococcus faecium)的系统位置最接近,L22与短乳杆菌(Lactobacillus brevis)的系统位置最接近,L28与棒状乳杆菌扭曲亚种(Lactobacillus coryniformis subsp. torquens)的系统位置最接近。因此,根据16S rDNA同源性对比和构建系统发育树得出结果,菌株L14、L22、L28分别鉴定为屎肠球菌(Enterococcus faecium),短乳杆菌(Lactobacillus brevis)和棒状乳杆菌扭曲亚种(Lactobacillus coryniformis subsp. torquens)。这与生理生化实验结果相一致。

图3 菌株L14、L22、L28的系统发育树Fig.3 Phylogenetic tree of three lactic acid bacterial isolates
2.6 菌株生理性能
2.6.1 菌株的生长曲线

图4 乳酸菌生长曲线Fig.4 Growth curves of three lactic acid bacterial isolates
由图4可知,L14在0~12 h的时间段,其生长速率明显高于L22和L28,但在12 h之后,L14到达稳定生长期,菌体密度不会再有太大的变化。L28和L22在0~16 h的时间段中进入对数生长期,在16 h之后都到达稳定生长期。24 h之后,L22和L28的菌体密度明显高于L14的菌体密度。菌体的生长速率快,繁殖能力强是作为发酵水产品发酵剂的一个重要的衡量标准[22]。
2.6.2 菌株产酸曲线
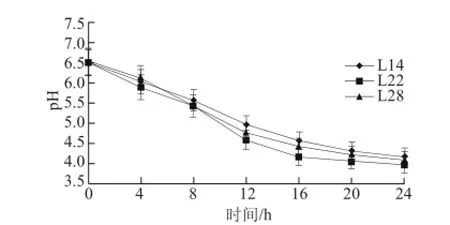
图5 乳酸菌的产酸能力Fig.5 Acid-producing capacities of three lactic acid bacterial isolates
由图5可知,菌株产酸曲线的变化存在一定的相似性,L14、L22、L28在0~16 h时间段中,pH值下降速率最快,而在16 h之后则趋于平缓。这与菌株的生长曲线大体一致。在培养24 h后,3 株菌株的pH值大约都在4.0左右。其中,L22的pH值略低于L14和L28。在虾蛄腌制过程中,产乳酸速率快,pH值低,被杂菌污染的机率就会有所降低,同时也会有利于风味物质的形成[15]。
2.6.3 菌株在不同温度条件下的生长情况

图6 乳酸菌在不同温度下的生长情况Fig.6 Growth status of three lactic acid bacterial isolates at different temperatures
由图6可知,3 株菌株在不同的温度条件下生长情况有所差异,但在25 ℃和35 ℃的条件下生长情况均良好。在35 ℃时生长最旺盛,其中L22和L28的OD600nm值稍高于L14的OD600nm值。而在15 ℃和45 ℃时3 株菌株的生长明显都受到抑制。
2.6.4 菌株在不同食盐质量浓度条件下的生长情况
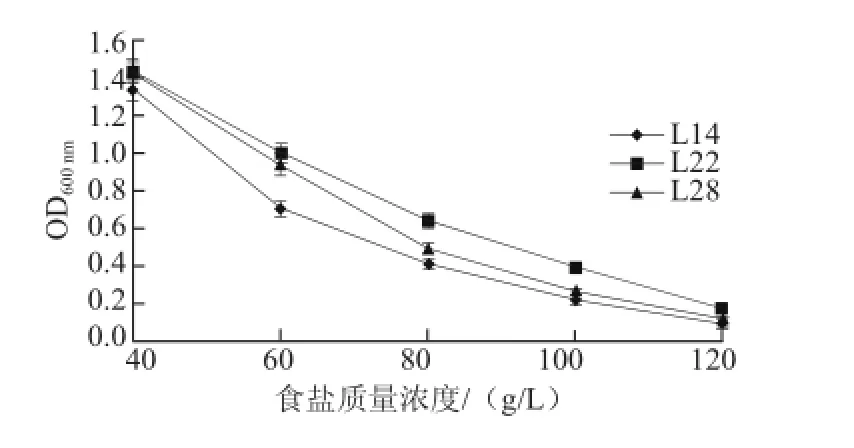
图7 乳酸菌在不同食盐质量浓度下的生长情况Fig.7 Growth status of three lactic acid bacteria isolates at different salt concentrations
由图7可知,随着培养基中食盐质量浓度逐渐增加,3 株菌株的生长都不同程度的受到抑制。当食盐质量浓度在60 g/L时,3 株菌株的生长状况均良好。当食盐质量浓度达到120 g/L时,3 株菌株的生长都受到严重的抑制,OD600nm值大约都在0.1左右。但L22的耐盐性明显好于L28和L14。在腌制虾蛄过程中,虾蛄体内的食盐质量浓度很高,因此需要选用耐盐性更好的菌株作为发酵剂[16]。
3 结 论
本实验从腌虾蛄中分离49 株疑似乳酸菌株,经过形态学观察,生理生化实验及16S rDNA序列测定及分析,筛选出3 株乳酸菌株,分别是L14屎肠球菌(Enterococcus faecium)、L22短乳杆菌(Lactobacillus brevis)和L28棒状乳杆菌扭曲亚种(Lactobacillus coryniformis subsp. torquens)。再对3 株乳酸菌株分别进行产酸、耐温等相关生理性能的测定。3 株菌株生长性能的OD600nm值都在1.0以上,产酸pH值均下降到4.0左右,温度在25~35 ℃的范围内正常生长,低于25 ℃和高于35 ℃时,菌株的生长均受到抑制,食盐质量浓度在60 g/L时,菌株生长性能良好。3 株菌株均适合作发酵水产品的发酵剂,这为发酵水产品的进一步研究提供参考依据。
[1] 杨春, 苏秀榕, 李太武. 口虾蛄的繁殖和人工育苗[J]. 齐鲁渔业,2004, 21(3): 9-10.
[2] 陈雪琴, 周长艳, 黄泽元. 直投式复合菌剂发酵鱼加工工艺研究[J].武汉工业大学学报, 2012, 31(1): 13-17.
[3] 刘安军, 何立蓉, 郑捷, 等. 发酵带鱼乳酸菌种的筛选及其工艺优化[J].现代食品科技, 2010, 26(9): 948-951.
[4] 陈学云, 候鲁娜, 丁玉庭, 等. 盐干带鱼中乳酸菌的分离鉴定及其生物学特性研究[J]. 食品工业科技, 2010, 31(11): 165-167.
[5] 罗靓芷, 武俊瑞, 刘法佳, 等. 臭鳜鱼中优良乳酸菌的分离筛选与鉴定[J]. 食品与发酵工业, 2013, 39(10): 71-75.
[6] 武俊瑞, 李欣, 张苗, 等. 自然发酵酸菜汁中乳杆菌的分离鉴定[J].食品科学, 2012, 33(15): 191-194.
[7] 李欣, 武俊瑞, 田甜, 等. 大庆自然发酵酸菜中乳酸菌的分离鉴定及耐酸性菌株初步筛选[J]. 食品科学, 2014, 35(1): 150-154. doi: 10.7506/spkx 1002-6630-291401029.
[8] 帅瑾, 杨勇, 姚伟伟, 等. 四川发酵香肠中乳酸菌的分离与鉴定[J].食品工业科技, 2012, 33(20): 171-175.
[9] 马燕, 倪永清, 卢士玲, 等. 新疆特色干酪中乳酸菌的分离鉴定[J].中国酿造, 2011, 20(8): 38-40.
[10] 张慧杰, 玉柱, 王林, 等. 青贮饲料中乳酸菌的分离鉴定及优良菌株筛选[J]. 草地学报, 2011, 19(1): 138-141.
[11] 杨爱华, 王成忠, 范素琴. 发酵香肠乳酸菌生理生化特性的研究[J].中国酿造, 2009, 28(8): 79-81.
[12] 东秀珠, 蔡妙英. 常见细菌鉴定系统手册[M]. 北京: 科学出版社,2001: 423-447.
[13] 布坎南, 吉本斯. 伯杰细菌鉴定手册[M]. 北京: 科学出版社, 1984: 660-721.
[14] 盛海圆, 郭艳萍, 常艳, 等. 传统泡菜中乳酸菌多样性的分析[J]. 中国微生态学杂志, 2010, 22(7): 580-586.
[15] 唐思, 刘璋武, 赵九飞. 醉鱼中乳酸菌的分离与鉴定研究[J]. 肉类工业, 2010(12): 29-31.
[16] MUYANJA C M B K, NARBHUS J A, TREIMO J, et al. Isolation,characterisation and identification of lactic acid bacteria from bushera: a Ugandan traditional fermented beverage[J]. International Journal of Food Microbiology, 2003, 80: 201-210.
[17] 赵鸭美, 刘林, 安静萤, 等. 一株海洋乳酸菌的鉴定及生物学特性的初步研究[J]. 北京联合大学学报, 2013, 27(2): 60-63.
[18] 湛剑龙, 陈钧, 黄林波, 等. 贵州少数民族酸肉、酸鱼中乳酸菌的分离鉴定[J]. 肉类研究, 2013, 27(7): 40-43.
[19] 陈红征, 杨洁. 发酵马肉中乳酸菌的分离筛选与鉴定[J]. 食品科技,2010, 35(1): 31-33.
[20] HWANHLEM N, BURADALENG S, WATTANACHANT S, et al. Isolation and screening of lactic acid bacteria from Thai traditional fermented fish (Plasom) and production of Plasom from selected strains[J]. Food Control, 2011, 22(3/4): 401-407.
[21] FAYE T, TAMBURELLO A, BEGARUD G E, et al. Survival of lactic acid bacteria from fermented milks in an in vitro digestionmodel exploiting sequential incubation in human gastric and duodenum juice[J]. Journal of Dairy Science, 2011, 94(7): 3229-3241.
[22] LIU Wenjun, BAO Qiuhua, JINRIMUTU, et al. Isolation and identification of lactic acid bacteria from Tarag in Eastern Inner Mongolia of China by 16S rRNA sequences and DGGE analysis[J]. Microbiological Research, 2012, 167(2): 110-115.
[23] 林胜利, 张琦琳, 聂小华. 发酵鱼制品的筛选鉴定及其初步应用[J].食品与发酵工业, 2012, 38(2): 61-63.
[24] GRECO M, MAZZETTE R, de SANTIS E P L, et al. Evolution and identification of lactic acid bacteria isolated during the ripening of Sardinian sausages[J]. Meat Science, 2005, 69(4): 733-739.
[25] 刘海燕, 苏秀侠, 陈群. 乳酸菌基因组学研究现状[J]. 中国畜牧兽医,2009, 36(11): 60-62.
Isolation, Screening and Identification of Lactic Acid Bacteria from Pickled Mantis Shrimp
LIU Zhengxing, YUE Xiqing*
(College of Food Science, Shenyang Agricultural University, Shenyang 110866, China)
Totally 49 strains suspected to be lactic acid bacteria were segregated from pickled mantis shrimp. Three of these strains, namely L14, L22 and L28, were preliminarily screened via morphological observation and physiological and biochemical tests. Subsequent 16S rDNA sequencing and analysis showed that L14 had 99% similarity to Enterococcus faecium, L22 had 98% similarity to Lactobacillus brevis and L28 had 99% similarity to Lactobacillus coryniformis subsp. torquens. The values of optical density at 600 nm (OD600nm) of the three selected strains after 24 h of culture were all higher than 1.0 and the pH values of their cultures were around 4.0 with the lowest pH of 3.97 observed for L22. All these three strains grew well at temperatures ranging from 25 to 35 ℃ and grew normally in the presence of 60 g/L NaCl.
pickled mantis shrimp; screening; lactic acid bacteria; 16S rDNA
TS201.3
A
1002-6630(2015)09-0125-05
10.7506/spkx1002-6630-201509023
2014-07-25
刘正行(1989—),女,硕士,研究方向为功能性食品开发。E-mail:2530367439@qq.com
*通信作者:岳喜庆(1966—),男,教授,博士,研究方向为动物性食品加工。E-mail:yxqsyau@126.com
