3种杀菌剂在北京林地食用菌中的残留与安全性评价
2015-12-13罗梅梅王纪华马智宏王守现
贺 敏,罗梅梅,王纪华,马智宏,刘 宇,王守现
(1.北京农业质量标准与检测技术研究中心,北京 100097;2.北京市农林科学院植物保护环境保护研究所,北京 100097;3.湖南农业大学资源与环境学院,湖南 长沙 410128)
3种杀菌剂在北京林地食用菌中的残留与安全性评价
贺 敏1,2,罗梅梅3,王纪华1,马智宏1,刘 宇2,王守现2
(1.北京农业质量标准与检测技术研究中心,北京 100097;2.北京市农林科学院植物保护环境保护研究所,北京 100097;3.湖南农业大学资源与环境学院,湖南 长沙 410128)
在北京市林地食用菌基地采集不同品种食用菌,监测多菌灵、噻菌灵和咪鲜胺的残留水平。样品用乙腈提取,N-丙基乙二胺和弱 阳离子交换吸附剂净化,超高效反相液相 色谱分离,三重四极杆质谱检测,基质匹配标准溶液的外标法定量。在添加量为0.01~1.0 mg/kg时,方法的回收率为74%~100%,相对标准偏差为2%~13.0%,咪鲜胺、噻菌灵和多菌灵3 种农药的最小检出量分别为0.003、0.003、0.001 5 ng,最低检出浓度为0.01 mg/kg。林地食用菌样品中噻菌灵的残留量均小于0.01 mg/kg,多菌灵的残留量为0.01~0.42 mg/kg,咪鲜胺的残留量为0.01~0.51 mg/kg。我国规定多菌灵、噻菌灵、咪鲜胺在食用菌中的最大残留限量分别为1.0、5.0、2.0 mg/kg,以此为依据,北京林地食用菌中的多菌灵、噻菌灵和咪鲜胺残留是安全的。
超高效液相色谱-串联质谱;多菌灵;噻菌灵;咪鲜胺;食用菌
多菌灵、噻菌灵和咪鲜胺是食用菌病害防治中使用最为广泛的低毒杀菌剂,关于多菌灵、噻菌灵和咪鲜胺在食用菌中的残留分析方法,主要有气相色谱法[1-3]、高效液相色谱法[4-12]和液相色谱-质谱联用法[13-22],样品净化主要采用液液分配法、柱层析法、混合型阳离子交换固相萃取柱法、分散净化法,上述报道的方法无法同时检测分析食用菌中多菌灵、噻菌灵和咪鲜胺。GB/T 23202—2008《食品中农药最大允许残留限量》[23]采用石墨化炭黑-氨基混合固相萃取柱净化,液相色谱-质谱联用同时测定食用菌中440 种农药,包括多菌灵、噻菌灵和咪鲜胺,但该方法采用石墨化炭黑-氨基混 合固相萃取柱净化成本高、耗时长。本研究探讨了利用乙腈提取,N-丙基乙二胺(primary secondary amine,PSA)和弱阳离子交换吸附剂填料(weak cation exchange packing,WCX)混合分散净化、超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS-MS)分离检测食用菌中多菌灵、噻菌灵和咪鲜胺残留量的可能性,建立的多残留分析方法达到NY/T 788—2004《农药残留准则》[24]的要求。利用该方法对北京林地的食用菌样品进行了农药残留监测,旨在为林地食用菌产品安全及农药污染控制提供科学依据。
1 材料与方法
1.1 材料与试剂
食用菌采自北京郊区县林地食用菌基地。
多菌灵(CAS号10605-21-7,纯度98.9%)、噻菌灵(CAS号148-79-8,纯度99.0%)和咪鲜胺(CAS号67747-09-5,纯度97.6%)标准品 百灵威科技有限公司;乙腈、乙酸(色谱纯) 美国Fish公司;PSA和WCX 月旭材料科技有限公司;所有提取用有机溶剂均为国产分析纯。
1.2 仪器与设备
Acquity-Xevo TQD超高效液相色谱-三重四极杆质谱、Filter Unit 滤膜(0.22 ☒m)、Acquity UPLC BEH C18色谱柱 美国Waters公司;QL-901漩涡混合器 海门市其林贝尔仪器制造有限公司;5415D离心机 德国Eppendorf公司;2094样品均质机 丹麦Foss有限公司;T25匀浆机 德国IKA公司;BUCHI-215型旋转蒸发浓缩仪 瑞士布琪公司;1/10万和1/100电子天平 瑞士梅特勒-托利多集团。
1.3 方法
1.3.1 样品采集与制备
参照NY/T 762—2004 《蔬菜农药残留检测抽样规范》[25]和NY/T 789—2004《农药残留分析样本采样方法》[26],在北京市通州区永乐店镇、房山区蒲洼镇、昌平区南邵镇和平谷区马昌营镇林地食用菌基地随机抽取食用菌作为检测样本。采集食用菌整个子实体可食用部位,每个样品至少采集12 个。抽样时,应除去泥土、黏附物及明显腐烂和萎蔫部分。当林地食用菌样品已收获,在收获的样品中从中心到四周五点取样,每批样品采集1~2 kg作为一个样本。食用菌运回实验室后放入均质机中捣碎,各分取500 g左右2 份,放入样品袋中制成A、B待测样,A份样品马上测定,B份样品作为备份样品以备其他需要。所有样品均置于—20 ℃冰箱中贮存,待测定。
1.3.2 样品提取
称取食用菌10 g置于50 mL塑料离心管中,加入5 g氯化钠、2 g无水MgSO4、25 mL 5%的乙酸-乙腈溶液摇匀,高速匀浆30 s后,放入离心机中4 000 r/min离心1 min,留上清液待净化。
1.3.3 样品净化
吸取1.3.2节制取上清液1.5 mL,转入装有PSA 50 mg、MCX 50 mg、MgSO450 mg的2 mL离心管中,涡旋1 min后放入离心机中14 000 r/min离心1 min,取上清液过0.22 ☒m滤膜,供UPLC-MS-MS分析。
1.3.4 液相色谱及质谱检测
1.3.4.1 液相色谱条件
Acquity UPLC BEH C18柱(100 mm×2.1 mm,1.7 ☒m),柱温40 ℃,样品室温度10 ℃,进样量3 ☒L。流动相A为超纯水,流动相B为乙腈,流速0.3 ☒L/min。流动相梯度洗脱程序:0~2.0 min,流动相A由80%线性变化至20%;2.0~4.0 min,流动相A由20%线性变化至50;4.0~5.0 min,流动相A由50%线性变化至80%。
1.3.4.2 质谱条件
电喷雾离子源,正离子模式;毛细管电压3.20 kV;离子源温度150 ℃;去溶剂温度350 ℃;去溶剂气和锥孔气均为高纯液氮,去溶剂气流速为550 L/h,锥孔气流速为40 L/h;碰撞气为高纯氩气;采用多反应离子监测模式,用基质匹配标准溶液的外标法定量。母离子、子离子、锥孔电压、碰撞电压、保留时间见表1,多反应选择离子色谱图见图1。

表1 咪鲜胺、噻菌灵和多菌灵的监控离子对、锥孔电压、碰撞能量和保留时间Table1 Precursor ions, product ions, cone voltage, collision energy and retention time ime
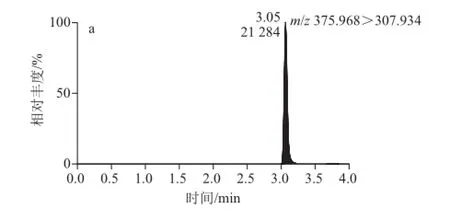

图1 咪鲜胺(a)、噻菌灵(b)和多菌灵(c)的多反应选择离子色谱图(0.01 mg/L) g/LFig.1 MRM chromatograms of prochloraz, thiabendazole and carbendazim at 0.01 mg/L
1.3.5 标准曲线和添加回收率实验
采用食用菌样品的空白基质配制标准曲线。分别取200 ☒L多菌灵、噻菌灵和咪鲜胺母液,用乙腈定容到20 mL,配成质量浓度为10 mg/L的混合标准溶液。用系列稀释法配制质量浓度为0.001、0.002、0.005、0.01、0.02、0.05、0.1、0.2、0.5 mg/L的标准溶液系列,取空白食用菌样品,按照1.3.2节和1.3.3节的方法提取净化,过膜后的上清液取1 mL,氮吹仪上吹干,用配制的标准溶液系列定容到1 mL,摇匀后转移到自动进样小瓶,进UPLC-MS-MS检测。与此同时,取空白食用菌样品,同时添加多菌灵、噻菌灵和咪鲜胺混合标准溶液,设定0.01、0.1、1.0 mg/kg三个添加水平,每个水平设5 个重复,按照以上方法进行实验,另设空白对照。
1.3.6 定量方法
采用外标法与标准曲线结合应用的的定量方法,即用农药标准品(加入一定量的基质)配制成一系列质量浓度的标准溶液,然后测出各自的色谱峰面积,再以农药量为横坐标,峰面积为纵坐标,绘制标准曲线。在相同检测条件下,注入待测样本溶液后,得到峰面积,然后在标准曲线上查出相应的农药量,根据待测样本溶液定容体积,样本溶液进样体积和称样质量等因素,计算出待测样本中农药残留量,可以下式表示:

式中:R为样本中农药残留量/(mg/kg);Q为从标准曲线上查得的相应农药量/ng;V终为样本溶液最终定容体积/mL;V样为样本溶液进样体积/☒L;m为称样量/g;P为样品稀释倍数(浓缩前量取的提取溶液体积与实际加入的提取溶剂体积的比值)。
1.3.7 安全性评价
以我国最新颁布的NY/T 749—2012 《绿色食品:食用菌》[27]和GB 2763—2012《食品中农药最大允许残留限量标准》[28]为依据,评价食用菌中残留的多菌灵、噻菌灵和咪鲜胺的安全性。
2 结果与分析
2.1 方法的线性相关性
以农药的质量浓度为横坐标,定量离子的峰面积为纵坐标制作标准曲线,结果表明在相对应的质量浓度范围内,呈现出较好的线性,结果见表2。

表2 咪鲜胺、噻菌灵和多菌灵的回归方程、相关系数和最小检出量Table2 Regressioon equations, correlation effiicients ad LODs of 3 funiies
2.2 方法的准确度、灵敏度和精密度
香菇、平菇、双孢菇、灰树菇、鸡腿菇、木耳、黄伞和榆黄蘑的添加方法数据见表3。结果表明:方法的回收率在74%~100%之间,相对标准偏差(relative standard deviation,RSD)为2%~13%,咪鲜胺、噻菌灵和多菌灵在食用菌中的最低检测浓度均为0.01 mg/kg。
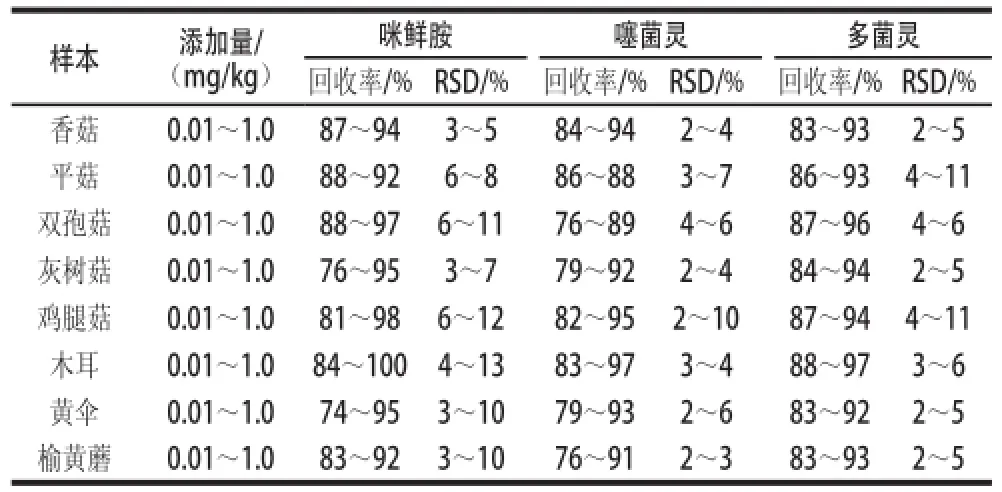
SDn=5)=5 Table 3 Average recovery and relative standard deviations (RSDs) of表3 咪鲜胺、噻菌灵和多菌灵的添加回收率和RSD(Table3 Average recovery and relative standard deviations (RSDs) of 3 fungicides in edible fungi (n n = 5)= 5)
2.3 3 种杀菌剂的残留量
2012—2013年期间,在北京市通州区永乐镇、房山区蒲洼镇、平谷区马昌营镇、昌平区南邵镇等林地食用菌基地采集香菇、平菇、双孢菇、灰树菇、鸡腿菇、木耳、黄伞和榆黄蘑样品,对样品中的多菌灵、噻菌灵和咪鲜胺残留进行了测定,检测结果见表4。食用菌样品中,多菌灵的残留量为0.01~0.42 mg/kg;噻菌灵的检出率为0,残留量均小于0.01 mg/kg;咪鲜胺的残留量为0.01~0.51 mg/kg。

表4 食用菌中咪鲜胺、噻菌灵和多菌灵的残留量Table4 Residual contents of 3 fungicides in edible fungi
3 结 论
本实验报道了北京林地食用菌中多菌灵、噻菌灵和咪鲜胺的残留监测结果,为林地食用菌的质量安全提供技术支持和数据保障。采集的食用菌样品用乙腈提取,分散吸附剂净化,UPLC-MS-MS检测,方法的平均回收率在74%~100%之间,满足农药残留分析的要求。NY/T 749—2012规定多菌灵、咪鲜胺在食用菌(鲜)中的最大残留限量分别为1.0、2.0 mg/kg,GB 2763—2012规定噻菌灵在香菇(鲜)中的最大残留限量为5.0 mg/kg。采集的香菇、平菇、双孢菇、灰树菇、鸡腿菇、木耳、黄伞和榆黄蘑样品中,噻菌灵的残留量均低于0.01 mg/kg,多菌灵的残留量均不高于0.42 mg/kg,咪鲜胺的残留量均不高于0.51 mg/kg,根据监测结果,北京林地食用菌中这3 种杀菌剂的残留水平符合绿色食用菌标准。
[1] 袁宏球, 尹桂豪, 程伶俐, 等. NY/T 1456—2007 水果中咪鲜胺残留量的测定: 气相色谱法[S]. 北京: 中国标准出版社, 20 07.
[2] 侯志广, 赵晓峰, 张浩, 等. 气相色谱法测定稻米中丙环唑和咪鲜胺的残留量[J]. 农药, 2013, 52(4): 273-274; 280.
[3] 翟淑华, 张爱娟, 刘伟, 等. 葡 萄与土壤中咪鲜胺及其代谢物的残留分析[J]. 农药, 2012, 51(10): 748-749; 757.
[4] 饶钦雄, 宣岩芳, 白冰, 等. 超高效液相色谱法测定食用菌中咪鲜胺残留量[J]. 上海农业学报, 2011, 27(4): 87-89.
[5] 李胜清, 陈浩. 固相萃取-高效液相色谱法测定蘑菇中咪鲜胺的残留量[J]. 分析科学学报, 2008, 2 4(6): 735-737.
[6] 陈练洪, 王登飞, 游俊, 等. 固相萃取-高效液相色谱法同时测定食用菌中多菌灵和噻菌灵残留量[J]. 理化检验: 化学分册, 2009, 45(8): 982-984.
[7] 张浩, 张祥辉, 逯忠斌, 等. 高效液相色谱法同时测定食用菌中的多菌灵和噻菌灵残留量[J]. 农药, 2008, 47(7): 517-518.
[8] 陈莹, 丛佩华, 聂继云, 等. 分散固相萃取-高效液相色谱法测定水果中多菌灵和噻菌灵[J]. 果树学报, 2008, 25(5): 769-773.
[9] 刘晓松, 童张法, 郑玲, 等. SPE-HPL C法同时测定多种浓缩果汁中的噻菌灵和多菌灵[J]. 武汉大学学报: 理学版, 2009, 55(5): 511-516.
[10] 赵连海, 于淑新, 孙元社, 等. QuEChERS-高效液相色谱法测定果蔬中多菌灵残留[J]. 农业工程, 2012, 2(7): 42-44; 65.
[11] 王登飞, 陈练洪, 游俊, 等. 固相萃取-HPLC法同时测定果蔬中多菌灵和噻菌灵残留量[J]. 农药, 2008, 47(6): 443-444; 447.
[12] 何强, 赵洁, 孔祥虹, 等. HPLC法同时测定苹果及浓缩苹果汁中吡虫清等4 种农药的残留量[J]. 分析试验室, 2008, 27(6): 64-67.
[13] 牟仁祥, 陈铭学, 曹赵云, 等. NY/T 1680—20 09 蔬菜水果中多菌灵等4 种苯并咪唑类农药残留量的测定: 高效液相色谱法[S]. 北京:中国标准出版社, 2009.
[14] 连文浩, 苏建峰, 江滨炜. 超高效液相色谱-串联质谱法测定干香菇中多菌灵和噻菌灵残留量研究[J]. 食品科学, 2009, 30(12): 202-204.
[15] 姚艳玲, 倪炜华, 顾益. LC-MS快速检测橙汁中苯并咪唑类农药[J].中国卫生检验杂志, 2013, 23(1): 33-35.
[16] 刘晓松, 郑玲, 黄文雯, 等. 浓缩果汁中甲基硫菌灵、2-氨基苯并咪唑、多菌灵、噻菌灵及5-羟基噻菌灵残留量的液相色谱-串联质谱法测定[J]. 分析测试学报, 2013, 32(1): 84-88.
[17] 张卉, 胡梅, 王骏, 等. 液相色谱-质谱测定蔬菜、水果中四种保鲜剂的残留量[J]. 食品科学, 2009, 30(2): 180-184.
[18] 徐永, 寿林飞, 虞淼, 等. 超高效液相色谱-串联四极杆质谱联用法测定水果中多效唑、氯吡脲和咪鲜胺的残留[J]. 农药学学报, 2012, 14(1): 61-66.
[19] 程莉, 董丰收, 刘新刚, 等. QuEChERS-超高效液相色谱-串联质谱方法快速测定小麦中的咪鲜胺残留[J]. 农药学学报, 2009, 11(3): 357-361.
[20] 刘慧群, 刘新刚, 董丰收, 等. 超高效液相色谱-串联质谱测定蔬菜、水果和土壤中多菌灵的残留研究[J]. 农药科学与管理, 2009, 30(4): 20-24.
[21] 赵领军, 岳晖, 郭栋梁, 等. UPLC-MS/MS法测定苹果中苯并咪唑类农药残留[J]. 食品科学, 2009, 30(12): 209-212.
[22] 孔志强, 董丰收, 刘新刚, 等. 超高效液相色谱-串联质谱法测定柑橘及柑橘精油中4 种农药残留[J]. 分析化学, 2012, 40(3): 474-477.
[23] 庞国芳, 范春林, 郑军红, 等. GB/T 23202—2008 食用菌中440 种农药及相关化学品残留量的测定液相色谱-串联质谱法[S]. 北京: 中国标准出版社, 2008.
[24] 刘光学, 乔雄梧, 陶传江, 等. NY/T 788—2004 农药残留试验准则[S].北京: 中国标准出版社, 2004.
[25] 刘肃, 刘潇威, 钱洪, 等. NY/T 762—2004 蔬菜农药残留检测抽样规范[S]. 北京: 中国标准出版社, 2004.
[26] 何艺兵, 刘丰茂, 潘灿平, 等. NY/T 789—2004 农药残留分析样本采样方法[S]. 北京: 中国标准出版社, 2004.
[27] 黎其万, 汪庆平, 刘宏程, 等. NY/T 749—2012 绿色食品: 食用菌[S].北京: 中国标准出版社, 2012.
[28] 国家农药残留标准审评委员会. GB 2763—2012 食品中农药最大允许残留限量[S]. 北京: 中国标准出版社, 2012.
Residue and Safety Evaluation of Three Fungicides in Edible Fungi in Plantation Woodlands of Beijing
HE Min1,2, LUO Meimei3, WANG Jihua1, MA Zhihong1, LIU Yu2, WANG Shouxian2
(1. Beijing Research Center for Agricultural Standards and Testing, Beijing 100097, China; 2. Institute of Plant Protection and Environment Protection, Beijing Academy of Agriculture and Foresty Sciences, Beijing 100097, China; 3. College of Resources and Environmental, Hunan Agricultural University, Changsha 410128, China)
The objective of this study was to collect and analyze residue data of carbendazim, thiabendazole and prochloraz in edible fungi in Beijing plantation woodlands. Samples were extracted with acetonitrile, cleaned up by mixed PSA and MCX dispersive solid-phase extraction, separated by ultra performance liquid chromatography, detected using a triple quadrupole mass spectrometer under the multi-reaction monitoring model, and quantitatively analyzed with external standard method using matrix-match standard solution. Average recoveries in samples ranged from 74% to 100% at three spiked levels from 0.01 to 1.0 mg/kg, with relative standard deviations varying from 2% to 13.0%. Thiabendazole residues in the tested samples were below 0.01 mg/kg, carbendazim residues ranged from 0.01 to 0.42 mg/kg and prochloraz residues ranged from 0.01 to 0.51 mg/kg, which were all less than their maximum residue limits in edible fungus (5.0, 1.0 and 2.0 mg/kg, respectively). Based on these results, the three pesticides residues were safe for the edible fungi in Beijing plantation woodlands.
ultra performance liquid chromatography-triple q uadrupole mass spectrometry (UPLC-MS-MS); carbendazim; thiabendazole; prochloraz; edible fungus
TS201.3
A
1002-6630(2015)04-0213-04
10.7506/spkx1002-6630-201504042
2014-03-19
北京市农林科学院青年科研基金项目(QNJJ201210);国家现代农业产业技术体系北京市食用菌产业创新团队项目
贺敏(1980—),女,高级工程师,博士研究生,研究方向为环境监测与治理。E-mail:hemin800420@163.com
