UPLC-IDMS法测定配方奶粉中的生物素含量
2015-12-13梁敏慧崔亚娟全霞陈兆天李菁菁
梁敏慧,崔亚娟*,叶 润,李 全霞,陈兆天,李菁菁,李 东
(1.北京工业大学生命科学与生物工程学院,北京 100124;2.北京市营养源研究所,北京 100069)
UPLC-IDMS法测定配方奶粉中的生物素含量
梁敏慧1,崔亚娟2,*,叶 润2,李 全霞2,陈兆天2,李菁菁2,李 东2
(1.北京工业大学生命科学与生物工程学院,北京 100124;2.北京市营养源研究所,北京 100069)
建立一种超高效液相色谱-同位素稀释质谱法测定配方奶粉中生物素含量的方法。样品中加入生物素-D2作为同位素内标,经水超声提取后,以含体积分数0.1%甲酸的10 mmol/L乙酸铵溶液和乙腈作为流动相进行梯度洗脱,采用电喷雾正离子模式、多反应监测方式进行定性定量分析。结果表明:生物素在1~50 ng/mL范围内线性关系良好,线性范围内对已知生物素含量样品3 个标准添加水平的平均回收率为89.6%~93.1%,相对标准偏差为1.71%~4.33%。方法检出限为0.6 μg/100 g,定量限为1.5 μg/100 g,该方法具有灵敏度高、重复性好、分析时间短等优点,可以满足配方奶粉中生物素含量的测定要求。
生物素;超高效液相色谱-同位素稀释质谱;奶粉
生物素又叫做VB7,是一种水溶性B族维生素。生物素是构成羧化酶的重要辅酶[1],参与人体内脂肪、糖类和氨基酸的代谢[2],对于维持机体正常生理功能有重要的作用。其长期摄入不足会导致免疫、代谢、基因表达方面的疾病[3-7]。配方奶粉是婴幼儿除母乳外主要的营养来源,因此对其中生物素的检测监督是十分必要的。
目前,配方奶粉中生物素的测定方法主要是微生物法[8-10]。微生物法也是我国分析婴幼儿食品和乳品中生物素的国标分析方法,其检测灵敏度高,但是实验周期长、重复性差,对实验操作环境有比较严格的要求。其他常用于生物素检测的分析方法还包括生物传感器法、酶联免疫法、高效液相色谱法[1,11-12]等。超高效液相色谱-同位素稀释质谱(ultra performance liquid chromatographyisotope dilution mass spectrometry,UPLC-IDMS)技术是一种新型的仪器分析手段,它将色谱良好的分离能力与质谱的高选择性结合起来,具有灵敏性高、选择性好、分析速度快并且分析结果准确等优点,近年来在食品分析中得到了广泛的应用[13-14]。而同位素稀释技术[15-16]通过加入稳定同位素标记物,可有效消除基质效应及处理过程带来的较大偏差,尽可能保证了分析结果的准确性。近年来,国内已有报道利用高效液相色谱-质谱法测定配方奶粉中的生物素[17-19],但采用同位素稀释法分析测定奶粉中生物素含量的方法尚未见报道。
本实验采用可以抵消样品处理过程中损失的同位素稀释质谱法,同时结合UPLC-串联质谱良好的分离能力及高选择性,对配方奶粉中的生物素进行了定性和定量分析,建立一种结果准确、分析速度快、样品处理简单的检测方法。
1 材料与方法
1.1 材料与试剂
配方奶粉样品(样品A~E、a~e) 市购。
生物素标准品(纯度≥98.0%) 美国Supelco公司;生物素-D2标准品(纯度≥99.5%) 美国Iso Sciences公司;乙酸铵、甲酸(均为色谱纯) 美国Sigma公司;乙腈(色谱纯) 美国Fisher公司;硫酸、盐酸(均为分析纯) 北京化学试剂厂;实验用水为超纯水。
1.2 仪器与设备
Acquity@UPLC-Xevo TQ型超高效液相色谱-串联质谱联用仪 美国Waters公司;BS224S型分析天平德国Sartorius公司。
1.3 方法
1.3.1 标准储备液配制
生物素标准储备溶液(100 μg/mL):精确称取生物素1.0 mg,用体积分数50%甲醇溶液溶解至10 mL,摇匀,密封、避光保存。生物素-D2标准储备溶液(100 μg/mL):称取生物素-D21.0 mg,用体积分数50%甲醇溶液溶解至10 mL,摇匀,密封、避光保存。临用前根据需要用水稀释成不同质量浓度的标准溶液。
1.3.2 样品处理条件的优化
根据现有文献[20-21]和标准[22]选取奶粉经0.5 mol/L硫酸、1.0 mol/L盐酸溶解后在121 ℃,1 MPa条件下水解30 min和水溶解后超声10 min作为样品提取方法,考察不同提取方法的提取效果。并通过实验比较三氯甲烷、调pH值、乙腈和高氯酸去除蛋白质的效果。
确定样品处理方法后称取奶粉样品7 g(精确至0.000 1 g)于50 mL锥形瓶中,加入与样品中生物素含量相近的生物素-D2标准储备液;瓶中加入30 mL温水振摇溶解后,超声提取10 min。冷却至室温,用5 mol/L硫酸调pH值到1.7,再用10 mol/L氢氧化钠溶液调pH值到4.6,溶液转移到100 mL容量瓶中,用水冲洗3 次,合并溶液于容量瓶中,定容混匀后过滤,滤液过0.2 μm聚丙烯滤膜滤膜,待上机分析。
1.3.3 色谱条件优化
色谱柱:实验比较BEH C18柱(100 mm×2.1 mm,1.7 μm)和Acquity@HSS T3柱(2.1 mm×100 mm,1.8 μm)分离效果的差异;流速0.4 mL/min;柱温40 ℃;进样量10 μL;流动相A:含体积分数0.1%甲酸的10 mmol/L乙酸铵水溶液;流动相B:乙腈。梯度洗脱,洗脱条件见表1。
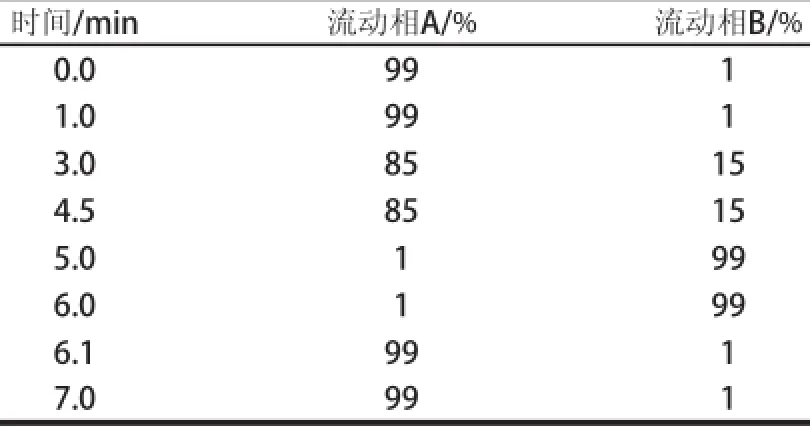
表1 流动相梯度洗脱条件Table1 Elution conditions of mobile phase
1.3.4 质谱条件优化
电喷雾离子源正离子模式;多反应监测;毛细管电压3 000 V;离子源温度150 ℃;去溶剂气温度500 ℃;去溶剂气流速(氮气)1 000 L/h;碰撞气流速(氩气)0.18 mL/min。
在电喷雾源正离子检测方式下,生物素的准分子离子峰为[M+H]+峰。配制0.5 μg/mL的生物素标准溶液,调节各个参数得到响应较强的[M+H]+母离子峰。然后对母离子进行子离子扫描,调节碰撞能量,选择响应较高的2 个子离子作为定性定量离子。2 个离子中响应高的作为定量离子,另一个作为定性离子。优化确定适合本实验的质谱条件。
1.3.5 方法学实验
1.3.5.1 线性范围
准确吸取生物素标准储备溶液,添加与试样中生物素含量相近的生物素同位素内标溶液,用水配制成质量浓度为1、5、10、20、30、40、50 ng/mL的生物素标准溶液进行进样分析,确定生物素的线性范围。
1.3.5.2 检出限与定量限
选择木薯淀粉作为空白样品(经测定不含生物素),对其进行不同水平的加标实验,样品进行前处理后,以RSN为3和RSN为10作为生物素的检出限和定量限。
1.3.5.3 精密度与回收率
向已知生物素含量的奶粉样品中分别添加3 个不同质量浓度的标准溶液进行回收率实验,各个添加水平平行测定6 次,计算加标回收率和相对标准偏差,考察方法的精密度与回收率。
1.3.5.4 与微生物方法比对
选取5 种市购的配方奶粉(样品A~E),每种样品平均分成2 份,一份采用微生物法测定其中的生物素含量,另一份采用UPLC-IDMS测定其中的生物素含量,每份平行测定6 次,计算奶粉中生物素含量,通过2 种方法结果的比较验证UPLC-IDMS方法的可行性与准确性。
2 结果与分析
2.1 样品前处理条件优化
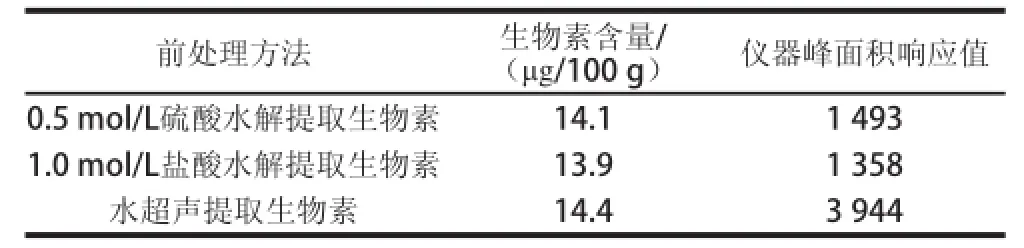
表2 不同前处理方法结果Table2 Comparison of different sample pretreatment procedures
不同提取方法的提取效果见表2。结果显示,3 种方法最终测定值并无显著差异,都可以获得较好的结果。但用水超声提取处理样品后,仪器峰面积响应值要比另外2 种方法高出很多,这可能是由于酸对生物素及其内标的离子抑制作用而导致了仪器响应值的显著降低。考虑到分析的准确性,选择使用水超声处理作为样品的提取方法。
配方奶粉中含有大量的蛋白质存在降低生物素的离子化效率风险,从而影响分析的准确性,并缩短色谱柱的使用寿命[18]。实验通过比较三氯甲烷、调pH值、乙腈和高氯酸去除蛋白质的效果,结果发现三氯甲烷、调pH值以及高氯酸法沉淀蛋白效果较好,可以获得较为澄清的溶液,回收率均为90%以上。但考虑到色谱柱适合的pH值范围以及不同样品在水中的pH值差异会影响生物素在色谱柱上的保留时间,因此选择调pH值法作为去除蛋白质的方法。
2.2 色谱条件优化
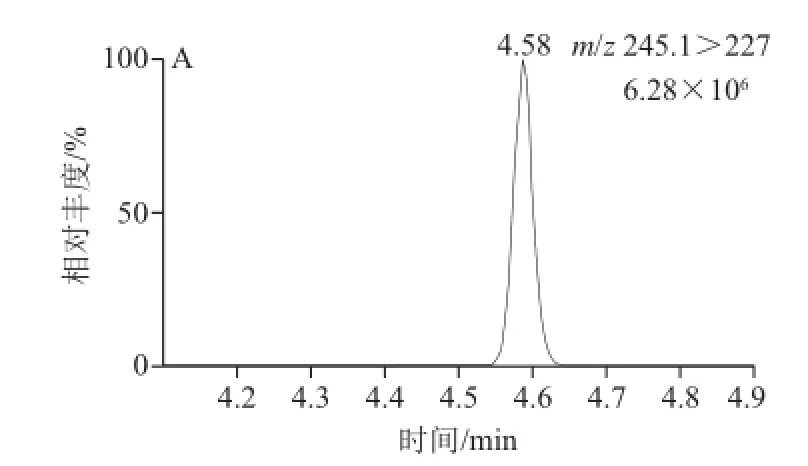
实验中2 种色谱柱的分离效果差异见图1。C18柱的保留时间比T3柱提前,2 种柱子对生物素都有良好的分离效果,但T3柱的响应值(6.28×106)要好于C18柱(3.24×106)的响应值,因此实验选择T3柱。
2.3 质谱条件优化
质谱条件优化后确定的生物素定性和定量离子对分别为m/z 245.1>97.0和m/z 245.1>227.0,生物素-D2的定性和定量离子对分别为m/z 247.1>99.0和m/z 247.1>229.0。生物素及其同位素的母离子、定量定性离子、锥孔电压、碰撞能量等参数见表3。生物素及其同位素-D2的多反应监测色谱图见图2,子离子扫描图见图3。
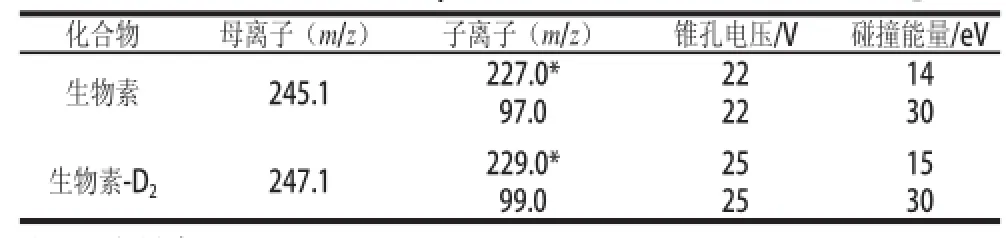
表3 生物素及其同位素内标的质谱参数Table3 Instrumental parameters of biotin and biotin-D
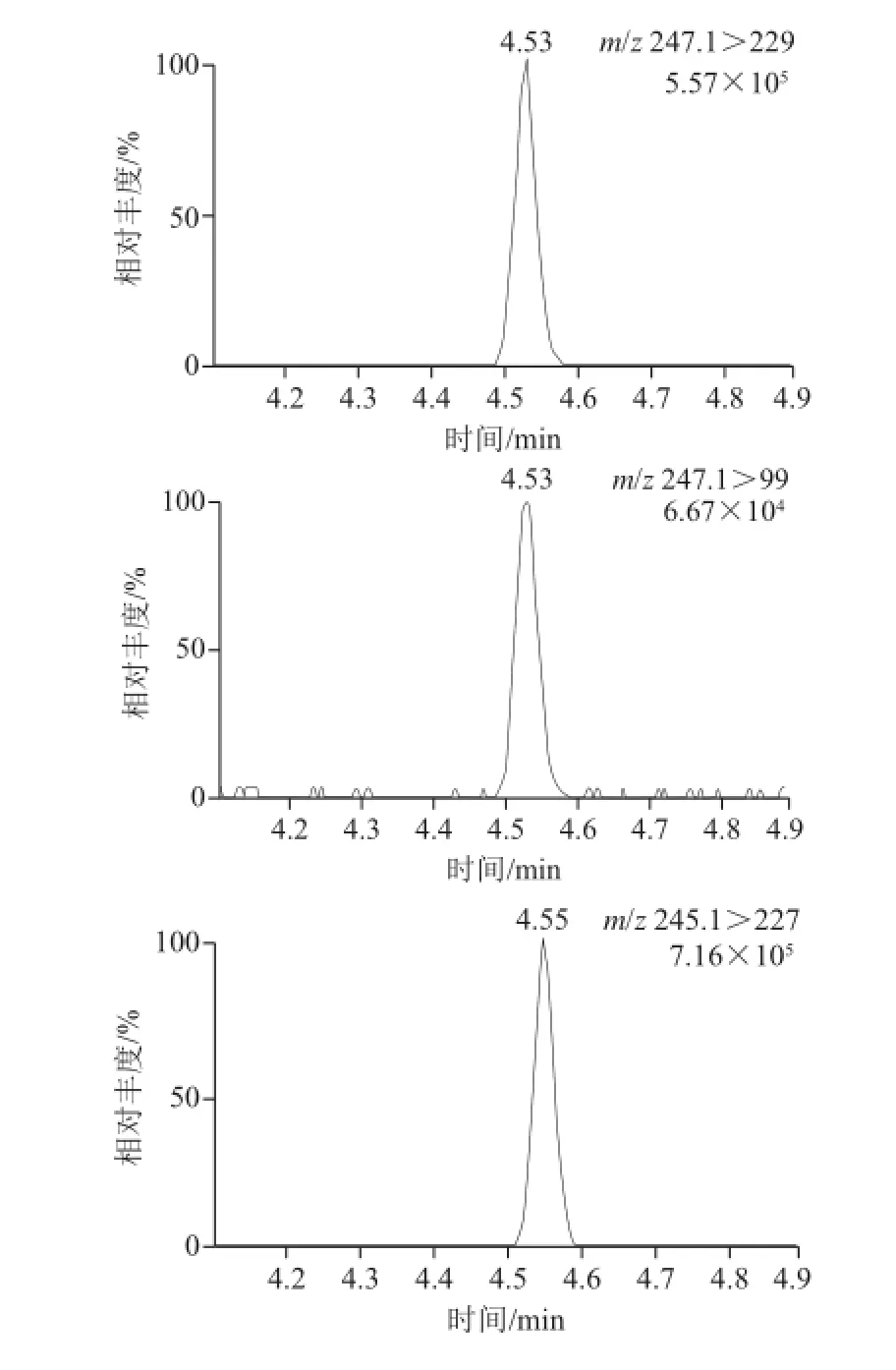
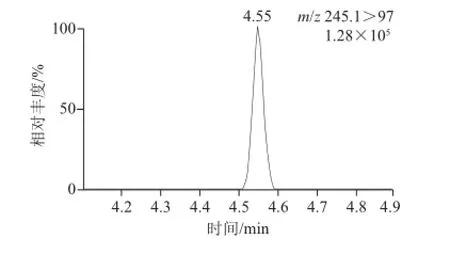
图2 生物素及生物素--DD2的多反应监测色谱图Fig.2 MRM chromatograms of biotin and biotin-D2
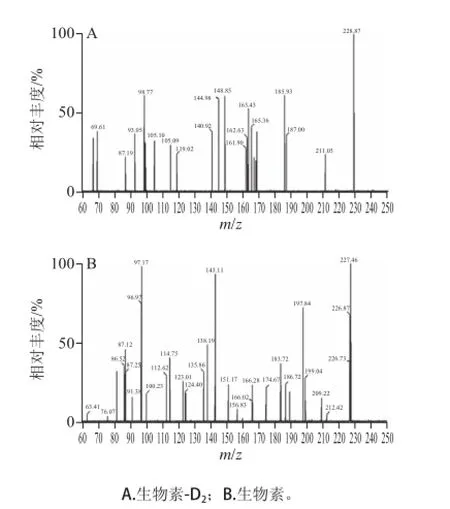
图3 生物素和生物素--DD2的离子扫描质谱图Fig.3 Mass spectra of biotin and biotin-D2
2.4 方法学验证
2.4.1 线性范围
以生物素与生物素内标峰面积比(A生物素/A生物素-D2)和同位素质量浓度的乘积为 纵坐标,生物素质量浓度为横坐标,绘制标准曲线,结果如图4所示。生物素在1~50 ng/mL范围内,线性回归方程为Y=1.826 97X+ 0.049 075 6,相关系数r大于0.999 8,线性关系良好,十分适合做定量分析。
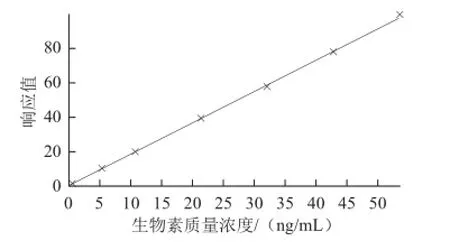
图4 生物素标准曲线Fig.4 The calibration curve of biotin
2.4.2 检出限与定量限
以RSN为3作为检出限,RSN为10作为定量限,得到方法的检出限为0.4 ng/mL,定量限为1.0 ng/mL。当奶粉质量为7 g,定容体积为100 mL时,折算成奶粉含量分别为0.6 μg/100 g和1.5 μg/100 g,表明该方法可对生物素含量较少的奶粉样品进行定性定量分析。
2.4.3 精密度与回收率
向奶粉样品中分别添加3 个不同质量浓度的标准溶液进行回收率实验,各个水平平行测定6次,计算加标回收率和相对标准偏差,结果见表4。生物素3 个水平的加标回收率在89.6%~93.1%,相对标准偏差在1.71%~4.33%,表明该方法比较准确,适用于奶粉中生物素的定性定量分析。
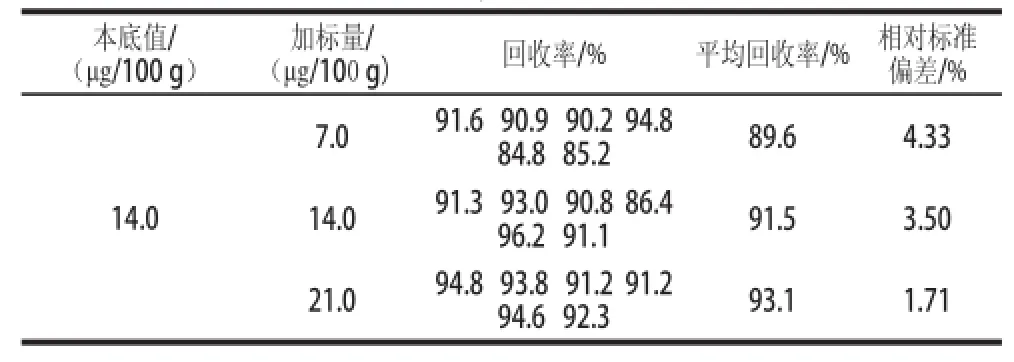
表4 生物素加标回收实验结果Table4 Results of recovery and relative standard deviation
2.4.4 与微生物方法的比对
微生物法是我国测定婴幼儿食品和乳品中生物素的国标分析方法。实验比较了UPLC-IDMS法与微生物法之间的差异来验证所建立方法的准确性。对5 种配方奶粉样品同时做了2 种方法的比对实验,检测结果见表5。 利用SPSS软件对实验结果做非参数Mann-Whitney秩和检验,分析2 种方法测定结果之间差异是否显著:得出P值为0.705(P>0.05),表明2 种方法测定结果无显著差异,证明了实验建立的方法可以用于配方奶粉中生物素的检测。
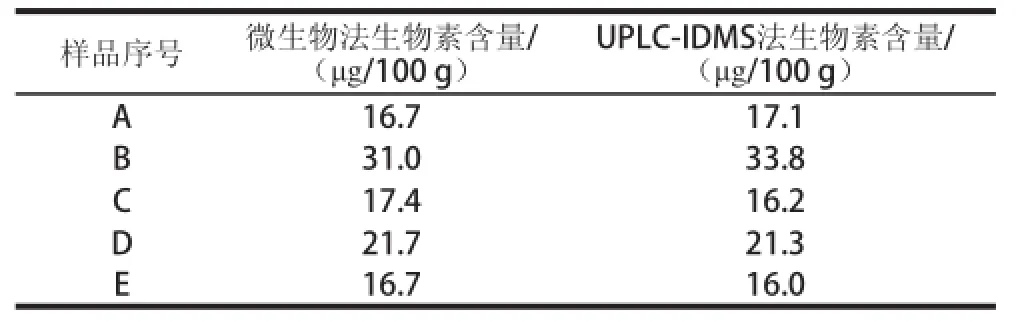
表5 微生物法和UPLC-IDMS法对照实验Table 5 Comparison of microbiological method and UPLC-IDMS method
2.5 实际样品测定结果
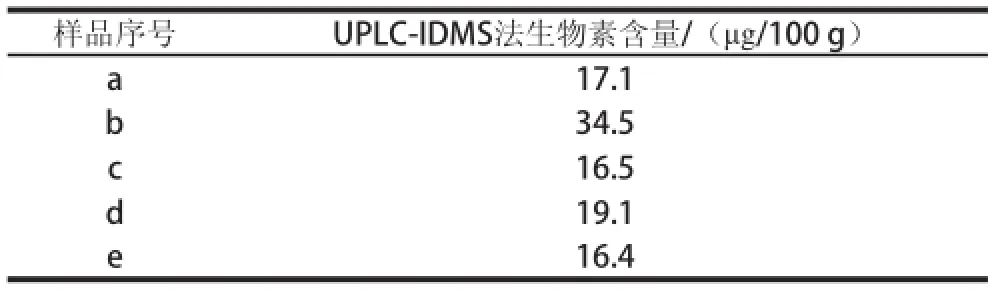
表6 配方奶粉中生物素UPLC-IDMS测定结果Table 6 Analytical results for milk powder samples by UPLC-IDMS
利用所建立的方法对市售的5 种配方奶粉(样品a~e)进行测定,每个样品平行测定3 次,计算平均值,结果见表6。可以看出,5 种配方奶粉中生物素含量均大于8 μg/100 g的,符合国家标准[23]。
3 结 论
本实验建立了一种可以快速检测配方奶粉中的生物素含量的方法。奶粉中生物素含量较低且基质复杂,通过加入同位素内标可消除实验过程中基质效应的影响和处理过程生物素损失带来的偏差,同时利用质谱的高选择性,简化了实验步骤,获得了稳定良好的测定结果。该方法操作过程简单,分析周期短、灵敏度高、重复性好,适合奶粉中生物素的分析研究,必将受到广泛的重视。
[1] KERGARAVAT S V, GOMEZ G A, FABIANO S N, et al. Biotin determination in food supplements by an electrochemical magneto biosensor[J]. Talanta, 2012, 97: 484-490.
[2] ZEMPLENI J, MOCK D. Biotin biochemistry and human requirements[ J]. The Journal of Nutritional Biochemistry, 1999, 10(3): 128-138.
[3] TAKECHI R, TANIGUCHI A, EBARA S, et al. Biotin deficiency affects the proliferation of human embryonic palatal mesenchymal cells in culture[J]. The Journal of Nutrition, 2008, 138( 4): 680-684.
[4] BAEZ-SALDANA A, GUTIERREZ-OSPINA G, CHIMALMONROY J, et al. Biotin deficiency in mice is associated with decreased serum availability of insulin-like growth factor-Ⅰ[J]. European J ournal of Nutrition, 2009, 48(3): 137-144.
[5] BAEZ-SALDANA A, DIAZ G, ESPINOZA B, et al. Biotin deficiency induces changes in subpopulations of spleen lymphocytes in mice[J]. The American Journal of Clinical Nutrition, 1998, 67(3): 431-437.
[6] HERNANDEZ-VAZQUEZ A, OCHOA-RUIZ E, IBARRAGONZALEZ I, et al. Temporal development of genetic and metabolic effects of biotin deprivation. A searc h for the optimum time to study a vi tamin deficiency[J]. Mo lecular Genetics and Metabolism, 2012, 107(3): 345-351.
[7] WATANABLE T, ENDO A. Teratogenic effects of maternal bi otin deficiency on mouse embryos examined at midges tation[J]. Teratology, 1990, 42(3): 295-300.
[8] 汤水平, 李冰, 彭灿, 等. 微 生物法测定婴幼儿配 方乳粉中游离生物素含量的研究[J]. 食品与机械, 2008, 24(5): 96-98.
[9] 王志伟. 婴幼儿乳粉中生 物素含量的测定研究[J]. 包装与食品机械, 2013, 31(3): 66-68.
[10] YIN Xiaoh ong, YANG Jinbao, ZHANG Xiaoyu. Determination method for biotin in infants formula food[J]. China Dairy Industry, 2002, 30(5): 117-119.
[11] INDYK H E, EVANS E A, CASELUNGHE M C B, et al. Determination of biotin and folate in infant fo rmula and milk by optical biosensor-based immunoassay[J]. Journal of AOAC International, 2000, 83(5): 1141-1148.
[12] THOMPSON L B, SCHMITZ D J, PAN S hangjing. Determination of biotin by high-performance liquid chromatography in infant formula, medical nutritional products, and vitamin premixes[J]. Journal of AOAC International, 2006, 89(6): 1515-1518.
[13] 孙良 娟, 蔡泓. 液质联用仪离子源与质量分析器的类型及其在食品安全检测中的应用[J]. 检验检疫科学, 2008, 18(2): 69-72.
[14] 周春红, 朱书强, 王荣. LC-MS/MS在食品安全分析中的应用[J]. 食品工业科技, 2011, 32(2): 124.
[15] DEBIEVRE P. Isotope dilution mass spectrometry as a primary method of analysis[J]. Analytical Proceedings, 1993, 30(8): 328-333.
[16] 刘卫霞, 罗勇, 杨维成. 有机同位素稀释质谱法在食品安全分析中的应用[J]. 化学世界, 2011(3): 184-187.
[17] 王凤玲, 刘爱国, 孙佳佳, 等. 高效液相色谱-质谱法同时测定婴幼儿配方奶粉中叶酸, VB12和生物素[J]. 食品科学, 2013, 34(22): 269-272.
[18] 吴宏, 林玉宙, 黄彩云, 等. 免疫亲和柱净化/高效液相色谱-串联质谱法检测婴幼儿配方乳粉中生物素含量[J]. 分析测试学报, 2013, 32(9): 1135-1138.
[19] 郎昭滨, 程纲领, 马世波. 婴幼儿配方食品和乳粉中串联四极杆质谱的检测方法[J]. 中国乳品工业, 2009, 37(9): 39-42.
[20] 王一红, 冯家力, 潘振球, 等. 液相色谱-串联质谱法分析10 种水溶性维生素[J]. 中国卫生检验杂志, 2007, 17(7): 1160-1162.
[21] BALL G F M. Vitamins in foods analysis, bioavailability, and stability[M]. New York: Taylor & Francis, 2006: 328-329.
[22] 卫生部. GB 5413.19—2010 婴幼儿食品和乳品中游离生物素的测定[S]. 北京: 中国标准出版社, 2010.
[23] 卫生部. GB 10767—1997 婴幼儿配方粉及婴幼儿补充谷粉通用技术条件[S]. 北京: 中国标准出版社, 1997.
Determination of Biotin in Milk Powder by Using Ultra Performance Liquid Chromatography-Isotope Dilution Mass Spectrometry
LIANG Minhui1, CUI Yajuan2,*, YE Run2, LI Quanxia2, CHEN Zhaotian2, LI Jingjing2, LI Dong2
(1. College of Life Science and Bioengineering, Beijing University of Technology, Beijing 100124, China; 2. Beijing Research Institute for Nutritional Resources, Beijing 100069, China)
An ultra performance liquid chromatography-isotope dilution mass spectrometry (UPLC-IDMS) method has been developed for the determination of biotin in milk powder. After spiking biotin-D2as an internal standard, samples were extracted with water. The mobile phase consisted of 10 mmol/L ammonium acetate with 0.1% f ormic acid and acetonitrile. The biotin was identified under multiple-reaction monitoring (MRM) mode and quantified by an internal standard method. The results showed a good linear calibration in the range of 1–50 ng/mL, the recoveries at three spiked levels and the relative standard deviations were 89.6%–93.1% and 1.71%–4.33%, respectively. T he limit of detection and quantification for biotin were 0.6 μg/100 g and 1.5 μg/100 g, respectively. This method is sensitive, time saving, and accurate for the determination of biotin in milk powder.
biotin; ultra performance liquid chromatography-isotope dilution mass spectrometry (UPLC-IDMS); milk powder
TS207.3
A
1002-6630(2015)04-0136-05
10.7506/spkx1002-6630-201504026
2014-07-02
北京市科委科技新星计划项目(2011059);卫生部行业科研专项(201202012)
梁敏慧(1992—),女,硕士研究生,研究方向为食品分析。E-mail:lmh29301126@163.com
*通信作者:崔亚娟(1979—),女,副研究员,博士,研究方向为食品分析。E-mail:cuiyj66@163.com
