DTI技术示踪视束、视辐射在指导脑胶质瘤术后放疗方案选择中的应用价值
2015-12-13赵超云夏新舍王明磊刘子姗高文奇马辉王晓东夏鹤春
赵超云,夏新舍,王明磊,刘子姗,高文奇,马辉,王晓东*,夏鹤春
1.宁夏医科大学,银川 750004
2.宁夏医科大学总医院肿瘤医院放疗科,银川 750004
3.宁夏医科大学总医院放射科,银川750004
4.宁夏医科大学总医院神经外科,银川 750004
视觉通路纤维束是颅内重要的神经传导通路,视路走行较长,相关解剖结构复杂,在脑胶质瘤术后放疗中可能对视觉通路造成放射损伤而导致视觉功能障碍[1]。目前在胶质瘤术后放疗计划制定中,眼球、视神经、视交叉等前视路被标记为常规串联危及器官进行保护。由于视束及视辐射等后视路在常规CT及常规MRI上难以显示,因此无法限制视束及视辐射所受辐射剂量。随着功能磁共振技术的不断发展,扩散张量成像(diffusion tensor imaging,DTI)纤维示踪技术可以很好地显示白质纤维束的形态、位置及其与肿瘤的关系。在患者术中保证最大程度切除肿瘤的同时,避免造成邻近神经纤维损伤,从而提高患者术后生活质量[2]。术后放疗是脑胶质瘤患者最主要的辅助治疗之一,可明显提高患者中位生存期,但同时也存在发生放射性损伤的风险[3],尤其是靶区周围邻近的重要组织结构[4-5]。本研究拟通过DTI技术,将视束及视辐射的纤维束信息融入放疗定位CT,比较不同常规放疗技术制定的放疗方案中视束及视辐射所受辐射剂量,探究其保护视束及视辐射并指导放疗方案选择的可行性。
1 材料与方法
1.1 一般资料
本研究纳入2013年8月至2015年3月宁夏医科大学总医院肿瘤医院放疗科脑胶质瘤术后放疗病例30例,男性18例,女性12例,年龄24~66岁,平均年龄41.3岁,其中胶质瘤Ⅱ级16例,Ⅲ级7例,Ⅳ级7例(WHO分级)。病变位于左侧额叶7例,右侧额叶5例,右侧颞叶6例,左侧颞叶1例,左侧顶叶1例,右额颞叶4例,左额颞叶1例,右侧顶枕叶3例,右颞枕叶1例,右颞顶叶1例。所有病例均经术后病理证实为胶质瘤,患者术后KPS评分均≥70分。所有患者检查前均签署知情同意书且无MRI检查禁忌症。
1.2 影像学检查
1.2.1 CT定位
患者均采用西门子公司 Somatom Sensation Open 大孔径CT机进行定位扫描,仰卧位,热塑面膜固定头部,扫描层厚3 mm,层间距0 mm。定位CT对比剂增强扫描后,图像传输至Pinnacle 3放疗计划系统。
1.2.2 MRI检查
患者于定位CT扫描2天后,行常规MRI平扫、增强及DTI检查。①扫描设备及患者体位:扫描仪采用GE Signa ExciteHD 3.0 T MRI,8通道正交头线圈,患者取仰卧位,头先进。②DTI扫描参数:扫描序列采用单次激发平面回波序列(EPI),扩散梯度方向为25,TR/TE=10000/98.8 ms,FOV 240 mm×240 mm,矩阵128×128,NEX=2,b为1000 s/mm2,层厚3 mm,层间距为0 mm。③图像后处理:DTI原始数据导入GE ADW4.4工作站,经后处理得到彩色FA图、DCE图与3DT1解剖图融合。分别于双侧视通路的视交叉、视束、外侧膝状体及视辐射放置感兴趣区(region of interest,ROI),从而实现视束、视辐射的重建,阈值设定为0.18(图1)。分析观察两侧视束、视辐射走行、形态及与术后病灶残腔的关系,综合彩色FA图、DCE图及重建视束及视辐射,在3D T1解剖图像分别勾画患侧及健侧视束、视辐射。3D T1解剖图数据导入Pinnacle 3放疗计划系统。
1.3 靶区勾画
所有患者均由放疗科同一名副高以上医师结合定位CT与MR成像勾画。大体肿瘤靶区(gross tumor volume,GTV):术后残留肿瘤和/或术腔,即术后MR成像中异常信号区域。临床靶区(clinical target volume,CTV):胶质瘤Ⅱ级CTV为GTV外扩1.5~2.0 cm,胶质瘤III/IV级CTV 为GTV及周围水肿区外放2.0~3.0 cm。计划靶区(planning target volume,PTV):CTV范围外扩0.5 cm。在靶区勾画完成后,勾画常规危及器官(晶体及脑干等)。最后由放射科同一名副高以上医师利用CT、MR融合图及纤维示踪图像勾画邻近放疗靶区的视束及视辐射(图2)。
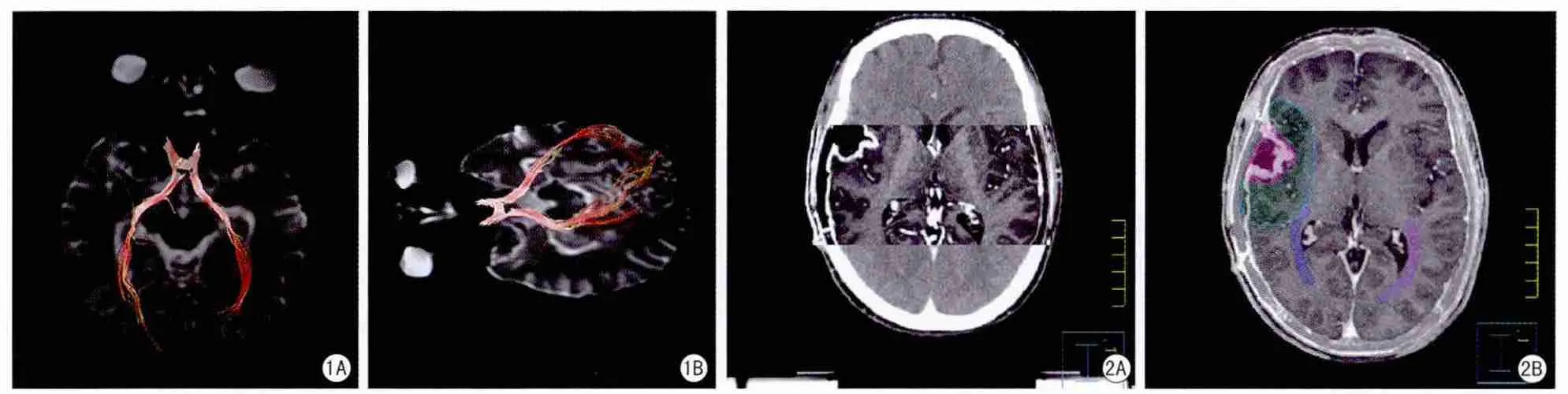
图1 患者男,29岁,右额胶质瘤Ⅱ级,A和B分别为重建后视束、视辐射的DTI图像 图2 患者女,53岁,胶质瘤Ⅲ级。A:导入放疗计划系统中CT与MR融合图像;B:在CT与MR融合图像上勾画的放疗靶区及视辐射。粉色区域代表GTV,绿色区域表示CTV,淡蓝色区域为PTV;深蓝色与紫色区域分别表示患侧、健侧视辐射走行区域Fig.1 A and B are the reconstructive optic tract and optic radiation of a 29-year-old male patient of cerebral gliomas.Fig.2 A:It was the fused image of CT and MR of a 53-year-old female patient of a WHO Grade III glioma in the radiotherapy planning system; B:GTV,CTV,PTV and the optic radiation were outlined in the fusion image of CT and MR.The pink area represents GTV and the green area is expressed in CTV and the light blue area is for PTV.The dark blue and purple area are expressed as the affected and unaffected optic radiation,respectively.

图3 患者女,53岁,胶质瘤Ⅲ级。A:蓝色实线与虚线分别为3D-CRT计划和IMRT计划中患侧视辐射所受辐射的剂量曲线。黄色实线与虚线分别为3D-CRT计划和IMRT计划中健侧视辐射所受辐射的剂量曲线。B:粉色实线与虚线分别为3D-CRT计划和IMRT计划中患侧视束所受辐射的剂量曲线。紫色实线与虚线分别为3D-CRT计划和IMRT计划中健侧视束所受辐射的剂量曲线。图3中IMRT计划(虚线)患侧及健侧视束、视辐射所受剂量均低于3D-CRT(实线)Fig.3 It is a 53-year-old female patient of a WHO Grade III glioma.A:Blue solid line and dotted line are respectively represented the dose curves of 3D-CRT and IMRT plans in the affected side of the optic radiation,and the yellow solid line and dotted line are the dose curves of 3D-CRT and IMRT plans in the unaffected side of the optic radiation.B:Pink solid line and dotted line are respectively represented the dose curves of 3D-CRT and IMRT plans in the affected side of the optic tract,and the purple solid and dashed line are the dose curves of 3D-CRT and IMRT plans in the unaffected side of the optic tract.In fi gure 3,the dose of the optic tract and optic radiation in IMRT plan(dotted line)is lower than that in the 3D-CRT plan(solid line).
1.4 计划设计及评估
每名患者均由同一名高年资物理师在Pinnacle 3放疗计划系统下分别采用3D-CRT技术及IMRT技术制定两套放疗计划,制定计划中不提供视束、视辐射相关影像学信息。所有计划均采用6 MV X射线照射,处方剂量为:95% PTV达到60 Gy/2.0 Gy×30次。危及器官及限制剂量:脑干Dmax<54 Gy;晶体Dmax<9 Gy;视交叉Dmax<54 Gy;视神经Dmax<54 Gy。分别对每名患者的两套放疗计划的剂量体积直方图(DVH)(图3)、靶区适形度与剂量均匀性、等剂量曲线分布等进行评估。靶区适形度及剂量均匀性参数为:适形指数(conformity index,CI)、剂量均匀性指数(homogeneity index,HI)。视束、视辐射:分别比较两侧视束、视辐射在不同放疗计划中所受Dmax及Dmean,评估两种计划保护视束、视辐射的有效性。
1.5 统计学分析
采用SPSS 17.0软件进行数据处理,对3D-CRT和IMRT计划中PTV的CI、HI及两侧视束、视辐射所受Dmax及Dmean进行统计学分析。数据均采用±s表示,P<0.05认为有统计学差异。
2 结果
2.1 靶区适形度及剂量均匀性比较
采用IMRT技术的放疗方案的靶区适形度(CI)优于采用3D-CRT技术的放疗方案(P<0.05),而剂量均匀性(HI)差异无统计学意义(P>0.05),见表1。
2.2 视束、视辐射剂量对比
采用IMRT技术的放疗计划较采用3D-CRT技术的放疗计划的患侧、健侧的视束、视辐射的Dmax及Dmean均有不同程度减低(P<0.05),见表2。
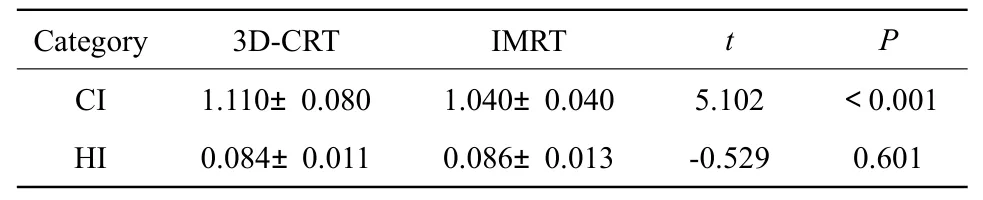
表1 靶区适形度及剂量均匀性比较Tab.1 Comparison between 3D-CRT and IMRT in dose uniformity and conformal degree of target volume

表2 视束、视辐射受照剂量比较Tab.2 Comparison of irradiation dose for optic tract and optic radiation
3 讨论
目前脑胶质瘤的常规放射剂量已经提高至60 Gy,高剂量照射在提高治疗效果的同时,也易引起放射性损伤[6]。所以,如何在保证靶区治疗剂量的前提下避免对靶区周围正常脑组织,尤其是邻近危及器官的过度照射,降低发生放射性损伤的风险已成为国内外努力研究的方向之一。近年来,3D-CRT、IMRT技术由于其既能够提高肿瘤靶区剂量又可最大限度地减少对靶区周围正常组织的辐射剂量,从而在脑胶质瘤术后放疗中得到广泛应用。
视觉通路是一个连续且完整的重要神经传导通路,视路走行较长,相关解剖结构复杂,视神经、视交叉、视束及视辐射其中任何一部分损伤,视觉通路传导都将会受到影响,甚至导致患者视力缺损。目前在胶质瘤患者术后放疗计划制定中,眼球、视神经、视交叉等前视路已被标记为常规危及器官进行保护。由于视束及视辐射等后视路在常规CT及常规MRI图像上难以显示,因此无法将视束、视辐射纳入危及器官在放疗计划中进行保护。
随着功能磁共振成像的不断发展,扩散张量成像可无创性显示活体脑白质纤维束的完整性和方向性及其脑肿瘤与邻近白质纤维束的解剖关系,包括直接压迫推移、浸润、中断破坏等异常表现[7-8]。在本课题组前期研究中,利用DTI技术在神经导航下术前精确定位视辐射走行,术中对其进行有效保护,降低术后致残率[9]。本研究通过DTI示踪视束、视辐射并将其融入到脑胶质瘤患者术后放疗计划中,对比不同的放疗方案,指导放疗优化方案的选择。
本研究结果表明3D-CRT与IMRT计划两者在剂量均匀性(HI)方面对比无统计学差异,但采用IMRT技术在靶区适形度(CI)方面要优于采用3D-CRT技术的放疗计划,这与国内外对比3D-CRT、IMRT两种技术的研究结果一致[10-12]。3D-CRT技术是将照射野同靶区形状在三维方向上的适形技术,而IMRT技术除此之外还能够使放疗剂量在三维方向上与靶区适形,与3D-CRT技术相比可以使放疗剂量梯度在靶区周围正常组织相对均匀、快速的降低,因此采用IMRT技术的放疗方案中两侧视束、视辐射的Dmax及Dmean比采用3D-CRT技术的放疗方案均有不同程度降低,降低了视束、视辐射发生放射性损伤的风险性。本组患者患侧视束的Dmax及Dmean分别降低了11.2%、10.4%,患侧视辐射的Dmax及Dmean分别降低了10.9%、8.9%;健侧视束的Dmax及Dmean分别降低了20.2%、21.4%,健侧视束的Dmax及Dmean分别降低了22.3%、18.6%,以上数据显示健侧视束、视辐射的辐射剂量降低程度较大。分析认为,是由于为了保证放疗靶区的治疗剂量,邻近放疗靶区的患侧视束、视辐射剂量减低程度受到限制,而健侧视束、视辐射与肿瘤靶区距离相对较远,剂量限制条件较少。
本研究亦存在一些不足之处:本组患者仅仅是将DTI示踪视束、视辐射融入脑胶质瘤术后放疗,对两种常规放疗计划中视束、视辐射所受放射剂量进行比较,以指导放疗方案的选择。在已经将视束、视辐射引入放疗计划的前提下,能否将视束、视辐射纳为危及器官进行剂量限制,进一步探究保护视束、视辐射的可行性及其评价后期疗效,均有待相关课题开展后续研究。
DTI技术能够准确示踪视束、视辐射,为脑胶质瘤术后放疗计划制定提供纤维束影像学信息,进而指导放疗方案的选择,减低视束、视辐射所受放射剂量,降低其后期发生放射性神经损伤的风险。
[References]
[1]Guan XY,Zhu GP,Feng Y,et al.Advances in the study of radiationinduced ocular injury.Chin J Radiat Oncol,2010,19(1):81-83.管西寅,朱国培,冯炎,等.放疗引起眼损伤的研究进展.中华放射肿瘤学杂志,2010,19(1):81-83.
[2]Bello L,Gambini A,Castellano A,et al.Motor and language DTI fi ber tracking combined with intraoperative subcortical mapping for surgical removal of gliomas.Neuroimage,2008,39(1):369-382.
[3]Bai XD,Sun XL,Wang D,et al.Differentiation between recurrent gliomas and radiation-induced brain injuries using DCE-MRI.Chin J Magn Reson Imaging,2014,5(1):1-6.白雪冬,孙夕林,王丹,等.动态对比增强MRI在鉴别胶质瘤复发及放射性脑损伤中的应用.磁共振成像,2014,5(1):1-6.
[4]Andrade-Souza YM,Zadeh G,Scora D,et al.Radiosurgery for basal ganglia,internal capsule,and thalamus arteriovenous malformation:Clinical outcome.Neurosurgery,2005,56(1):56-63.
[5]Jenghwa C,Ashwatha N.Functional MRI for Radiotherapy of Gliomas.Technology in Cancer Research and Treatment,2010,9(4):347-358.
[6]Dai YW,Wang ZG,Qin JZ,et al.Progress of treatment for glioma,Chin J Clinicians(electronic edition),2013,7(14):6225-6228.戴宜武,王振光,秦家振,等.脑胶质瘤治疗进展.中华临床医师杂志(电子版),2013,7(14):6225-6228.
[7]Li WG,Zhang YT.Combination of fMRI and diffusion tensor imaging in research of brain tumors.Int J Med Radiol,2009,32(3):226-228.李文贵,张云亭.fMRI和DTI在脑肿瘤中的联合应用研究.国际医学放射学杂志,2009,32(3):226-228.
[8]Shen XD,Shen GQ,Gao B.Research progress of diffusion tensor imaging in gliomas invasion.Chin J Magn Reson Imaging,2015,6(3):221-224.申旭东,沈桂权,高波.脑胶质瘤浸润程度的扩散张量成像研究进展.磁共振成像,2015,6(3):221-224.
[9]Sun SY,Ma H,Wang XD,et al.Application of BOLD-fMRI and DTI on the treatment of lesions in or surrounding the occipital visual function area undergoing the neuronavigation.Chin J Neurosurg,2011,27(9):925-928.孙胜玉,马辉,王晓东,等.BOLD-fMRI和DTI结合神经导航在枕叶视觉功能区附近病变切除中的应用.中华神经外科杂志,2011,27(9):925-928.
[10]Lawrence B Marks,Jin Li Ma,et al.Challenges in the clinical application of advanced technologies to reduce radiation-associated normal tissue injury.Int.J.Radiation Oncology Biol.Phys,2007,69(1):4-12.
[11]Lu J,Wu ZX,Zhang GF,et al.Dosimetric comparison of threedimensional conformal and intensity modulated radiotherapy in brain glioma.Chin J Radiol Med Prot,2009,29(5):499-501.卢洁,吴朝霞,张桂芳,等.脑胶质瘤三维适形放射治疗与调强放射治疗的剂量学比较.中华放射医学与防护杂志,2009,29(5):499-501.
[12]Shen Q,Ma X,Hu W,et al.Intensity-modulated radiotherapy versus three-dimensional conformal radiotherapy for stage I-II natural killer/T-cell lymphoma nasal type:dosimetric and clinical results.Radiat Oncol,2013,25(8):152.
