海藻糖对过氧化氢诱导M14黑素瘤细胞氧化损伤的保护作用
2015-12-13王宝玺煦李诚让
张 宇 王宝玺 姚 煦李诚让
·论著·
海藻糖对过氧化氢诱导M14黑素瘤细胞氧化损伤的保护作用
张 宇 王宝玺 姚 煦∗李诚让∗
目的: 确定海藻糖对过氧化氢诱导的M14黑素瘤细胞损伤的保护作用。方法: 不同浓度过氧化氢处理后的M14黑素瘤细胞加入0.5 μg/mL、1 μg/mL、10 μg/mL海藻糖,采用MTT法检测各组细胞存活率,嘌呤氧化酶法检测处理前后超氧化物歧化酶(SOD)的活性。结果: 浓度为1 μg/mL的海藻糖抗氧化作用明显,可提高低浓度过氧化氢(小于400 μmol/L)损伤后的M14黑素瘤细胞存活率约33%,可提高SOD活力约20%。当过氧化氢浓度大于400 μmol/L时,各浓度海藻糖对提高细胞存活率无明显作用。结论: 1 μg/mL海藻糖对低浓度(小于400 μmol/L)过氧化氢诱导的M14黑素瘤细胞损伤具有保护作用。
过氧化氢; 黑色瘤细胞; 氧化应激; 海藻糖
白癜风是常见的色素脱失性皮肤病,发病率约占世界人口总数的1%。1其发病机制包括自身免疫损伤、黑素细胞自身破坏和神经源学说等。黑素细胞自身破坏学说2,3指出,黑素细胞合成黑素时产生醌类和酚类中间产物,有些中间产物不稳定可形成活性氧簇(reactive oxygen species,ROS),这些中间产物和ROS对黑素细胞有毒性作用,称之为毒性黑素前体。事实上,人体细胞在新陈代谢供能的过程中细胞内持续产生ROS,ROS是一类性质十分活泼的化学集团,主要包括超氧自由基、羟自由基、氢过氧化物自由基、过氧化氢和单线态氧。其中超氧化物歧化酶(SOD)是细胞产生氧化损伤的主要指标,过氧化氢酶(catalase,CAT)是清除过氧化氢的主要酶之一。如清除酶减少或缺陷ROS将攻击蛋白质、核酸,引起这些大分子物质结构和功能的改变。同时,ROS可作用于多种不饱和脂肪酸,以链式和链式支链反应的形式生成脂氢过氧化物,进而生成丙二醛(malonaldehyde,MDA)破坏细胞生物膜的结构和功能。4外界环境中的紫外线、外伤、空气污染、农药、吸烟等都有产生氧化应激加剧对生物大分子的破坏,导致白癜风的发生。
建立成功可靠的氧化应激模型,对于部分揭示白癜风发病机制以及研究和筛选抗氧化药物都有重要意义。过氧化氢是一种重要的活性氧,极易透过细胞膜,与细胞内铁离子通过Fenton反应形成高活性的自由基,导致一系列反应,其易于获得,性质相对稳定,所以它已成为研究细胞氧化损伤的重要工具。5本研究以黑素瘤M14细胞为基础,以过氧化氢应激诱导剂构建体外氧化应激细胞模型。初步用MTT法检测
细胞活力,并检测SOD以摸索过氧化氢的最佳作用浓度,构建体外氧化应激细胞模型,为后续研究筛选抗氧化剂的生物芯片实验提供参考。
1 材料与方法
1.1 材料、试剂与仪器 M14(黑素瘤细胞)(购自凯基公司,货号:KG059)。青霉素、链霉素、胰蛋白酶、1640培养基、H2O2、DMSO、海藻糖 (购自祥研生物技术中心);胎牛血清 (购自杭州四季青);测定与分析用水均为超纯水。CO2培养箱(Thremo,美国,型号BBD 6220);洁净工作台(Thermo,美国,型号BBSSSC);高性能冷冻离心机(Thermo,美国,型号MR23i);倒置显微镜(OLYMPUS,日本,型号IX71);酶标仪(全光波段)(TECAN,瑞士,型号Safire2);超声波细胞破碎(比朗,中国,型号BILON92-11DL)。
1.2 方法
1.2.1 黑素瘤细胞(M14)培养 将M14细胞接种在1640培养基(含10%FBS、100 U/mL青霉素、100 μg/ mL链霉素、2 mmol/L L-谷氨酰胺,PH 7.2)中。37℃、5%CO2温育。细胞为多角形贴壁生长细胞,约2~3天传代1次,按5×105个/mL密度,96孔板中每孔接种50 μL,待细胞进入对数生长期(细胞数量较多,贴壁完好)继续实验。
1.2.2 实验分组及药物处理 调零孔:1640培养基200 μL;PBS毒性孔:进入对数生长期的细胞,PBS 200 μL;H2O2处理组:加入对数生长期细胞H2O2使终浓度为800 μmol/L,400 μmol/L,200 μmol/L,100 μmol/L;海藻糖毒性组:PBS配制海藻糖溶液,终浓度为0.5 μg/mL,1 μg/mL,10 μg/mL。
加入海藻糖保护剂组:对数生长期细胞分别加入H2O2100 μL和海藻糖100 μL,H2O2终浓度为400 μmol/L,200 μmol/L,100 μmol/L及海藻糖终浓度为0.5 μg/mL,1 μg/mL,10 μg/mL。
1.2.3 细胞形态观察 黑素瘤细胞(M14)形态通过倒置荧光显微镜10X目镜、20X物镜(Nikon Eclipse Ti-U,尼康公司)观察并拍照。
1.2.4 噻唑蓝(MTT)法检测细胞存活率6取对数生长期M14黑素瘤细胞,以按5×105个/mL密度,96孔板中每孔接种 50 μL,共设 10组,每组3个孔,于37℃、5%CO2培养24 h,细胞融合至90%,贴壁完好,分别检测H2O2、海藻糖对M14黑素瘤细胞存活率影响加入各浓度H2O2、海藻糖100 μL。保护组加入H2O2、海藻糖各100 μL作用60 min,然后每孔加入10 μL,5 g/L的MTT,温育4 h,去除培养液及MTT,小心吸取上清,每孔加入150 μL DMSO,用酶标仪测定各孔在波长570 nm处的吸光度。
1.2.5 SOD活力测定 取H2O2、H2O2和海藻糖作用的M14黑素瘤细胞,制成细胞悬液,将细胞悬液置于冰水条件下,超声破碎,功率130 w,3~5 s/次,间隔30 s,重复5~7次,取200 μL,破碎好的匀浆液进行测定。参照南京建成生物工程研究所提供的相应试剂盒说明书测定细胞内SOD活力。SOD活力单位定义为每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD酶活力为一个酶活力单位(U);蛋白质定量采用考马斯亮蓝比色法测定。
1.2.6 统计学方法 采用SPSS 19.0统计软件对数据进行单因素方差分析,两组间的数据比较采用t检验。实验数据用¯x±s表示,P<0.05表示有显著性差异,P<0.01表示有极显著性差异。
2 结果与分析
2.1 细胞形态观察结果 不同浓度的H2O2作用于M14黑素瘤细胞60 min后,低浓度(100 μmol/L) H2O2作用M14黑素瘤细胞后形态与正常对照比较无差异。高浓度(大于400 μmol/L)H2O2作用后的M14黑素瘤细胞数量减少,呈大细胞,小细胞,细胞两级延长不规则形态,出现空泡变性,并丧失贴壁功能。
2.2 过氧化氢呈浓度依赖性损伤M14黑素瘤细胞及抑制M14黑素瘤细胞活性,1 μg/mL海藻糖有效抑制过氧化氢对M14细胞损伤及活力影响 使用MTT法检测不同浓度的H2O2对M14黑素瘤细胞存活率和细胞活性的影响,发现作用于M14黑素瘤细胞60 min后,各浓度H2O2作用细胞存活率与正常对照组相比均降低(P<0.01)。但随着H2O2浓度升高细胞存活率逐渐降低,当大于400 μmol/L后M14细胞存活率及活性变化无差异(P>0.05),见图1。不同浓度的海藻糖作用于M14细胞60 min后,与正常对照组相比对细胞存活率及活力无影响,见图2。
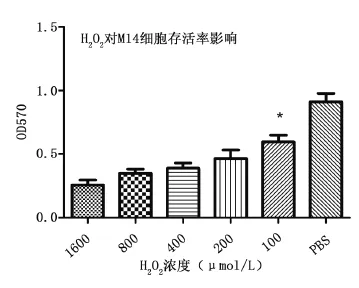
图1 MTT法检测显示过氧化氢呈浓度依赖性损伤M14黑素瘤细胞且呈浓度依赖性抑制M14黑素瘤细胞活性,与PBS组比较有差异(∗P<0.01)
1 μg/mL海藻糖加入H2O2处理组同时作用60 min,可抵抗过氧化氢对细胞损伤并提高细胞活性,见
图3。当过氧化氢浓度高于400 μmol/L时,海藻糖抵抗过氧化氢引起细胞损伤及活力影响的保护作用降低。当选用10 μg/mL海藻糖加入H2O2处理组时保护作用不明显。
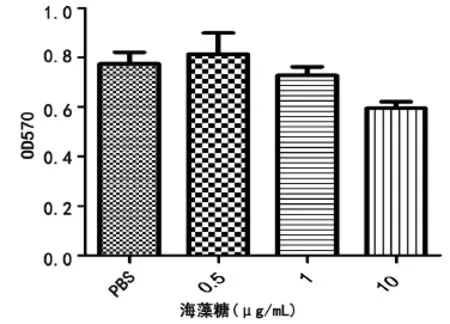
图2 MTT法检测显示各浓度海藻糖对M14细胞存活率及活性的影响与PBS组比较无差异(P>0.05)
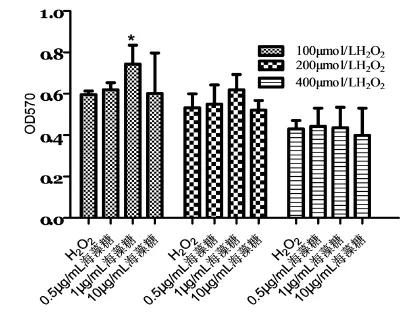
图3 海藻糖对H2O2引起M14黑素瘤细胞凋亡的保护作用
2.3 过氧化氢对黑素瘤细胞(M14)SOD活性影响及加入海藻糖防护后SOD活性变化 不同浓度的H2O2作用于M14黑素瘤细胞1 h后,与正常对照组相比,100 μmol/L H2O2处理对SOD活力无明显影响(P=0.095),未对黑素瘤细胞产生较大的氧化损伤。当逐渐提高过氧化氢浓度,与正常对照比较100 μmol/L H2O2处理组SOD活力明显降低,400 μmol/L H2O2对SOD活力的影响较大(∗∗P<0.01),见图4。当1 μg/mL海藻糖加入H2O2,处理组时可提高被过氧化氢抑制的SOD活力(P<0.01),对过氧化氢引起的黑素瘤细胞氧化损伤有保护作用,见图5。
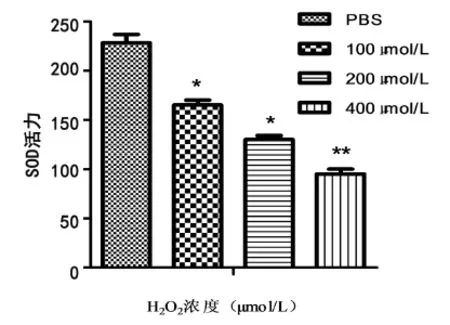
图4 与正常对照组相比100 μmol/L过氧化氢处理组SOD活力明显降低(∗P<0.05),400 μmol/L H2O2对SOD活力的影响较大(∗∗P<0.01)

图5 当1 μg/mL海藻糖加入100 μmol/L H2O2处理组时可提高被过氧化氢抑制的SOD活力(∗P<0.05),对过氧化氢引起的黑素瘤细胞氧化损伤有保护作用(100 μmol/L H2O2,P=0.01),当H2O2处理组达到400 μmol/L时,海藻糖仍可提高SOD活力(400 μmol/L H2O2,P=0.008)
3 讨论
皮肤是机体与外界环境接触的重要界面,经常暴露于各种物理、化学及生物性物质中。其中,许多物质或其代谢物可直接或间接地催化产生一系列活性氧化物,统称为ROS。常见的氧化物包括来自汽车及其他工业源的气态环境污染物、紫外线辐射、食物污染物/添加剂/防腐剂、护肤类产品、药物等。7ROS包括单线态氧、超氧阴离子、H2O2、羟自由基、一氧化氮等。迄今为止,已经有大量证据表明白癜风患者表皮内和血淋巴细胞和单核细胞内有微量过氧化氢的蓄积。正常情况下,皮肤ROS的产生与清除处于动态平衡之中,而白癜风中这一平衡被打破。在进展期白
癜风患者表皮内可检测到浓度范围为10-3M的H2O2蓄积,8远远高于生理浓度10-7M-10-6M。异常产生的H2O2的来源已部分明确,分为外源性和内源性。前者例如UVA/UVB照射,X-线照射,接触酚类、氢醌类制剂,后者包括表皮单胺氧化酶A、诱导型一氧化氮合酶及NADPH氧化酶活性升高,TNF-α水平增高,6-生物蝶呤和墨蝶呤的光氧化增强,6R-左-红-5,6,7,8,四氢生物蝶呤生物合成/再循环通路紊乱、雌激素/黄体激素介导的H2O2产生等。同时,白癜风患者中抗氧化的CAT、硫氧还蛋白还原酶、谷胱甘肽过氧化物酶表达/活性降低。ROS的生成大于清除,导致氧化应激。
诸多研究显示白癜风中的氧化-抗氧化格局发生了改变,Agrawal等9报道患者外周血红细胞中SOD活性剂脂质过氧化水平显著升高,GSH浓度及谷胱甘肽过氧化物酶活性显著降低,红细胞中CAT活性及血浆维生素E浓度无明显差异。Koca等4报道患者血浆丙二醇浓度及黄嘌呤氧化酶活性显著增高。也有研究报道红细胞中谷胱甘肽过氧化物酶活性显著升高以及CAT活性显著降低。在组织水平,患者表皮SOD、丙二醇、谷胱甘肽过氧化物酶的表达量明显升高,而一氧化氮水平无明显差异。文献报道,10白癜风皮损区 MSRA的表达/活性显著降低,10-3M的H2O2可使重组MSRA,MSRB的活性分别下降85%,40%。同时,周舟等11研究表明,MSRA表达水平下降会导致黑素细胞对氧化应激的敏感性增高,同时MSRA表达水平下降及失活不利于黑素细胞功能及生存。H2O2介导的氧化应激不仅显著降低白癜风患者中的MSRA表达水平,而且MSRA自身也因H2O2氧化而失活。Giovannelli等12-18发现白癜风患者外周单个核细胞DNA链断裂及DNA碱基被氧化的水平显著高于对照组。
脂质过氧化作用不仅把活性氧转化成活性化学剂,而且通过链式或链式支链反应,放大活性氧的作用。因此,初始的一个活性氧能导致很多脂类分解产物的形成,这些分解产物部分能引起细胞代谢及功能障碍,甚至死亡。氧自由基不但通过生物膜中多不饱和脂肪酸的过氧化引起细胞损伤,而且还能通过脂氢过氧化物的分解产物引起细胞损伤。学者推测,白癜风中存在着一个恶性循环,H2O2使抗氧化酶失活,一方面导致清除ROS的能力下降,另一方面紊乱的黑素合成/代谢通路及6BH4再循环通路会异常产生更多的H2O2。
皮肤的抗氧化防御系统随着有氧代谢共同发展以拮抗ROS的不利影响。这些抗氧化分子包括氧化酶,如SOD、CAT、谷胱甘肽过氧化物酶、谷胱甘肽还原酶、谷胱甘肽-S-转移酶、硫氧还蛋白/硫氧还蛋白还原酶、醌还原酶。还包括一些小分子物质,如维生素C、维生素E、GSH、硫醇、氨基酸中的甲硫氨酸和色氨酸,6、7-四氢生物蝶呤、类脂酸以及非金属的硒。4SOD作为唯一的以自由基为底物的酶,可将单线态氧歧化为H2O2,CAT可将H2O2分解为水和氧。可作为细胞氧化损伤的标志,SOD活性增强,是由于机体内氧自由基增多,SOD活性代偿性升高。而丙二醛(MDA)的量常常反映机体内脂质过氧化的程度,间接地反映出细胞损伤的程度。MDA的测定常常与SOD的测定相互配合,SOD活力的高低间接反应了机体清除氧自由基的能力,而MDA的高低又间接反应了机体细胞受自由基攻击的严重程度。基于以上发现,通过清除表皮H2O2而实现色素恢复是治疗白癜风的途径之一。海藻糖是在酵母中发现的二糖,海藻糖对生物体具有神奇的保护作用,在高温、高寒、高渗透压及干燥失水等恶劣环境条件下在酵母细胞表面能形成独特的保护膜,有效地保护蛋白质分子不变性失活,从而维持生命体的生命过程和生物特征。海藻糖应用于保湿类化妆品及食品防腐剂具有抗氧化作用。
本实验拟在体外构建黑素瘤细胞(M14)氧化应激细胞模型,该模型在100 μmol/L至400 μmol/L浓度的过氧化氢诱导下,细胞功能改变,但是这种损伤不会造成细胞死亡,而且在适宜的抗氧化剂的作用下,这些损伤还有可能被修复,但高浓度过氧化氢长时间作用细胞就可触发细胞器质性损害和不可逆损伤。既往实验证实基因产生表达变化间隔时间为4 h,18同时考虑到长时间的氧化作用会对细胞造成不可逆损伤甚至死亡,19因此本实验选择过氧化氢作用细胞的时间为60 min。本研究使用MTT法检测细胞存活率,MTT进入细胞后被线粒体脱氢酶还原生成蓝色formazan颗粒,经溶剂溶解后比色定量,其颜色深浅直接与活细胞数有关,从而确定其存活率。同时本实验根据细胞代谢活动与活细胞数直接成比例的原理,通过测定M14黑素瘤细胞代谢活性的减少来衡量H2O2作用M14细胞引起氧化应激损伤的程度。从实验结果可见,不同浓度的H2O2作用于M14黑素瘤细胞60 min后,各浓度H2O2作用细胞存活率与正常对照组相比均降低。随着H2O2浓度升高,细胞存活率逐渐降低。而加入保护剂组,即同时加入1 μg/mL海藻糖和H2O2作用M14细胞60 min,细胞存活率及活性与H2O2单独处理组相比有升高。但是海藻糖对高浓度H2O2处理损害细胞已无保护作用。低浓度H2O2对M14黑素瘤细胞的活性有影响,如细胞内DNA,脂质和蛋白质会有变化,但是这种损伤不会造成细胞死亡,加入膜保护剂后细胞活性恢复,因此根据实验结果过氧化氢的最佳作用浓度范围为100
μmol/L至 400 μmol/L。如果高浓度 H2O2使细胞DNA产生不可逆性损伤,因海藻糖不能使受损DNA恢复,此时对细胞的保护作用有限。
本实验结果表明,过氧化氢作用M14黑素瘤细胞后引起可逆性损害的浓度为100 μmol/L至400 μmol/L,作用时间为60 min,可以成功构建过氧化氢诱导M14细胞体外氧化应激模型。并摸索出膜保护剂海藻糖浓度为1 μg/mL时可提高过氧化氢损伤细胞的存活率。本模型具备操作简便、模拟性和可控性,为进一步揭示氧化应激机制以及研究和筛选抗氧化药物奠定了实验基础。
1 Whitton ME,Ashcroft DM,Gonzalez U.Therapeutic interventions for vitiligo.J Am Acad Dermatol,2008,59(4):713-717.
2 Schallreuter KU,Elwary S.Hydrogen peroxide regulates the cholinergic signal in a concentration dependent manner.Life Sci,2007,80(24-25):2221-2226.
3 Spencer JD,Gibbons NC,Rokos H,et al.Oxidative stress via hydrogen peroxide affects proopiomelanocortin peptides directly in the epidermis of patients with vitiligo.J Invest Dermatol,2007,127(2):411-420.
4 Koca R,Armutcu F,Altinyazar HC,et al.Oxidant-antioxidant enzymes and lipid peroxidation in generalized vitiligo.Clin Exp Dermatol,2004,29(4):406-409.
5张斌.氧化应激模型的建立及其评价.中国临床康复,2006,10 (44):112-114.
6 Mooradian AD,Haas MJ,Wadud K,et al.Ascorbic acid and alpha-tocopherol down-regulate apolipoprotein A-I gene expression in HepG2 and Caco-2 cell lines.Metabolism,2006,55(2): 159-167.
7 Bickers DR,Athar M.Oxidative stress in the pathogenesis of skin disease.J Invest Dermatol,2006,126(12):2565-2575.
8 Schallreuter KU,Moor J,Wood JM,et al.In vivo and in vitro evidence for hydrogen peroxide(H2O2)accumulation in the epidermis of patients with vitiligo and its successful removal by a UVB-activated pseudocatalase.J Investig Dermatol Symp Proc, 1999,4(1):91-96.
9 Agrawal D,Shajil EM,Marfatia YS,et al.Study on the antioxidant status of vitiligo patients of different age groups in Baroda. Pigment Cell Res,2004,17(3):289-294.
10 Ines D,Sonia B,Riadh BM,et al.A comparative study of oxidant-antioxidant status in stable and active vitiligo patients. Arch Dermatol Res,2006,298(4):147-152.
11周舟,高天文.氧化应激与白癜风.中国美容医学,2009,18 (7):1037-1039.
12 Muzio L,Campisi G,Giovannelli L,et al.HPV DNA and survivin expression in epithelial oral carcinogenesis:a relationship?Oral Oncol,2004,40(7):736-741.
13 Giovannelli L,Bellandi S,Pitozzi V,et al.Increased oxidative DNA damage in mononuclear leukocytes in vitiligo.Mutat Res,2004,556(1-2):101-106.
14 Saran A,Spinola M,Pazzaqlia S,et al.Loss of tyrosinase activity confers increased skin tumor susceptibility in mice.Oncogene,2004,23(23):4130-4135.
15 Samson VF,Champagnat J,Giovannelli F,et al.Point target detection and subpixel position estimation in optical imagery. Appl Opt,2004,43(2):257-263.
16 Campisi G,Giovannelli L,Ammatuna P,et al.Proliferative verrucous vs conventional leukoplakia:no significantly increased risk of HPV infection.Oral Oncol,2004,40(8):835-840.
17 Street ME,de'Angelis G,Camacho-Hübner C,et al.Relationships between serum IGF-1,IGFBP-2,interleukin-1beta and interleukin-6 in inflammatory bowel disease.Horm Res,2004,61(4):159-164.
18 Weigel AL,Handa JT,Hjelmeland LM,et al.Microarray analysis of H2O2-,HNE-,or tBH-treated ARPE-19 cells.Free Radic Biol Med,2002,33(10):1419-1432.
19 Farombi EO,Moller P,Dragsted LO,et al.Ex-vivo and in vitro protective effects of kolaviron against oxygen-derived radical-induced DNA damage and oxidative stress in human lymphocytes and rat liver cells.Cell Biol Toxicol,2004,20(2):71-82.
(收稿:2014-07-01 修回:2014-10-08)
Protection of trehalose against damage of hydrogen peroxide to melanoma cell lines M14
ZHANG Yu,WANG Bao-xi,YAO Xu,et al.Institute of Dermatology,Peking Union Medical College and Chinese Academy of Medical Sciences,Nanjing,210042
Objective:To determine the protective effect of trehalose against the damage of hydrogen peroxide to the melanoma cell lines M14.Methods:Melanoma cell lines M14 induced by hydrogen peroxide were re-cultured by different concentrations of trehalose(0.5 μg/mL,1 μg/mL,10 μg/mL).The cell survival rate was detected by MTT.The activity of SOD was detected by xanthine oxidase technique.Results:The antioxidation of 1 μg/mL trehalose was obvious.1 μg/mL trehalose improved the survival rate and the activity of SOD of M14 cells induced by low-concentration(<400 μmol/L)hydrogen peroxide by 33%and 20%respectively.The survival rate of M14 cells induced by high-concentration(>400 μmol/L)hydrogen peroxide was not increased after re-cultured in different concentrations of trehalose.Conclusion:1 μg/mL trehalose is protective against the damage of low-concentration(<400 μmol/L)hydrogen peroxide to the melanoma cell lines M14.
H2O2;melanoma cells;oxidative stress;trehalose
中国医学科学院北京协和医学院皮肤病研究所,南京,210042
∗通信作者
