纳米ZnO吸附分离-氢化物原子荧光光谱法测定硒
2015-12-13李国涛定雅雪
李 阳,李国涛,定雅雪,黄 婷
(安康学院 化学化工系,陕西 安康 725000)
硒是生命中必需的微量元素,也是化工、冶金、环保及医药卫生等领域中的重要研究对象。测定硒的方法主要有比色法[1]、分光光度法[2-3]、石墨炉电感耦合等离子体发射光谱法[4]、原子吸收法[5-6]、高效液相色谱法[7-8]、氢化物-原子荧光光谱法[9-10],其中氢化物-原子荧光光谱法具有操作简单、干扰少、灵敏度高的特点。
当样品中硒元素含量低或化学组成较复杂时,在测定之前往往辅以化学分离/预富集手段,以富集待测元素和除去干扰基体。目前,分离富集环境样品中Se(IV)的方法有溶剂萃取法[11]、离子交换法[12]、共沉淀法[13]、吸附法[14-15]等,但这些方法大多具有环境污染大、操作过程繁琐、耗时长等缺点。吸附法具有操作简单、快速、吸附量大、无污染物等优点,已得到广泛应用。硒常用的吸附剂有交联壳聚糖、活性炭巯基棉、腐殖酸等,以上吸附剂性能稳定、操作简单、环境污染小、回收率高,但它们的吸附容量低,所需吸附平衡时间较长[16]。
纳米氧化锌由于粒径小,比表面积大,对许多金属离子具有较强的吸附能力和较大的吸附量,能在较短的时间内达到吸附平衡,是痕量分析较为理想的吸附剂[17-18]。同时纳米氧化锌能克服环境污染,但有操作繁琐、样品易污染损伤等缺点。本文采用纳米氧化锌作为吸附剂,试验了共存元素的影响,测定了环境水样中的痕量硒。
1 实验部分
1.1 仪器设备
AFS-8X双道原子荧光光度计(北京吉天仪器有限公司),用于测量Se4+的浓度;TDL80-2B台式离心机(上海安亭科学仪器厂),用于离心分离;pHS-3C型pH计(上海精密科学仪器有限公司),用于测量溶液pH值。
1.2 试剂
Se(IV)标准溶液配制(1.0000mg·mL-1):称取SeO2(北京纳克分析仪器有限公司)5.5480 g,加入少量水及2 mL浓HNO3,溶解后移入250 mL容量瓶中,用超纯水稀释至刻度,摇匀。
硼氢化钾、氢氧化钾(5 g·L-1)、铁氰化钾(10 μg·L-1)均为分析纯;盐酸、硝酸、高氯酸均为优级纯,实验用水为超纯水。吸附剂纳米ZnO,粒径为50±10 nm,购于陕西中科纳米材料股份有限公司。
1.3 实验方法
1.3.1 仪器条件设置
AFS-8X双道原子荧光光度计仪器条件为:灯电流60 mA,负高压270 V,原子化器温度200℃,原子化器高度8.0 mm,载气流量400 mL·min-1,屏蔽气流量 1000 mL·min-1,读数时间 10.0 s,延迟时间1.0 s,进样方式为自动进样。
1.3.2 吸附-解吸
用一定浓度的HCl和NaOH调节硒标准溶液为吸附最佳pH值,加入100 mg纳米ZnO,摇匀,静置15 min,离心15 min(1500 rpm),移取上层清液(A);沉积物用三次蒸馏水洗涤干燥多次后,加入0.50 mol·L-1NaOH洗脱剂0.50 mL,静置10 min后,再加入定量水稀释后离心分离,取上层清液(B);用AFS-8X双道原子荧光光度计测量硒,计算溶液A和B中硒的含量和吸附率。吸附率(Ads.%)计算式[17]为:
式中的ρ0和ρ分别是Se(IV)的初始浓度和吸附平衡后的浓度,mg·L-1。
1.3.3 吸附容量的测定
使用1.3.2所述方法吸附不同初始浓度的Se(IV)标准溶液(由1.0000 mg·mL-1标准溶液稀释,初始浓度范围50~250 mg·L-1),按下式计算纳米ZnO对Se(IV)的静态吸附容量q[17]:
式中,q为纳米材料对Se(IV)离子的吸附容量,mg·g-1;ρ0和ρ分别是Se(IV)在水相中的初始浓度和吸附平衡时的浓度,mg·L-1;V为水相体积,mL;W为所加纳米ZnO的质量,g。
1.3.4 样品的处理
采集陕西安康汉江水,用纤维素滤膜(孔径0.45 μm)过滤,酸化为pH=2.0后储存。实验室的自来水采取同上的预处理过程。在进行吸附实验前将样品溶液调至pH 4,配制成一定浓度的待测溶液。
2 结果和讨论
2.1 透射电镜及其图像分析
纳米ZnO的透射电镜照片见图1。图像显示,氧化锌粒子为近球形颗粒,表面疏松,粒子之间分散均匀,无明显团聚现象,颗粒粒径为50±10 nm。
2.2 氢化物-原子荧光光谱法测定硒条件的选择
2.2.1 盐酸用量的选择
实验考察了盐酸用量对测定硒的影响,荧光值随着盐酸用量的增加而增加(见图2),当盐酸质量分数在3%~15%时,荧光值基本趋于稳定且有较高的荧光值。盐酸用量过高会对仪器管路造成损坏。因此,采用质量分数为3%的盐酸作为载流液。
2.2.2 硼氢化钾用量的选择
实验考察了KBH4用量对荧光强度的影响,结果见图3。荧光值随着KBH4用量的增大而增大,但当KBH4的用量过高时,荧光值反而降低,这是因为产生的氢气量太大而稀释硒原子蒸汽造成的。因此,KBH4的最佳质量浓度为10 g·L-1。
2.3 酸度对纳米ZnO吸附硒的影响
实验考察了不同酸度条件下,纳米ZnO对Se(IV)的吸附率的影响,结果见图4。
图4显示,pH值在4.0~8.0范围内,纳米ZnO对Se(IV)的吸附效果较好,吸附率达到93%;当pH>8时,纳米ZnO对Se(IV)的吸附能力下降。这是由于Se(IV)离子在溶液中的存在形态受溶液的pH影响,与H2SeO3的酸式解离常数Ka有关,Se(IV)离子在水溶液中的存在形态有H2SeO3、HSeO3-和 S。pH值在3.5~9时,HSeO3-占主导;pH<3.5时,主要是以H2SeO3形态存在;而在pH>9时,S占主导[19]。同时,纳米ZnO为两性氧化物,其等电点(IEP)为8.0~8.5。当溶液pHIEP=8.0时,纳米ZnO表面带正电荷,Se(IV)主要是以HSe形态存在,有利于Se(IV)的吸附。随着溶液pH>pHIEP,纳米ZnO表面带负电荷,Se(IV)是以SeO32-主要形态存在的,不利于吸附[16]。所以,本实验选择pH4.0为吸附酸度,用于实验。
2.4 吸附等温线和吸附容量
实验考察了在温度0℃,60℃,80℃条件下纳米ZnO对Se(IV)的吸附等温线,结果见图5。符合Langmuir吸附方程[17]:
式中,qmax是饱和吸附量(mg·g-1),ρe是Se(IV)吸附平衡时的浓度(mg·L-1),qe是吸附平衡时的吸附量(mg·g-1),Kads为吸附平衡常数(mg·L-1)。以ρe/qe对ρe做直线可得qmax和Kads,见图6。Langmuir吸附模型常数的计算结果见表1。
从图5、图6和表1可看出,在3种温度下,热力学实验数据与Langmuir等温吸附模型有较好的拟合(R≥0.99)。0℃、60℃、80℃时,最大吸附量分别为 31.45 mg·g-1、31.75 mg·g-1、31.95 mg·g-1。
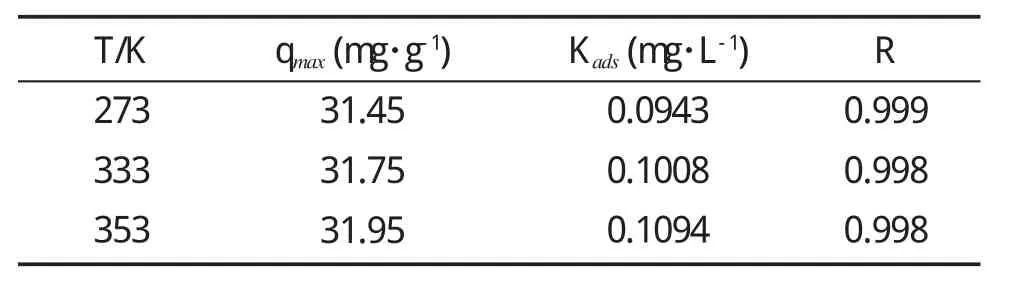
表1 Langmuir吸附等温线常数与相关系数Table 1 Langmuir isotherm constants and correlation coefficients
2.5 洗脱
由图3可知,随着溶液pH的升高,纳米ZnO材料表面上吸附的Se(IV)离子开始解吸。实验将吸附后的纳米ZnO用三次蒸馏水洗涤至中性,干燥后,加入定量NaOH为洗脱剂静置10 min,测量Se(IV)离子的回收率。结果发现,当用0.5 mL 0.5 mol·L-1NaOH溶液静置10 min洗脱时,Se(IV)离子的回收率达到96%,可将吸附的Se(IV)离子基本洗脱。本实验选择用0.5 mL 0.5 mol·L-1NaOH溶液静置10 min进行洗脱。
2.6 干扰实验
实验考察了一系列共存离子对硒分离富集的干扰情况。Cu2+、Bi+3、Ni+等离子对Se(IV)存在干扰,加入一定量的铁氰化钾作掩蔽剂可以消除这些离子的干扰,并且可以在原子化器内较好地生成硒化氢。实验结果表明,当铁氰化钾质量浓度为10μg·L-1时,可以消除干扰,并且对原子荧光信号无影响。
2.7 工作曲线
配制质量浓度梯度的硒标准溶液(≤20μg·L-1),用氢化物-原子荧光光谱法测定以上硒标准溶液,得到标准曲线回归方程为IF=82.778CSe+9.04,线性范围为0.1~20μg·L-1,相关系数R2=0.9997。
2.8 样品分析
采集汉江水与实验室自来水为样品,用纤维素滤膜(孔径0.45μm)过滤,将一定浓度的硒标准液加入到水样品中,调至pH为4.0备用。按照1.3.2所述方法进行吸附洗脱实验,平行做7次,结果如表2所示。结果表明,测定值与加入值基本一致,结果令人满意。
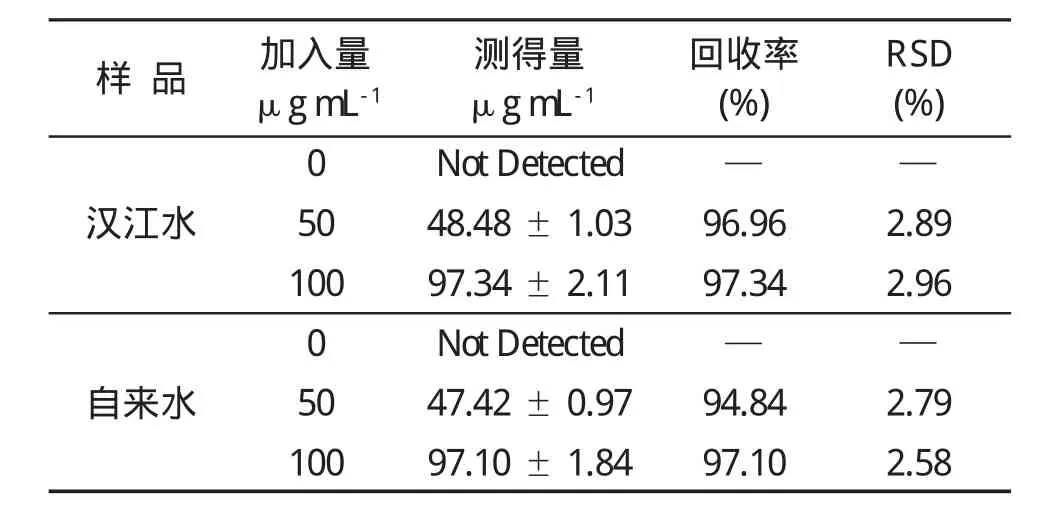
表2 水样品中Se(IV)离子含量的测定(n=7)Table 2 The determination of Se(IV)in water samples(n=7)
2.9 检出限和精密度
该方法的检出限为0.05μg·L-1,回收率为94%~106%,相对标准偏差(RSD%)为4.24%,n=11。
3 结论
采用纳米ZnO分离富集水相体系中的痕量硒,研究了氢化物-原子荧光光谱法测定硒的条件。结果表明,在pH4.0条件下,利用纳米ZnO作为吸附剂,可以快速、定量地分离富集硒,且具有吸附容量大、易于洗脱、操作简单、选择性高、回收率高等特点。此方法可应用于实际水样中痕量硒的分离、富集和测定。
