胃镜联合二维超声在进展期胃癌术前分期中的应用探讨
2015-12-13王海燕付宪伟
王海燕,贵 蕾,付宪伟
(1.山东省茌平县第三人民医院;2.山东省茌平县中医院,山东 茌平 252100)
胃黏膜活检及病理检查是明确胃癌诊断的最直接、最可靠方法,也是临床上最常用的检查和确诊方法。近年来,B超、CT等诸多的影像学检查方法广泛用于胃癌的术前诊断及分期,用于指导临床治疗。但CT检查术前分期在基层医院的应用仍有一定程度限制。本文综合了我院消化科、普外科2007年1月—2010年12月期间收治的进展期胃癌126例,分析胃镜联合B超检查诊断进展期胃癌的准确性及诊断符合率,探讨二者联合检查在进展期胃癌诊断及临床分期中的应用价值。
1 资料与方法
1.1 一般资料 本组126例胃癌患者中,男性81例,女性45例,年龄34~76岁,平均年龄(58.4±11.8)岁。所有经治患者的临床表现主要为上腹部隐痛不适,伴有上腹饱胀感、食欲减退、反酸、恶心呕吐,部分患者有黑便、消瘦及恶液质等表现。多数患者无明显体征,可伴有上腹部轻度压痛、贫血、腹部包块、恶性腹腔积液以及浅表淋巴结肿大等。癌胚抗原 (CEA)、糖类抗原19-9(CA19-9)、糖类抗原724(CA724)等肿瘤标记物均有不同程度升高。所有患者在治疗前均需常规检查血常规、肝肾功能、电解质、胸部X线、心电图及超声心动图。
1.2 检查方法 (1)胃镜检查:本研究采用PENTAX-EPK 1000电子胃镜系统,清晰度较高、分辨率强,能够直观的帮助检查者确定病灶的部位和形态。检查前空腹6 h以上,向患者介绍检查中的注意事项,解除患者的顾虑,在检查过程中配合,并指导患者口服利多卡因凝胶。检查过程中,患者采取左侧卧位,双腿微曲。按照食道、胃、十二指肠的先后顺序对黏膜进行系统检查,在胃黏膜异常部位的边缘及中央区取活检组织4~6块,即放入10%的福尔马林溶液中固定,及时送病理检查。对病理结果证实为胃癌或病理未证实但内镜临床诊断为胃恶性肿瘤并拟行外科手术治疗的患者再行B超检查,目的了解胃部病变侵犯范围。(2)超声检查:采用Toshiba SSA B型超声波诊断仪,探头频率为3.5 MHz,检查前12 h禁食禁水,检查初始阶段,首先嘱患者取仰卧位,平静呼吸,先常规进行肝、胆囊、胆道系统、胰腺、脾脏等实质性器官的全面细致检查,然后观察胃的形态、位置、胃腔内有无潴留、胃壁有无异常增厚、是否存在明显肿块以及与周边脏器和结构的关系等,随时记录检查过程中的异常发现;然后准备胃B超快速显像剂10 mL加温开水500 mL,一次顿服,1 min即可排除胃部气泡,消除黏液,使五层胃壁清晰,以清楚显示胃各部不同病变,获得分辨力高的稳定图像。
应实时监测液体自食管下端进入胃腔的全过程,超声探头在中上腹部胃投影区不同方向分别进行纵向、横向、斜向扫查,使胃壁的五层结构从贲门至幽门能够完全显示清楚。此外在扫查过程中,要仔细观察胃的形态、位置、胃壁结构层次、胃腔充盈、胃壁伸展及蠕动等声像图情况,如发现胃壁增厚或者胃壁肿块者即行记录。再嘱患者平卧位,并观察病变部位与周围临近组织、器官的关系,检查胃壁周围、胰头部、腹腔动脉及腹主动脉旁有无肿大淋巴结等情况以及与周围血管的关系,对发现有淋巴结肿大的患者,应记录淋巴结大小。
1.3 TNM分期标准 胃癌TNM分期参照美国癌症联合委员会(AJCC)2010年第7版分期标准。原发肿瘤(T):原发肿瘤无法评价(Tx);切除标本中未发现肿瘤(T0);原位癌(Tis);肿瘤侵犯黏膜固有层、黏膜肌层或黏膜下层(T1);肿瘤侵犯固有肌层(T2);肿瘤穿透浆膜下层结缔组织,未侵犯脏层腹膜或邻近结构(T3);肿瘤侵犯脏层腹膜(T4a);肿瘤侵犯邻近组织结构(T4b)。区域淋巴结(N):区域淋巴结无法评价(Nx);区域淋巴结无转移(N0);1~2个区域淋巴结有转移(N1);3~6个区域淋巴结有转移(N2);7个及7个以上区域淋巴结转移(N3)。远处转移(M):无远处转移(M0);存在远处转移(M1)。
1.4 统计学分析 统计软件SAS9.3版本进行统计学计算。观测资料主要为计数资料,两种诊断方法之间的比较,分别为卡方检验(一般计数资料)或秩和检验(等级资料)。显著性水准α=0.05。
2 结果
本组病例中经胃镜检查临床诊断为胃癌者124例,B超检查诊断为胃癌者114例,术后经病理确诊者126例,B超诊断符合率为90.5%,胃镜诊断符合率为98.4%(表1)。
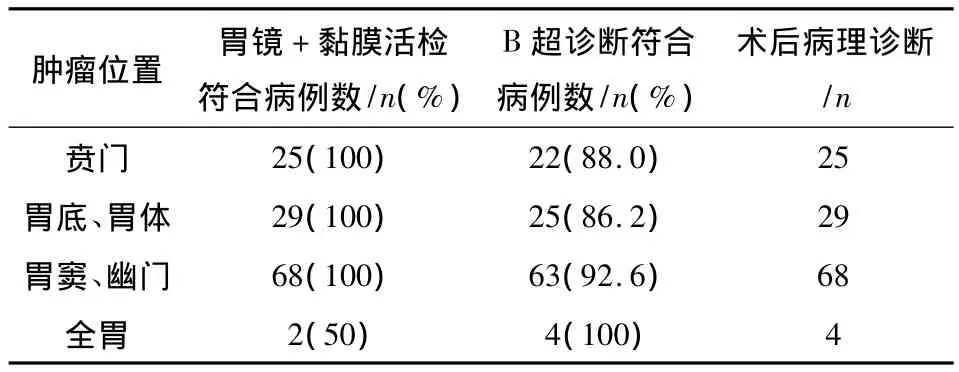
表1 胃镜/B超检查结果与术后诊断对照
进展期胃癌的B超声像图表现特征:主要表现为正常胃壁的结构层次不清晰,黏膜紊乱或者中断、胃壁局部增厚、胃腔局部性狭窄致扩张不充分,本组病例中有8例患者出现幽门梗阻情况;增厚的胃壁呈低回声。因此,B超检查可以帮助判断肿瘤浸润的深度以及与周围组织和脏器的关系,有助于判断淋巴结转移以及远处转移情况(表2),术前TNM分期判断的准确率可达71.4%(90/126)(表3)。
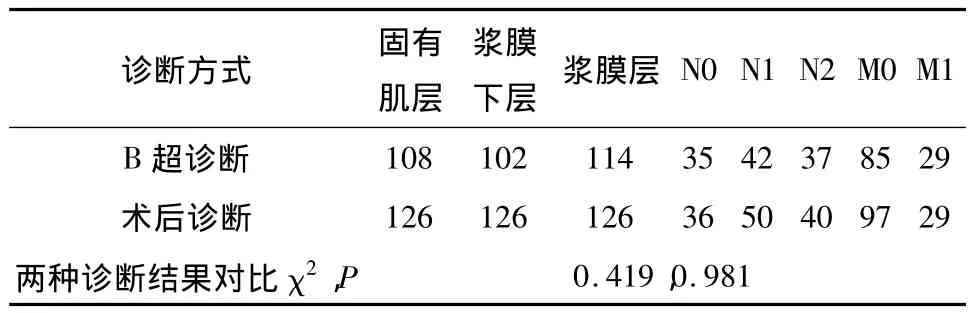
表2 B超对肿瘤浸润深度、淋巴结、远处转移诊断与术后诊断对比/n

表3 B超对TNM分期判断与术后诊断对比
3 讨论
胃癌是我国最常见的消化道恶性肿瘤之一,好发于胃窦部,其次是胃小弯部和贲门部,少数病例累及胃体。X线钡餐和电子纤维胃镜检查仍是目前临床诊断胃癌的主要手段。然而,由于X线钡餐造影对早期胃癌检出率较低,并且国内尚不能开展高危人群的胃镜普查,所以我国早期胃癌检出率较低,绝大多数患者诊断时病情已处于中晚期。胃镜检查的优点在于不仅可以直接观察病变的部位和形态,而且可以对可疑病变的部位进行病理活检及细胞学检查,定性诊断准确率高,是目前诊断上消化道病变的主要检查方法。但是,当胃癌尚未明显侵及胃黏膜层表面时,但靠胃镜往往不易检出病变,对部分有胃内隆起样改变者,也仅能作出初步可疑性诊断。
近年来,随着超声诊断技术的提高,B超对胃癌的检出率日趋增高,可以帮助临床判断肿瘤浸润的深度及范围,国外文献报道,B超对早期胃癌的诊断准确率可达90%[1-2]。
在B超检查过程中,可以清晰的显示正常胃壁的五层结构,并与组织解剖层次相对应,由内向外依次排列为黏膜层(强回声层)、黏膜肌层(弱回声层)、黏膜下层(强回声层)、肌层(弱回声层)、浆膜层(强回声层),正常胃黏膜各层层次清晰、连续性好、回声均匀,黏膜总厚度≤5 mm。当发生癌变时,根据发生病变的早晚不同,胃壁可表现为局限性增厚(早期)以及弥漫性增厚(进展期)。胃壁正常的五层结构回声出现不规则或结构消失,显现各种病理性回声。其主要的声像图改变有[2-6]:(1)黏膜层紊乱、中断:由于病灶侵及胃腺体及其表面上皮结构造成肿瘤隆起区缺乏黏液层的覆盖,B超表现为该病变区的黏膜层断裂、中断;(2)弱回声隆起:如果病变位于黏膜层,声像图表现为向胃内或胃外隆起弱回声,表面凹凸不平,其隆起的厚度与范围大小决定于病变发展的程度,局部胃壁不均匀增厚;(3)胃壁的层次结构消失:随着疾病进展,晚期肿瘤向深部浸润可以侵犯黏膜下层、肌层及浆膜层,造成正常胃壁的5层结构完全消失,在正常胃黏膜及病变黏膜的移行区可见黏膜层至肌层呈不规律的局限性增厚;(4)胃壁周围淋巴结肿大:肿大的淋巴结在声像图上常表现为圆形、椭圆形低回声病变,大小约1~2 cm不等,胃小弯、肝左叶下方、腹主动脉周围及胰头周围往往是肿大淋巴结的好发部位;(5)假肾征:肿瘤沿着胃壁呈浸润性生长,使得胃壁增厚,主要见于部分胃腔较狭窄患者;(6)皮革胃的特殊声像图表现:胃壁多呈弥漫性增厚,黏膜表面回声增强,但无明显隆起和凹陷性改变。早期的病变可分辨胃壁的五层结构,但各层组织均增厚;中晚期五层结构消失,呈低回声改变。
依据B超声像图改变,本组患者中胃癌TNM分期的诊断符合率达71.4%,可以较准确的判断胃癌术前分期,避免了对一些局部病变分期较晚、不能手术切除的患者进行手术治疗,有助于指导临床治疗。在诊断皮革胃方面,由于皮革胃病变先累及胃黏膜下层,再沿胃壁四周呈弥漫性生长,而胃黏膜的病变往往不明显,胃镜下活检仅能获得黏膜表面组织,对黏膜下恶性病变而难以作出组织学确诊,这就增加了胃镜诊断皮革胃的难度,在检查过程中容易漏诊。
另外,胃镜和X线检查对肿瘤侵犯胃壁的范围、大小以及与胃外组织结构的关系无法了解。相比之下,B超检查则可清晰观察胃壁各层结构改变以及胃外组织结构的浸润和转移情况,弥补了胃镜检查在皮革胃诊断方面的不足,两者联合应用,能提高皮革胃患者的诊断率。国内报道胃镜诊断皮革胃的确诊率为 13.6% ~ 76%[7-8],本组胃镜检查确诊率为50%。本组资料显示,胃镜和B超联合应用诊断皮革胃的符合率达100%,高于单纯胃镜检查,这说明胃镜联合B超检查诊断皮革胃的符合率优于胃镜检查,可作为诊断皮革胃的理想的选择方法。但B超检查胃癌亦存在一定的局限性,本组病例中有12例患者B超检查漏诊,分析可能的原因包括图像干扰较多;需要依靠饮水或特配液体使胃腔保持充盈、胃壁伸展状态,有些部位可能因伸展不良造成误诊,胃底亦可能受胃内气体影响易漏诊,另外对较小的胃癌,如黏膜层的胃癌难以发现。
与普通B超检查相比,超声内镜检查(endoscopic ultrasonography,EUS)更能反映胃部病变与周围邻近组织、器官的关系,尤其是对胃癌T分期的优势更加明显[9-10]。但对操作者的技术要求较高,在基层医院开展有一定难度,而普通B超检查具有无创、经济、可重复检查等优点,尤其对年老体弱或不宜进行胃镜检查者,更宜选用B超检查;并且B超还可以追踪观察病变发展过程及对术后疗效进行评价。因此,笔者建议在基层医院,临床上发现的可疑黏膜下胃癌患者,应将B超列为首选和常规检查手段,以期提高对胃癌患者的早期诊断和早期治疗。
[1]Kim GH,Park do Y,Kida M,et al.Accuracy of high-frequency catheter-based endoscopic ultrasonography according to the indications for endoscopic treatment of early gastric cancer[J].J Gastroenterol Hepatol,2010,25(3):506 -511.
[2]Hallinan JT,Venkatesh SK.Gastric carcinoma:imaging diagnosis,staging and assessment of treatment response[J].Cancer Imaging,2013,13:212 -227.
[3]Tomizawa M,Shinozaki F,Hasegawa R,et al.Screening ultrasonography is useful for the diagnosis of gastric and colorectal cancer[J].Hepatogastroenterology,2013,60(123):517 - 521.
[4]Feng XY,Wang W,Luo GY,et al.Comparison of endoscopic ultrasonography and multislice spiral computed tomography for the preoperative staging of gastric cancer-results of a single institution study of 610 Chinese patients[J].PLoS One,2013,8(11):e78846.
[5]Li S,Huang P,Wang Z,et al.Preoperative T staging of advanced gastric cancer using double contrast-enhanced ultrasound[J].Ultraschall Med,2012,33(7):E218 - E224.
[6]Mehmedovic'A,Mesihovic'R,Saray A,et al.Gastric cancer staging:EUS and CT[J].Med Arh,2014,68(1):34 - 36.
[7]王雪委,顾康生.超声内镜对胃癌术前分期的临床意义[J].安徽医药,2013,17(7):1163 -1164.
[8]和红春,张 冰.超声内镜在肝胆胰外科的应用进展[J].中国内镜杂志,2004,10(1):47 -49,52.
[9]De Angelis C,Pellicano R,Manfrè SF,et al.Endoscopic ultrasound in the 2013 preoperative evaluation of gastric cancer[J].Minerva Gastroenterol Dietol,2013,59(1):1 -12.
[10]Cantisani V,Rubini A,Miniagio G.CEUS and strain elastography in gastric carcinoma[J].J Ultrasound,2013,16(3):123 - 125.
