麝香醒脑滴丸对脑缺血再灌注损伤的保护作用
2015-12-13尹艳艳王玉婵吴阳洋李维祖
胡 文,尹艳艳,王玉婵,吴阳洋,何 灿,李维祖
(安徽医科大学药理学教研室,安徽合肥 230032)
随着社会老龄化的加速,心脑血管疾病已经成为危害人群健康的主要原因,发病率呈逐年增高的趋势,尤以缺血性脑血管病最为常见[1]。目前,缺血性脑血管疾病具有患病率高、致残率高、病死率高、治疗费用高等特点[2],严重影响病人的健康和生活质量,给社会和家庭带来沉重负担。因此寻找治疗缺血性脑血管病的有效药物已经成为药理学科的重要课题。麝香醒脑滴丸(Shexiang Xingnao dropping pills,SXD)由传统中药精制而成,主要成分有麝香、川芎、冰片、水蛭、丹参等。研究表明,麝香、川芎、冰片具有醒脑开窍的功效,水蛭、丹参等具有活血化瘀抑制血栓形成的功能,因此它们对缺血性脑损伤具有保护作用[3-4]。本实验通过建立大鼠局灶性脑缺血(MCAO)再灌注模型,研究麝香醒脑滴丸对局脑缺血的保护作用及其机制。
1 材料与方法
1.1 实验动物 清洁级SD大鼠,雄性,268~310 g,购自安徽医科大学实验动物中心,动物许可证号:SCXK(皖)2011-002。大鼠自由进食、饮水,饲养3 d适应后进行实验。
1.2 药品与试剂 麝香醒脑滴丸(SXD),安徽省华方医药科技有限公司,批号:20120601。麝香心脑通胶囊(SXJ),吉林省辉南辉发制药股份有限公司,批号:20110901;红四氮唑(2,3,5-三苯基氯化四氮唑,TTC),中国医药(集团)上海化学试剂公司产品;水合三氯乙醛,天津市光复精细化工研究所产品;乳酸脱氢酶(LDH)测定试剂盒、丙二醛(MDA)测定试剂盒、超氧化物歧化酶(SOD)测定试剂盒和考马斯亮兰蛋白测定试剂盒,全部由南京建成生物工程研究所提供;直径0.235 mm鱼线,日本PATU公司产品。
1.3 实验仪器 FA1004型电子天平,上海天平仪器厂产品;GKC型可控硅恒温水浴锅,上海锦屏仪器仪表有限公司;SpectraMax 190型全波长酶标仪,美国MD公司;WG-2003台式干燥箱,惠阳南方电气实验设备厂;LG10-2.4A型超速离心机,北京医用离心机厂产品;LBY-NJ4血小板聚集仪,北京普利生仪器有限公司。
1.4 方法
1.4.1 分组及给药 取雄性SD大鼠,体重268~310 g,随机分成 6组:模型组、假手术组,SXD(0.21、0.42、0.84 g·kg-1)3 个剂量组和 SXJ(0.42 g·kg-1)组。用药组灌胃(ig)给药,模型组和假手术组ig给等容量蒸馏水7 d。第7天给药后1 h,采用线栓法阻塞大鼠大脑中动脉2 h建立MCAO再灌注模型,再灌注8 h时重复给药1次。
1.4.2 大鼠MCAO再灌注模型的建立 参照改进的Longa等[5]方法建立大鼠MCAO再灌注模型。术后出现Horner氏征视为造模成功。假手术组只暴露颈内外动脉分叉,无需闭塞大脑中动脉(MCA)。造模前后适宜温度常规饲养。
1.4.3 考察SXD对MCAO再灌注大鼠神经功能损伤评分的影响 大鼠MCAO后2 h即再灌注0 h,以及再灌注4、8、22 h时,按照Bederson的方法对大鼠的神经功能损伤进行评分[6]。
1.4.4 考察SXD对MCAO再灌注大鼠脑梗死百分比的影响 大鼠MCAO再灌注22 h,将大鼠麻醉后固定,腹主动脉取血后处死大鼠,快速断头取脑。将脑置于冰生理盐水中,除去小脑、嗅球和低位脑干,称取脑湿重。将脑组织在-20℃条件下冷冻10 min,取出后用手术刀片将脑组织切成5片。然后将脑片放入含有1%的TTC的磷酸缓冲溶液中,37℃避光30 min,达15 min时翻到另外一面。经染色后,脑组织梗死区显白色,正常区域显玫瑰红色,界限分明。分离梗死区和非梗死区脑组织,称重,计算梗死百分比。
1.4.5 考察SXD对MCAO再灌注大鼠血小板聚集率的影响 大鼠MCAO再灌注22 h后,麻醉后固定大鼠,腹主动脉取血,用3.8%枸椽酸钠溶液(1∶9)抗凝,低速离心机1 000 r·min-1离心10 min,所取上清液为富血小板血浆(PRP),余下部分3 000 r·min-1离心10 min,所取上清液为贫血小板血浆(PPP),用PPP调整PRP吸光度值在300~400之间。取PRP 290 μL,37℃孵育5 min,加入诱导剂二磷酸腺苷(ADP)溶液10 μL,利用比浊法测定5 min血小板最大聚集率。
1.4.6 考察SXD对MCAO再灌注大鼠脑含水量和脑指数的影响 大鼠断头后快速取脑,用电子天平称取脑组织标本湿重。按照公式:脑指数=脑湿重×100/体重计算脑指数。将脑组织放入恒温干燥箱(105℃)烤24 h以上,称取脑组织干重,按公式:脑含水量(%)=(湿重-干重)/湿重×100%计算脑含水量。
1.4.7 考察SXD对MCAO再灌注大鼠脑组织生化指标的影响 取一批大鼠,MCAO 2 h再灌注22 h后断头处死大鼠,快速取脑后将其置于冰台上切为两部分,一部分固定后做病理组织学检测。分离另外一部分脑皮质,加入冰NS后在冰浴条件下制成10%的脑组织匀浆,将匀浆在4℃下离心(3 500 r·min-1)15 min,分离上清液后用试剂盒测定SOD和LDH活性,MDA含量,考马斯亮蓝法测定蛋白含量。
1.4.8 考察SXD对MCAO再灌注大鼠脑组织形态学的影响 将脑组织放入10%甲醛溶液中固定。石蜡包埋、切片后作HE染色,主要对大脑皮质神经元部位进行病理组织学检查。
1.5 统计学分析 采用SPSS17.0软件进行统计学分析,观察资料均为计量资料,以(±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。大鼠神经功能评分为多时点重复测量资料,采用两因素重复测量方差分析,以P<0.05代表有统计学意义。
2 结果
2.1 SXD对MCAO再灌注大鼠神经功能损伤评分的影响 各组结果如表1所示,该资料为5组4个时点重复测量资料,经球形检验后,进行两因素重复测量方差分析。发现组间和时间点之间交互作用有统计学意义。再行精细比较,再灌(0,4 h)结果无统计学意义。再灌8 h后SXJ和SXD(0.42,0.84 g·kg-1)组对大鼠神经功能损伤有所减轻。再灌24 h后SXD(0.84 g·kg-1)组对神经功能损伤评分有所降低,具有统计学意义。
表1 SXD对MCAO再灌注大鼠神经功能损伤评分的影响(±s,n=8)
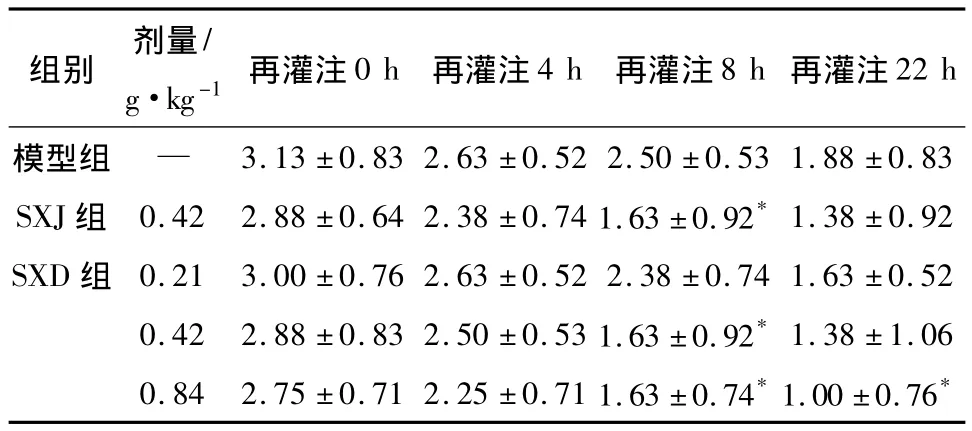
表1 SXD对MCAO再灌注大鼠神经功能损伤评分的影响(±s,n=8)
注:与模型组比较:*P <0.05。
组别 剂量/g·kg-1再灌注0 h 再灌注4 h 再灌注8 h再灌注22 h模型组 —3.13 ±0.83 2.63 ±0.52 2.50 ±0.53 1.88 ±0.83 SXJ组 0.42 2.88 ±0.64 2.38 ±0.74 1.63 ±0.92*1.38 ±0.92 SXD 组 0.21 3.00 ±0.76 2.63 ±0.52 2.38 ±0.74 1.63 ±0.52 0.42 2.88 ±0.83 2.50 ±0.53 1.63 ±0.92*1.38 ±1.06 0.84 2.75 ±0.71 2.25 ±0.71 1.63 ±0.74*1.00 ±0.76*
2.2 SXD对MCAO再灌注大鼠脑梗死百分比的影响 与模型组比较,SXD(0.42,0.84 g·kg-1)和阳性药SXJ能够减小MCAO再灌注22 h大鼠的脑梗死百分比。差异有统计学意义(P<0.05),结果见表2。
表2 SXD对MCAO再灌注大鼠脑梗死百分比的影响(±s,n=8)
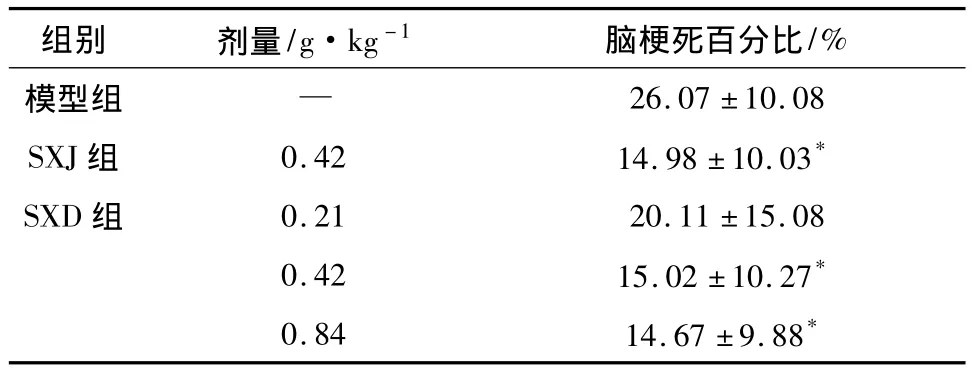
表2 SXD对MCAO再灌注大鼠脑梗死百分比的影响(±s,n=8)
注:与模型对照组比较:*P<0.05。
组别 剂量/g·kg-1 脑梗死百分比/%模型组 —26.07 ±10.08 SXJ组 0.42 14.98 ±10.03*SXD 组 0.21 20.11 ±15.08 0.42 15.02 ±10.27*0.84 14.67 ±9.88*
2.3 SXD对MCAO再灌注大鼠血小板聚集率的影响 结果表明,模型组大鼠血小板聚集率相对于假手术组明显增加,SXD(0.42,0.84 g·kg-1)组大鼠血小板聚集率相对于模型组比较有一定的降低。阳性药SXJ组大鼠血小板聚集率有降低趋势,但无显著性差异,结果见表3。
表3 SXD对MCAO再灌注大鼠血小板聚集率的影响(±s,n=8)

表3 SXD对MCAO再灌注大鼠血小板聚集率的影响(±s,n=8)
注:与假手术组比较:△P <0.05;与模型组比较:*P <0.05。
组别 剂量/g·kg-1 血小板聚集率/%假手术组 —33.19 ±9.18模型组 — 46.13±10.78△SXJ组 0.42 36.42 ±9.37 SXD 组 0.21 38.11 ±10.03 0.42 36.33 ±9.06*0.84 35.14 ±9.24*
2.4 SXD对MCAO再灌注大鼠脑含水量和脑指数的影响 结果显示,模型组脑含水量和脑指数明显高于假手术组;SXD(0.42、0.84 g·kg-1)和阳性药SXJ对脑缺血再灌注22 h大鼠脑指数都低于模型组。SXD(0.84 g·kg-1)和阳性药SXJ组脑含水量低于模型组且有统计学差异,结果见表4。
表4 SXD对MCAO再灌注大鼠脑含水量和脑指数的影响(±s,n=8)
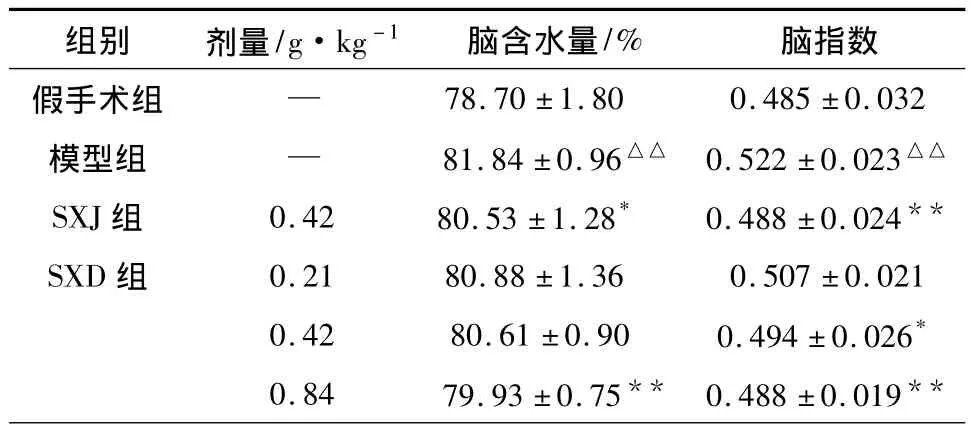
表4 SXD对MCAO再灌注大鼠脑含水量和脑指数的影响(±s,n=8)
注:与假手术组比较:△△P<0.01;与模型组比较:*P<0.05,**P <0.01。
组别 剂量/g·kg-1 脑含水量/%脑指数假手术组 —78.70 ±1.80 0.485 ±0.032模型组 — 81.84±0.96△△ 0.522±0.023△△SXJ组 0.42 80.53 ±1.28* 0.488 ±0.024**SXD 组 0.21 80.88 ±1.36 0.507 ±0.021 0.42 80.61 ±0.90 0.494 ±0.026*0.84 79.93 ±0.75** 0.488 ±0.019**
2.5 SXD对MCAO再灌注大鼠脑组织生化指标的影响 与假手术组相比,模型组大鼠脑组织中SOD及LDH活性显著降低,MDA含量显著增加;与模型组比较,SXD(0.42、0.84 g·kg-1)和阳性药SXJ能够提高MCAO再灌注大鼠脑组织SOD活性,降低 MDA 含量;SXD(0.42、0.84 g·kg-1)和阳性药SXJ对LDH活性明显提高,结果见表5。
表5 SXD对MCAO再灌注大鼠脑组织SOD、LDH、MDA的影响(±s,n=8)
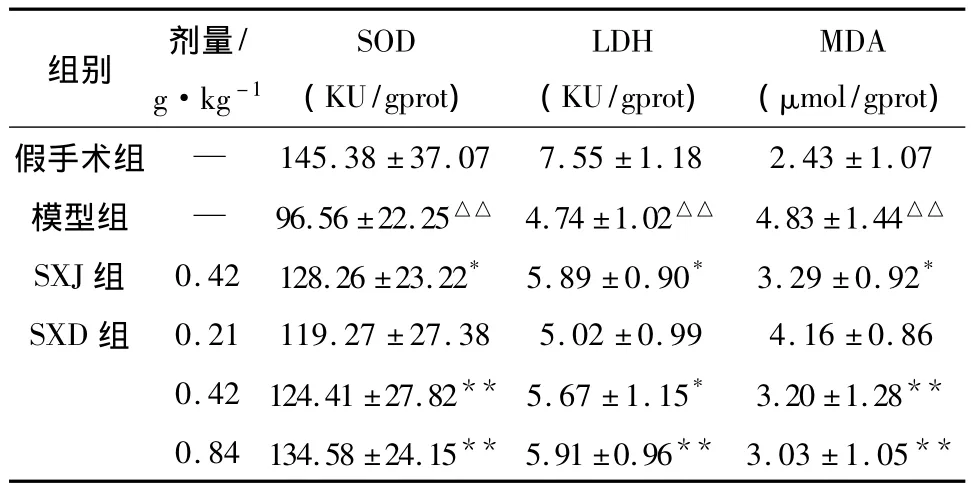
表5 SXD对MCAO再灌注大鼠脑组织SOD、LDH、MDA的影响(±s,n=8)
注:与假手术组比较:△△P<0.01;与模型组比较:*P<0.05,**P <0.01。
组别 剂量/g·kg-1 SOD(KU/gprot)LDH(KU/gprot)MDA(μmol/gprot)假手术组 —145.38 ±37.07 7.55 ±1.18 2.43 ±1.07模型组 — 96.56 ±22.25△△ 4.74 ±1.02△△ 4.83 ±1.44△△SXJ组 0.42 128.26 ±23.22* 5.89 ±0.90* 3.29 ±0.92*SXD 组 0.21 119.27 ±27.38 5.02 ±0.99 4.16 ±0.86 0.42 124.41 ±27.82** 5.67 ±1.15* 3.20 ±1.28**0.84 134.58 ±24.15** 5.91 ±0.96** 3.03 ±1.05**
2.6 SXD对MCAO再灌注大鼠脑组织形态学的影响 假手术组脑组织神经元及细胞形态正常,核仁清晰,未观察到神经细胞变性坏死等明显的病理变化。模型组脑组织细胞排列不规则,有一定程度的核固缩、核染色较深,神经元结构模糊、较多胞体肿胀。SXD(0.42、0.84 g·kg-1)和 SXJ组脑组织软化灶都有一定程度的减少,神经元细胞核固缩程度明显降低,仅有少量细胞出现肿胀,表明SXD和SXJ对MCAO再灌注大鼠脑组织损伤均具有一定的作用保护,结果见图1。
3 讨论
缺血性脑血管病是一类由脑血流供应障碍导致的脑组织缺血、缺氧,是引发局灶性脑组织缺血性损伤或坏死的多发中枢神经系统病变[7]。缺血性脑血管疾病的病理生理机制主要是由脑缺血再灌注损伤引起,首先需要建立稳定、可靠的实验动物模型。目前常用的造模方法为大脑中动脉阻断再灌注损伤模型,该模型具有操作简单、损害较小、死亡率较低等特点,基本模拟了缺血性脑血管疾病的病理生理状态。
脑缺血后模型成功和MCAO再灌注损伤程度的评价主要是依据脑梗死百分比的测定和神经功能学的评分[8]。本实验采用TTC染色法检测脑缺血再灌注损伤后脑组织梗死状况,采用Bederson的评分方法对MCAO再灌注0、4、8、22 h大鼠的神经功能进行评分。实验结果表明SXD对MCAO再灌注后8 h和22 h神经功能损伤评分有一定的降低作用,对MCAO再灌注22 h大鼠脑组织梗死百分比具有一定的减小作用;病理组织学结果也显示SXD能明显改善MCAO再灌注大鼠脑组织神经元结构的形态变化。脑水肿是脑缺血再灌注损伤进程中的一个显著的变化,也是作为评价抗缺血性脑损伤药物的重要指标之一[9]。本实验结果显示SXD可以减轻脑缺血再灌注22 h大鼠脑水肿程度,降低其脑含水量和脑指数。
目前认为脑缺血再灌注损伤是由多种复杂因素相互作用而导致的结果,其中氧自由基脂质过氧化损伤是脑缺血再灌注损伤的主要机制[10]。脑缺血再灌注后脑中氧自由基显著增加,自由基连锁反应的激化可造成脑缺血损伤和迟发性神经功能损害的加重[11]。本实验结果显示,MCAO再灌注后脑组织中MDA含量显著升高,SOD和LDH活性下降,表明MCAO再灌注后出现脂质和氧自由基过氧化损伤。而SXD能降低缺血脑组织中MDA的含量,并提高SOD、LDH的活性,表明SXD能够减轻氧自由基介导的脂质过氧化反应,清除过氧自由基,减轻大鼠缺血性脑组织病变程度。另外,脑缺血时由于无氧糖酵解增加,导致生成大量自由基以及酸中毒,使血小板发生大量聚集继而加速血栓的形成[12]。实验结果表明,SXD能够一定程度降低局灶性脑缺血大鼠血小板聚集率,表明其具有抑制血栓形成的作用。
综上所述,SXD对大鼠脑缺血再灌注损伤具有一定的保护作用,其作用机制可能与抗脂质过氧化损伤、清除氧自由基,减少血小板聚集等因素有关。
[1]Thrift AG,Dewey HM,Macdonell RA,et al.Incidence of the major stroke subtypes:initial findings from the North East Melbourne stroke incidence study(NEMESIS)[J].Stroke,2001,32(8):1732-1738.
[2]Appelros P,Stegmayr B,Terént A.Sex differences in stroke epidemiology:A systematic review[J].Stroke,2009,40(4):1082-1090.
[3]尹士敏,王士贤.麝香的药理作用及临床研究近况[J].天津药学,2002,14(3):42-44.
[4]李凤文,张立石,刘 红,等.水蛭、丹参及其复方对血瘀大鼠血管内皮细胞保护作用的研究[J].中国中药杂志,2001,26(10):703-706
[5]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[6]Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-476.
[7]Hallenbeck JM,Dutka AJ.Background review and current concepts of reperfusion injury[J].Arch Neurol,1990,47(11):1245-1254.
[8]Menzies SA,Hoff JT,Betz AL.Middle cerebral artery occlusion in rats:a neurological and pathological evaluation of a reproducible model[J].Neurosurgery,1992,31(1):100-107.
[9]汪 洋,李维祖,尹艳艳,等.麝香醒脑宁对大鼠全脑缺血/再灌注损伤的保护作用[J].安徽医科大学学报,2009,44(4):475-479.
[10]Homi HM,Freitas JJ,Curi R,et al.Changes in superoxide dismutase and catalase activities of rat brain regions during early global transient ischemia/reperfusion[J].Neurosci Lett,2002,333(1):37-40.
[11]Hayashi T,Sakurai M,Itoyama Y,et al.Oxidative damage and breakage of DNA in rat brain after transient MCA occlusion [J].Brain Res,1999,832(1/2):159-163.
[12]魏 菲,纪凤兰,温富春,等.注射用通栓欣粉针对大鼠脑缺血损伤的保护作用及其机制[J].中国老年学杂志,2010,30(4):500-501.
