ATRA联合腹腔灌注化疗在进展期胃癌患者中的疗效观察
2015-12-13商景荣
商景荣
(湖北省武汉市新洲阳逻中心医院普外科,湖北武汉 430415)
最近,胃癌的发病率尽管是呈下降趋势,但是要能良好地控制进展期的胃癌仍然非常困难,50% ~90%左右的患者会在根治手术后出现局部复发的现象。故治疗胃癌尚需寻求更加有效、积极的治疗措施[1]。目前全反式维甲酸(ATRA),包括其自身的衍生物被广泛应用于诱导肿瘤分化的治疗研究中,开启了治疗肿瘤的新旅程[2]。有报道认为ATRA对胃癌的治疗有着一定的治疗效果,同时在部分的肿瘤细胞株内其能对顺铂(DDP)的治疗起到增强的作用。DDP或5-氟尿嘧啶(5-Fu)对胃癌进行腹腔灌注治疗具有良好的临床治疗的效果[3]。本文旨在通过分别使用腹腔灌注化疗和ATRA+腹腔灌注化疗的方法治疗进展期胃癌患者,探讨两者治疗方式的临床疗效。
1 资料与方法
1.1 研究对象 分析2006年3月至2009年8月在我院接受治疗的胃癌患者的临床资料。所有患者均经病理组织学确诊为胃癌,本研究共纳入患者共计125例,其中观察组患者64例,对照组患者61例。血脂和肝肾功能检测指标以及外周血的常规检查的指标都为正常值,参照美国东部肿瘤协会组(ECOG)的体力状态的评分标准低于4分者。由同一团队对所有患者施行手术。
1.2 研究方法 随机将患者分成腹腔灌注化疗组(对照组)和ATRA+腹腔灌注化疗组(观察组)。
对照组:采用单纯腹腔灌注化疗,具体为:在手术关腹前将化疗泵置入体内。每次实施腹腔化疗时,首先将42~43℃、1~2 L的0.9% 氯化钠溶液和10 mL 2%的利多卡因、10 mg的地塞米松快速注入腹腔中,参照患者自身的耐受状况来确定注入速度和量;接着,再将化疗药物DDP和5-Fu注入腹腔中。其中5-Fu购自海南长安国际制药有限公司,连续用药3 d,每天1次,每次600 mg·m-2,3次为1周期;DDP购自昆明贵研药业有限公司,每次40 mg·m-2,1次为1周期。为了达到腹腔和药物能够充分接触的目的,需提醒患者定时体位进行变换。术后1月开始化疗,3周为1周期,共6周期。
观察组:采用腹腔灌注化疗联合ATRA治疗,具体为:(1)腹腔灌注化疗同观察组;(2)ATRA的给药方式为:术后两周时给患者每次口服10 mg的ATRA,每天3次,共口服半年。其中ATRA购自山东良福制药有限公司。
随访:术后第1年,门诊复诊每月1次。术后第2年,门诊复诊每隔2个月1次。术后2年后,复诊半年1次。对于无法按时复诊的患者,通过社区医疗卫生的服务人员、地方的行政管理员、当地的派出所以及家属或患者进行电话随访,对患者的生存状况或是死亡的时间进行全面了解。随访截止于2014年9月30号。随访所有的入选患者,随访时间平均60.3月。
1.3 统计学方法 研究观测资料的比较采用SPSS19.0软件。计量数据的表示形式为均数±标准差(±s),组间比较为成组t检验;计数资料以例或率描述,组间比较为卡方检验;此外,对随访资料行生存分析及Log-Rank检验。P<0.05表示具有统计学差异。
2 结果
2.1 一般资料 本研究共纳入患者共计125例,其中观察组患者64例,对照组患者61例。表1结果提示两组患者的一般资料比较并无统计学差异(P>0.05)。
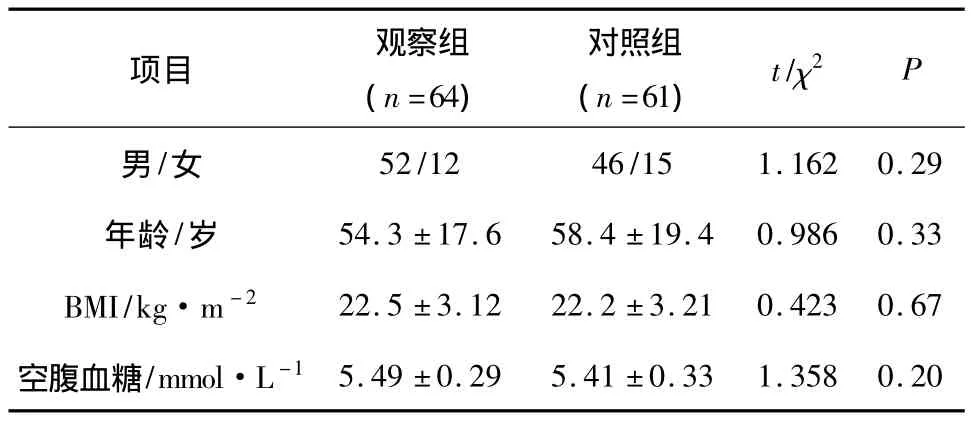
表1 两组一般资料的比较
2.2 两组患者的生存曲线比较 观察组和对照组患者的生存曲线比较见图1,结果提示观察组患者的5年生存率高于对照组(46.9%,30/62 vs 24.6%,15/61;Log-rank χ2=4.431,P=0.036)。
2.3 观察组患者的5年生存率与病理特征的相关性 表3结果提示观察组患者的5年生存率与肿瘤的组织分化程度、肿瘤分期以及淋巴结转移情况有着明显的相关性(P<0.05)。
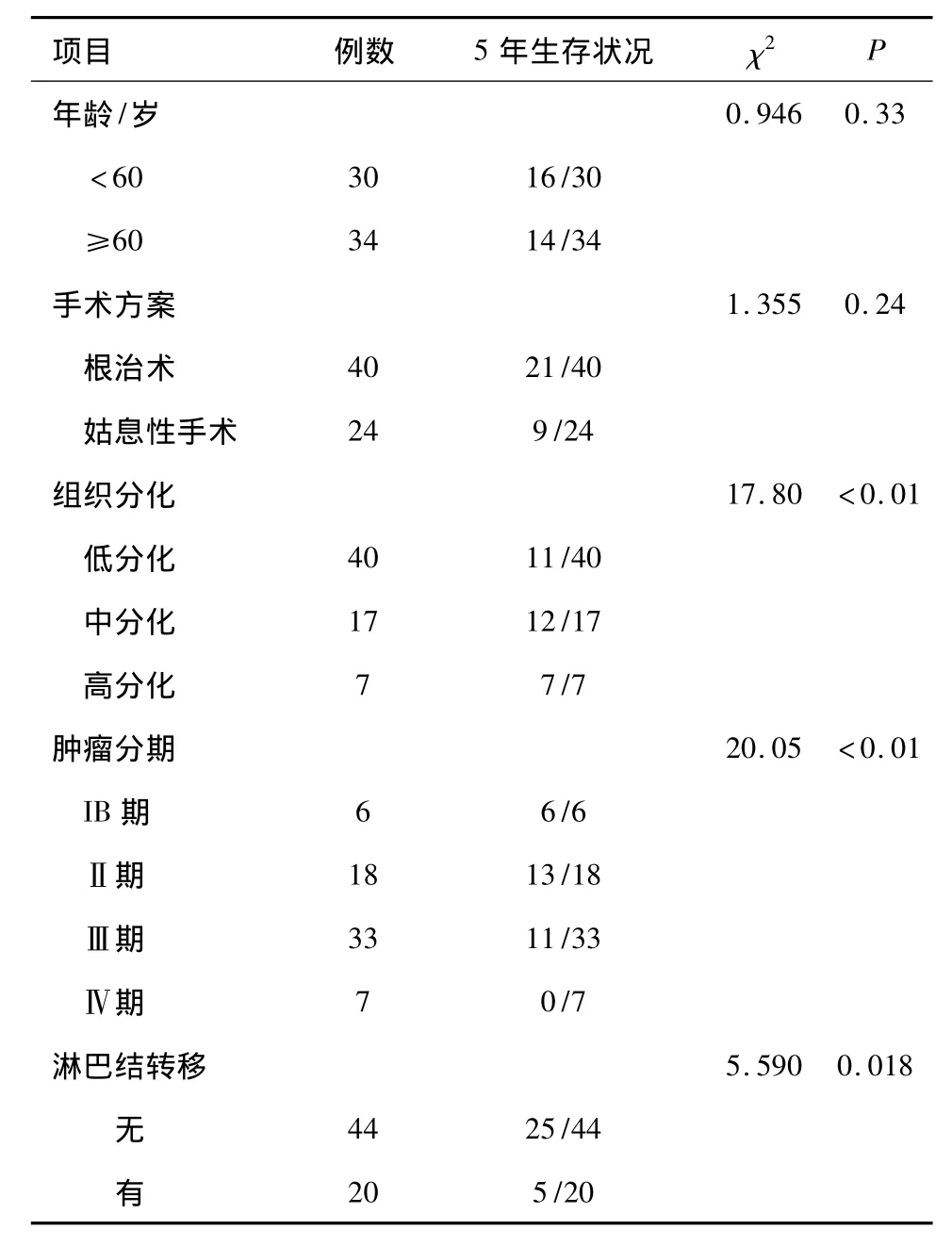
表3 观察组患者的5年生存状况与病理特征的相关性
3 讨论
胃癌属于常见的一种恶性肿瘤,对人类的身体健康构成了严重的威胁[4]。虽然胃癌手术技术不断进步,但胃癌术后复发是导致失败的一个重要因素[5]。腹腔癌中的细胞残留是致使腹膜以及局部复发的重要因素,原因可能是:癌栓随着术中淋巴管、离断的血管转移至腹腔;手术期间,对隔离未能妥善处理,伴随胃肠液,落入胃腔中的癌细胞通过残端进入腹腔中;进展期胃癌患者,虽然可以实施根治性手术的治疗,但是腹膜以及淋巴结的微转移情况可能在术前就已经出现,致使手术切除无法彻底[6]。
相对于全身静脉化疗,腹腔化疗能够保持腹腔内的病灶处于高浓度药物中,使得作用时间更长,杀伤性能更高[7];腹腔内药物经过门脉系统、肝脏首过效应,药物的毒性、不良反应明显减少,机体耐受性更佳;并且肝脏、门脉内高浓度的药物使得胃癌转移至肝脏的可能性大大减小,预防了癌灶的转移[8]。因此,腹腔化疗理论上对腹腔残留癌细胞的杀灭可能性更大。目前部分学者认为手术和腹腔化疗联合是对进展期胃癌治疗的一种极为有效的方式[9]。
很多化疗药物的细胞毒性无特异性,肿瘤对其也并不敏感。研究表明恶性肿瘤细胞的正常成熟和分化过程出现障碍[10],因此,诱导肿瘤细胞凋亡、分化使其想正常细胞方向转化,从而达到了抑制肿瘤的生长,使肿瘤和机体共存,进而降低化疗不良反应,提高患者耐受性内,明显降低肿瘤复发,最终提高患者生存率[11]。ATRA是临床上被广泛应用的一种分化诱导剂,对于急性早幼粒细胞白血病(APL)的治疗,ATRA诱导分化的治疗方式已经成为了首选方案,在治疗胃癌等的实体瘤方面,ATRA已经获得了显著的疗效[12]。
本实验中,采用了多种治疗方案对进展期胃癌术后的患者进行治疗,通过分析治疗方案对患者的生存时间所构成的影响发现,采用ATRA治疗的胃癌患者明显比未采用ATRA治疗的患者的生存期长,无论是中位生存期,还是5年的生存率,前者均更优秀。ATRA联合腹腔化疗能显著改善患者的生存率[13]。本研究还探讨了影响患者化疗预后的因素,结果发现肿瘤的组织分化程度、分期以及淋巴结转移情况能够显著影响患者的预后。我们分析认为,联合用药所取得的临床疗效可能原因为:细胞毒性药物对肿瘤细胞的杀伤作用服从一级动力学的原理,即只能按一定比例而不能全部杀死恶性肿瘤细胞。所以单一药物在治疗剂量范围内很难杀灭全部肿瘤细胞,而增加药物剂量无疑会导致毒副反应增加。因而联合使用肿瘤毒性机理不同的药物可以更为彻底消灭残余肿瘤。
截至目前医疗水平,还没有一种化疗药物能够根治肿瘤,但当体内的肿瘤负荷低于106个时,联合治疗有可能能够消灭残余癌细胞[14]。综上,联合细胞毒性药物联合诱导分化药物进行腹腔化疗有望成为一种治疗胃癌的新模式,对进展期胃癌的疗效或许能起到改善的作用。
[1]Lee JH,Son SY,Lee CM,et al.Factors predicting peritoneal recurrence in advanced gastric cancer:implication for adjuvant intraperitoneal chemotherapy[J].Gastric Cancer,2014,17(3):529-536.
[2]Votanopoulos KI,Newman NA,Russell G,et al.Outcomes of cytoreductive surgery(CRS)with hyperthermic intraperitoneal chemotherapy(HIPEC)in patients olderthan 70 years;survival benefit at considerable morbidity and mortality[J].Ann Surg Oncol,2013,20(11):3497-3503.
[3]Sun J,Song Y,Wang Z,et al.Benefits of hyperthermic intraperitoneal chemotherapy for patients with serosal invasion in gastric cancer:a meta-analysis of the randomized controlled trials[J].BMC Cancer,2012,12:526.
[4]张 弦,张 阳.胃癌辅助化疗的选择和应用[J].医学与哲学,2011,32(20):18-19,43.
[5]Roviello F,Caruso S,Neri A,et al.Treatment and prevention of peritoneal carcinomatosis from gastric cancer by cytoreductive surgery and hyperthermic intraperitoneal chemotherapy:overview and rationale[J].Eur JSurg Oncol,2013,39(12):1309-1316.
[6]Mi DH,Li Z,Yang KH,et al.Surgery combined with intraoperative hyperthermic intraperitoneal chemotherapy(IHIC)for gastric cancer:a systematic review and meta-analysis of randomised controlled trials[J].Int JHyperthermia,2013,29(2):156-167.
[7]Kim KW,Chow O,Parikh K,et al.Peritoneal carcinomatosis in patients with gastriccancer,and the role for surgical resection,cytoreductive surgery,and hyperthermic intraperitoneal chemotherapy[J].Am JSurg,2014,207(1):78-83.
[8]张 斌,姬社青,陈小兵,等.进展期胃癌新辅助化疗疗效及对手术风险影响[J].中华实用诊断与治疗杂志,2011,25(2):162-164.
[9]Benizri EI,Bereder JM,Rahili A,et al.Ascites and malnutrition are predictive factors for incomplete cytoreductive surgery for peritoneal carcinomatosis from gastric cancer[J].Am J Surg,2013,205(6):668-673.
[10]Lampl B,Leebmann H,Mayr M,et al.Rare diaphragmatic complications following cytoreductive surgery and HIPEC:report of two cases[J].Surg Today,2014,44(2):383-386.
[11]Kitayama J,Emoto S,Yamaguchi H,et al.Flow cytometric quantification of intraperitoneal free tumor cells(FTC)in patients with peritoneal metastasis[J].Cytometry B Clin Cytom,2014,86(1):56-62.
[12]Huang JY,Xu YY,Sun Z,et al.Comparison different methods of intraoperative and intraperitoneal chemotherapy for patients with gastric cancer:a meta-analysis[J].Asian Pac J Cancer Prev,2012,13(9):4379-4385.
[13]李 征,杨克虎,米登海,等.进展期胃癌术后腹腔热灌注化疗有效性和安全性的系统评价[J].中国循证医学杂志,2011,11(12):1402-1408.
[14]Imano M,Okuno K.Treatment strategies for gastric cancer patients with peritoneal metastasis[J].Surg Today,2014,44(3):399-404.
