血尿酸水平与帕金森病的相关性分析
2015-12-13余招平吴君仓
余招平,岳 宏,群 森,吴君仓
(合肥市第二人民医院广德路院区神经内科,安徽合肥 230011)
帕金森病(Parkinson disease,PD)又名震颤麻痹,是一种常见的运动障碍性疾病,我国65岁以上人群PD的患病率大约是1.7%。中脑黑质多巴胺能神经元的变性死亡,纹状体多巴胺含量显著降低是帕金森病最主要的病理改变[1]。近年来有研究发现尿酸是人体内的重要抗氧化剂,具有减轻体内氧化应激反应和保护多巴胺神经元的作用[2]。本文旨在研究血尿酸水平与帕金森病的关系,进一步探讨PD患者的认知功能及抑郁与血UA水平的相关性。
1 对象与方法
1.1 一般资料 PD组:选取2012年1月至2014年12月在合肥市第二人民医院广德路院区神经内科门诊及住院部确诊为PD患者共76例,所有患者均符合英国脑库关于帕金森病的诊断标准[3]。排除标准:(1)药物、外伤、脑炎、脑血管病等原因所致的帕金森综合征;(2)进行性核上性麻痹、多系统萎缩等帕金森叠加综合征;(3)合并严重心、肺、肝、肾等疾病及其他严重躯体疾病和精神疾病。PD患者中男36例,女40例,年龄58~82岁,平均(70.26±12.35)岁,平均受教育程度(7.87±2.58)年。对照组:选取同期在我院体检中心的健康中老年人70例,其中男32例,女38例,年龄56~84岁,平均(71.58±13.46)岁,平均受教育程度(7.16±2.08)年。两组研究对象均无痛风病史,肾功能均正常,两组年龄、性别、教育程度比较,差异无统计学意义,具有可比性。所有研究对象均为合肥市本地居民,生活习惯及饮食结构均相似。本研究对象均签署知情同意书,并经过医院伦理委员会批准。
1.2 方法 所有研究对象均进行血尿酸水平检测,详细记录年龄、性别、教育程度等相关资料。PD组患者由神经科医生进行仔细的体格检查,并经从事过专业量表测试的医生完成各项量表的评估。按Hoehn-Yahr分期,其中I期12例及Ⅱ期16例(轻度),Ⅲ期29例(中度),Ⅳ期13例及V期6例(重度)。应用蒙特利尔认知评估量表(北京版)评估其认知功能,MoCA包括了视结构技能、执行功能、语言、注意与集中、抽象思维、记忆、计算和定向力等8个认知领域的11个检查项目。总分30分,大于26分正常。应用汉密尔顿抑郁量表(HAMD)对抑郁程度进行评定,总分大于24分为重度抑郁,17~23分为中度抑郁,8~22分为轻度抑郁,小于8分为无抑郁。
1.3 统计学处理 应用SPSS 16.0软件进行统计分析。计量资料以均数(±s)表示,计数资料的组间比较采用χ2检验,用独立样本t检验比较两组资料的不同,多组比较采用单因素方差分析及Spearman等级分析,P<0.05表示差异有统计学意义。
2 结果
2.1 PD组与对照组血UA水平的比较 与对照组相比,PD组血UA水平明显降低,差异有显著统计学意义(P<0.05,见表 1)。

表1 PD组不同H-Y分期血尿酸水平与对照组的比较
2.2 PD组中轻、中、重3组血UA水平与对照组的比较与对照组相比,PD组中轻、中、重3组血UA水平明显低于对照组,差异有显著统计学意义(P<0.05,见表 1),但Spearman等级分析显示PD患者各临床分期与血UA水平之间无明显相关性(r=0.182,P >0.05)。
2.3 PD组患者中各亚组血UA水平比较 与PD患者无认知功能损害组相比,PD患者伴有认知功能损害组的血UA酸水平显著降低;与PD患者无抑郁组相比,PD患者伴有抑郁组的血UA水平也明显降低 (P<0.05),见表2。
2.4 血UA水平与PD患者认知功能及抑郁评分的相关性分析 PD组患者MoCA评分为(20.65±3.06)分,伴有认知功能损害46例(60.5%);PD组患者HAMD评分为(20.16±4.23)分,其中轻度抑郁 13例(17.1%),中度抑郁 21例(27.6%),重度抑郁 10 例(13.2%)。Spearman 相关分析结果表明,血UA水平与PD患者的MoCA评分呈明显正相关(r=0.552,P <0.05),而与 HAMD 评分呈负相关(r=-0.438,P <0.05)。
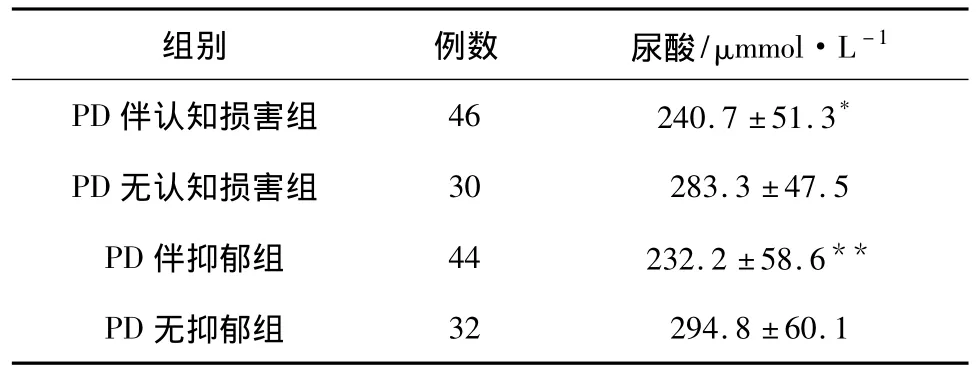
表2 PD组各亚组血尿酸水平的比较
3 讨论
帕金森病是一种中老年人常见的神经系统变性疾病,但目前其确切病因仍然不清楚。年龄老化、氧化应激、遗传、环境等多种因素可能均与帕金森病神经变性有关。现在认为氧化应激是导致帕金森病多巴胺能神经元变性死亡的主要发病机制[4]。尿酸是人体内细胞内核糖核酸和其他嘌呤类化合物代谢的最终产物,大部分尿酸经肾脏排泄,小部分经肠道和胆道排出体外[5]。尿酸是一种重要的天然抗氧化剂、自由基清除剂,可以清除人体内氧自由基及其他活性自由基,同时还是铁螯合剂,螯合转移铁等金属离子,尿酸盐还能清除过氧化物、羟基等,从而减轻多巴胺能神经元的损害[6]。另外帕金森病动物模型的研究发现,通过尿酸治疗可降低小鼠体内的氧化应激水平,保护多巴胺能神经元[7]。因此血尿酸水平与帕金森病存在密切的关系。
本研究发现,与对照组相比,PD组血尿酸水平明显降低,且PD组中轻、中、重3组血尿酸水平也明显低于对照组,差异有显著统计学意义,提示血尿酸水平降低很可能是帕金森病的一项高危因素。这与近年国内Sun及Pan的两项研究的结论是一致的[8-9]。西班牙的一项帕金森病的临床研究也表明,尿酸可能对帕金森病有保护作用,并且影响临床进展[10]。美国的一项大型前瞻性研究,共纳入18018名男性,对其随访5~7年后发现,高血尿酸水平随访者的PD发病率较低血尿酸水平随访者下降55%,且在校正年龄、吸烟和咖啡因摄入史等混杂因素之后,这种相关性仍然存在[2]。另一项有关帕金森病的前瞻性研究中,对804例初期PD患者平均随访21.4个月后发现,血尿酸水平较高的PD患者临床症状和体征进展相对较慢,说明高尿酸水平可能会延缓帕金森病患者的病情发展[11]。我们还发现血尿酸水平与PD患者病情H-Y分期间无等级相关性,这提示虽然低血尿酸水平可能是PD发病的高危因素,但与PD患者病情的严重程度无关。
近年来帕金森病的非运动症状越来越受到关注,特别是PD患者的认知功能损害及抑郁症状严重影响生活质量。本研究发现,PD患者伴有认知功能损害组的血尿酸水平显著低于PD患者不伴有认知功能损害组,PD患者伴有抑郁组的血尿酸水平也明显低于PD患者不伴有抑郁组。血尿酸水平与PD患者的MoCA评分呈明显正相关,而与HAMD评分呈负相关,提示低血尿酸水平和PD患者认知功能损害及抑郁的发生密切相关。Moccia等[12]最近的研究共包括609例新确诊的PD患者,所有患者均完成血清尿酸水平检测和非运动症状问卷调查,随访2年后结果显示,不伴有非运动症状的患者尿酸水平比伴有非运动症状的患者尿酸水平明显增高,而尿酸水平与非运动症状,特别是抑郁 /焦虑、注意力 /记忆力和心血管疾病相关。因此也证明了血尿酸水平可以作为PD的一种可靠的生物标志物。
综上所述,血尿酸水平降低很可能是帕金森病的一项高危因素,早期监测PD患者的血尿酸水平在临床工作中尤为重要,尽早通过调整饮食或药物适当升高尿酸,也许会延缓PD的进展,提高患者的生活质量。
[1]Shadrina MI,Slominsky PA,Limborska SA.Molecular mechanisms of pathogenesis of Parkinson’s disease[J].Int Rev Cell Mol Biol,2010,281:229-266.
[2]Weisskopf MG,O'Reilly E,Chen H,et al.Plasma urate and risk of Parkinson's disease[J].Am J Epidemiol,2007,166(5):561-567.
[3]Meara J,Bhowmick BK,Hobson P.Accuracy of diagnosis in patients with presumed Parkinson's disease[J].Age Ageing,1999,29(2):99-102.
[4]Cipriani S,Chen X,Schwarzschild MA.Urate:a novel biomarker of Parkinson’s disease risk,diagnosis and prognosis[J].Biomark Med,2010,4(5):701-712.
[5]黄婷婷,罗蔚锋,刘春风.尿酸—帕金森病防治的潜在新靶点[J].中华神经医学杂志,2012,11(11):1179-1181.
[6]张 丽,张利丽,鲁 明,等.尿酸与帕金森病的关系[J].临床神经病学杂志,2013,26(4):312-313.
[7]Duan W,Ladenheim B,Cutler RG,et al.Dietary folate deficiency and elevated homocysteine levels endanger dopaminergic neurons in models of Parkinson's disease[J].J Neurochem,2002,80(1):101-110.
[8]Sun CC,Luo FF,Wei L,et al.Association of serum uric acid levels with theprogression of Parkinson's disease in Chinese patients[J].Chin Med J,2012 ,125(4):583-587.
[9]Pan MQ,Gao HM,Long L,et al.Serum uric acid in patients with Parkinson's di-sease and vascular parkinsonism:a cross-sectional study[J].Neuroimmunomodulation,2013,20(1):19-28.
[10]Jesús S,Pérez I,Cáceres-Redondo MT,et al.Low serum uric acid concentration in Parkinson's disease in southern Spain[J].Eur J Neuro,2013(20):208-210.
[11]Sehwarzschild MA,Schwid SR,Marek K,et al.Serum urate as a predictor of clinical and radiographic progression in parkinson disease[J].Arch Neurol,2008,65(6):716-723.
[12]Moccia M,Picillo M,Erro R,et al.Presence and progression of non-motor symptoms in relation to uric acid in de novo Parkinson’s disease[J].Eur JNeuro,2015,22(1):93-98.
