低分割放疗对肝癌患者细胞免疫功能的影响
2015-12-12刘晓洪王越华肖天林易铁男邓晨昕
刘晓洪,章 阳,王越华,肖天林,易铁男,邓晨昕
(湖北省襄阳市中心医院1.肿瘤科;2.内分泌科,湖北 襄阳 441021)
在中国,原发性肝癌发病率为21.88/10万,在所有恶性肿瘤中位居第4位,死亡率为23.76/10万,占第2位[1]。早期肝癌患者首选手术治疗,但仅仅30%~40%能由此受益,经动脉化疗栓塞、各种经皮消融技术、系统化疗、靶向治疗都作为不能或者不愿手术患者的治疗选择,但仅有经动脉化疗栓塞和索拉非尼被临床试验证实能延长患者生存时间[2-3]。近年来,放射治疗尤其是低分割大剂量放射治疗(包括立体定向放射治疗)也逐渐用于肝癌或肝转移癌的治疗并显示出较好的疗效[2,4]。本研究通过检测治疗前后 T细胞亚群的变化探讨低分割大剂量放疗对肝癌患者细胞免疫功能的影响。
1 资料与方法
1.1 临床资料与入组标准 本组27例肝癌患者均来自我院肿瘤科2013年1—11月的住院患者,16例经肝穿刺活检病理组织学和(或)细胞学确诊,11例结合临床病史、AFP和增强影像学表现诊断[5]。入选标准:(1)临床确诊原发性肝癌,KPS≥70,年龄<80岁,经外科会诊无手术适应证;(2)有较好的肝功能储备,Child分级A或B级;(3)所有患者知情同意并获得治疗知情同意书。其中男19例,女8例,平均年龄(52.6±10.1)岁。肝功能 Child分级 A级者20例,B级者7例;癌灶为单发者25例,肿瘤最大直径 6.0~11.5 cm;有门脉癌栓者17例,术后复发1例;22例患者在放疗前行肝动脉化疗栓塞术1~3次。本研究通过我院伦理委员会审批。
1.2 治疗方法 患者仰卧位,双手自然交叉置于额部,采用碳纤底板及热塑多空网膜固定,用铅点做等中心体表标记,然后在大孔径模拟定位机下以5 mm层厚获取CT增强扫描图像,扫描范围为主动脉弓至双肾下极。在CT增强的动脉期勾画大体靶体积(gross tumor volume,GTV),均匀外扩0.5 cm并不超出肝脏形成临床靶体积(clinical target volume,CTV),CTV上下外扩1 cm、其余方向外扩 0.5 cm 形成计划靶体积(planning target volume,PTV),传输至放射治疗计划系统行三维适形放射治疗计划设计。90%等剂量曲线包含PTV,PTV内部剂量差异为±7%,采用4~8 Gy/次,3次/周,48~56 Gy,分8 ~10 次,3.0 ~3.5 周完成,根据 PTV大小分割方案有:4 Gy×12次;5Gy×10次;6 Gy×9次;7 Gy×8次4种,生物有效剂量相当于常规分割照射剂量67~95 Gy(α/β=10)。勾画危机器官包括脊髓、正常肝脏、胃、小肠、肾脏,并控制照射剂量在可接受范围内。
1.3 检测方法 患者分别于治疗前及治疗后1月空腹抽取肘静脉血3 mL,枸橼酸钠抗凝。采用流式细胞术检测淋巴细胞亚群(CD3+、CD4+、CD8+)和 CD4+/CD8+比值,并检测NK细胞水平。
1.4 统计学分析 使用SPSS16.0统计软件进行结果分析。数据采用均数±标准差(±s)表示,处理前后的比较采用配对t检验的方法;P<0.05认为有统计学意义。
2 结果
2.1 近期疗效 随访截止2014年3月,随访率为100.0%,随访时间为4~14个月。按实体瘤的近期疗效标准进行评价[6],放疗后完全缓解(CR)2例,部分缓解(PR)17例,无变化(NC)5例,进展(PD)3例。治疗有效率(CR+PR)为70.4%。
2.2 细胞亚群细胞计数 低分割放疗后,CD3+、CD4+、NK细胞水平及CD4+/CD8+比值明显增加,CD8+无明显变化(表1)。
2.3 毒副反应 正常组织急性反应按RTOG标准评价[7]。放疗中肝脏急性不良反应1级4例,经对症治疗恢复正常,无2级及以上反应;1~2级上消化道反应分别为12例、8例,无消化道溃疡和消化道出血等严重并发症发生。
3 讨论
肝癌位居我国恶性肿瘤致死原因的第2位[1]。目前,经动脉化疗栓塞术、射频消融、冷冻、微波等局部微创介入技术在中晚期肝癌中的应用越来越广泛,但治疗效果仍不理想。肿瘤免疫学的最新研究为肝癌治疗提供了新的思路。研究发现,肝癌发生、进展及预后与肿瘤局部微环境内和全身免疫功能状态密切相关[8-10]。肝癌肿瘤局部和全身存在自发的和复杂的免疫反应,包括 T细胞反应和对肿瘤各种相关性抗原刺激引起的体液反应[11-12]。肿瘤相关抗原特异性免疫治疗可产生更强的肿瘤特异性免疫反应[10],将为抗肝癌的治疗提供一种新的手段。细胞免疫是机体抗肿瘤免疫效应的主要机制,T淋巴细胞在细胞免疫中起主要作用,CD4+和CD8+T细胞相互协调,相互制约,共同参与对机体免疫应答的调节作用,其活性、数量、比例上的变化与疾病的发展、演变均有关系[13]。外周血T淋巴细胞亚群是反映肿瘤患者免疫状态的较好指标[14]。淋巴细胞的比例一定程度上可判断预后[11]。NK细胞系天然杀伤细胞,是一种非特异性的免疫活性细胞,是机体防御肿瘤生长、发展的第一道防线,对血行转移的肿瘤细胞产生较强的杀伤作用,在抑制肿瘤的转移方面起到积极作用。动态监测肝癌患者术后的细胞免疫功能,可作为评估肝癌根治术后预后和潜在复发风险评估的指标之一[15]。微波、氩氦刀、高强度聚焦超声HIFU等局部介入治疗手段有助于提高机体免疫功能[16-18]。
表1 放疗前后外周血T细胞亚群及NK细胞水平比较(±s)
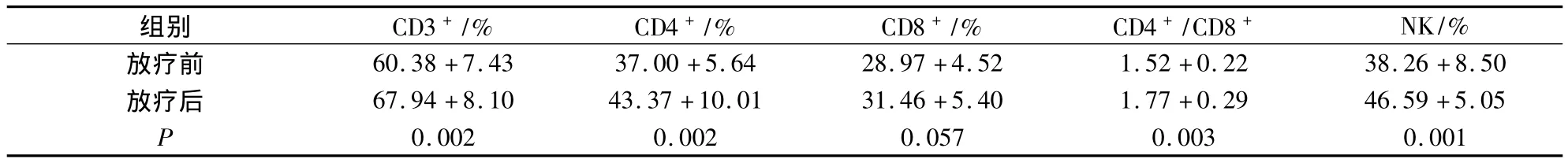
表1 放疗前后外周血T细胞亚群及NK细胞水平比较(±s)
组别 CD3+/% CD4+/% CD8+/% CD4+/CD8+NK/%放疗前 60.38+7.43 37.00+5.64 28.97+4.52 1.52+0.2238.26+8.50放疗后 67.94+8.10 43.37+10.01 31.46+5.40 1.77+0.29 46.59+5.05 P 0.002 0.002 0.057 0.003 0.001
肝癌曾被认为对放射线不敏感,正常肝脏放射耐受性差,不适合放射治疗,但现代基础与临床研究认为肝癌细胞属早反应组织,肝癌的放射敏感性相当于低分化鳞癌[19]。有研究评估了三维适形放疗的安全性、可行性及有效性,接受66 Gy总照射剂量,放射治疗后有效率达92%,无4级或更严重的不良反应;对5~18 cm肝癌3DCRT有效率91%,1、3年生存率94%、26%,放疗对大肝癌的治疗安全有效[20]。Meta分析显示,经动脉化疗栓塞术联合放疗较单纯的化疗栓塞术有更好的生存获益和肿瘤局部控制率[21]。立体定向放射治疗自1995年应用于肝癌以来,也被认为安全有效[22]。相比常规放疗,大分割放疗更有优势[23]。原因除了直接的肿瘤细胞损伤外,还包括:(1)TNF-α和神经酰胺等介导的旁观者效应或远隔效应;(2)超过8 Gy时强力导致肿瘤内皮细胞死亡;(3)增加宿主对放疗诱导免疫抗原递呈的识别,激活免疫系统,减轻肿瘤负荷,减少远处转移;(4)对不同克隆源的异质性肿瘤有较好的效果;(5)对乏氧依赖程度低[24]。立体定向放射治疗联合TACE对小肝癌是一种有效、安全的局部治疗,1年局部控制率96.3%,中位无病生存期18月,1年生存率92.6%[25]。本研究通过检测低分割放射治疗前后肝癌患者外周血T淋巴细胞亚群水平,发现治疗后患者外周血CD3+、CD4+、CD4+/CD8+以及NK细胞水平均显著增加,提示低分割放疗可以增强肝癌患者的免疫能力,更有利于患者治疗。T淋巴细胞亚群水平的变化与预后的相关性值得进一步研究。
[1]Chen WQ,Zheng RS,Zhang SW,et al.Report of cancer incidence and mortality in China,2010[J].Ann Transl Med,2014,18:233.
[2]Cárdenes HR.Role of stereotactic body radiotherapy in the management of primary hepatocellular carcinoma.Rationale,technique and results[J].Clin Transl Oncol,2009,11(5):276-283.
[3]Llovet JM,Bruix J.Molecular targeted therapies in hepatocellular carcinoma[J].Hepatology,2008,48(4):1312-1327.
[4]Lo SS,Dawson LA,Kim EY,et al.Stereotactic body radiation therapy for hepatocellular carcinoma[J].Discov Med,2010,9(48):404-410.
[5]中华人民共和国卫生部.原发性肝癌的诊疗规范(2011年版)摘要[J].中华肝脏病杂志,2012,20(6):419-426.
[6]孙 燕.内科肿瘤学[M].5版.北京:人民卫生出版社,2001:994-997.
[7]殷蔚伯,余子豪,徐国镇,等.肿瘤放射治疗学[M].4版.北京:中国协和医科大学出版社,2002:1108-1111.
[8]Fu J,Xu D,Liu Z,et al.Increased regulatory T cells correlate with CD8 T-cell impairment and poor survival in hepatocellular carcinoma patients[J].Gastroenterology,2007,132(7):2328-2339.
[9]Gao Q,Qiu SJ,Fan J,et al.Intratumoral balance of regulatory and cytotoxic T cells is associated with prognosis of hepatocellular carcinoma after resection[J].J Clin Oncol,2007,25(18):2586-2593.
[10]Mizukoshi E,Nakamoto Y,Arai K,et al.Comparative analysis of various tumor-associated antigen-specific t-cell responses in patients with hepatocellular carcinoma[J].Hepatology,2011,53(4):1206-1216.
[11]Korangy F,Höchst B,Manns MP,et al.Immune responses in hepatocellular carcinoma[J].Dig Dis,2010,28(1):150-154.
[12]孔 丽,姚树坤,刘金星,等.原发性肝癌患者细胞免疫功能变化及其与转归的关系[J].中华肝脏病杂志,2005,13(3):194-197.
[13]Koch M,Beckhove P,Op den Winkel J,et al.Tumor infiltrating T lymphocytes in colorectal cancer:Tumor-selective activation and cytotoxic activity in situ[J].Ann Surg,2006,244(6):986-992.
[14]黄 羽,梅玉屏,曾 星.肿瘤患者外周血T淋巴细胞亚群及天然杀伤细胞活性的检测—附121例[J].新医学,2006,31(6):337-340.
[15]覃英容,林 源,莫显伟,等.原发性肝癌患者术后细胞免疫功能状况与复发的相关性[J].中国癌症防治杂志,2013,5(3):235-238.
[16]彭齐荣,肖 必,张 健,等.微波凝固术后肝癌患者免疫功能变化的初步研究[J].现代肿瘤医学,2011,19(3):483-485.
[17]卢 宁,贺江虹,黄建国,等.氩氦刀冷冻治疗肝癌对患者免疫功能的影响[J].现代肿瘤医学,2010,18(10):2002-2003.
[18]吴发伟,冯 蕾,党亚正,等.高强度聚焦超声对转移性肝癌患者机体免疫功能的影响[J].现代肿瘤医学,2010,18(3):517-519.
[19]曾昭冲.原发性肝癌放射治疗的争论与共识[J].临床肿瘤学杂志,2008,13(2):97-104.
[20]Wu DH,Liu L,Chen LH,et al.Therapeutic effects and prognostic factors in three-dimensional conformal radiotherapy combined with transcatheter arterial chemoembolization for hepatocellular carcinoma[J].World J Gastroenterol,2004,10(15):2184-2189.
[21]Meng MB,Cui YL,Lu Y,et al.Transcatheter arterial chemoembolization in combination with radiotherapy for unresectable hepatocellular carcinoma:a systematic review and meta-analysis[J].Radiother Oncol,2009,92(2):184-194.
[22]Lo CH,Huang WY,Lee MS,et al.Stereotactic ablative radiotherapy for unresectable hepatocellular carcinoma patients who failed or were unsuitable for transarterial chemoembolization[J].Eur J Gastroenterol Hepatol,2014,26(3):345-352.
[23]Fakiris AJ,McGarry RC,Yiannoutsos CT,et al.Stereotactic body radiation therapy for early-stage non-small-cell lung carcinoma:four-year results of a prospective phase II study[J].Int J Radiat Oncol Biol Phys,2009,75:677-682.
[24]Prasanna1 A,Ahmed MM,Mohiuddin M,et al.Exploiting sensitization windows of opportunity in hyper and hypo-fractionated radiation therapy[J].J Thorac Dis,2014,6(4):287-302.
[25]Honda Y,Kimura T,Aikata H,et al.Pilot study of stereotactic body radiation therapy combined with transcatheter arterial chemoembolization for small hepatocellular carcinoma[J].Hepatogastroenterology,2014,61(129):31-36.
