全身PET/CT断层显像联合肿瘤标志物检测在肺癌诊断及鉴别诊断中的临床意义
2015-12-12高世乐董六一刘美琴胡宗涛
高世乐,董六一,王 崇,刘美琴,魏 磊,徐 鹏,刘 演,胡宗涛
(1.中国人民解放军第105医院肿瘤中心,安徽合肥 230031;2.安徽医科大学药理学教研室 ,安徽 合肥 230032)
肺癌是世界范围内最常见的恶性肿瘤,目前在世界上已成为恶性肿瘤死亡的第一位[1];肺癌的预后与其分期密切相关,0期至Ⅳ期其5年生存率由90%降至5%,影响肺癌预后的最重要因素是没有及时诊断、及时治疗[2]。近年来,随着正电子发射断层显像-X线计算机断层成像(Positron Emission Tomography/computed tomography,PET/CT)和肿瘤标志物检测(Detection of tumor markers,TM)越来越多运用于临床,提高了肺癌的诊断率。2008年,NCCN已把PET/CT检查作为肺癌治疗评估的必要手段引入诊疗指引[3]。PET/CT检查是目前肺部病灶最可靠的良恶性无创伤判定方法,实现PET与CT同机融合,使影像学诊断由解剖图形为主的模式向形态与生物化学结合的模式迅速发展,适应疾病分子诊断水平的发展和需要[4]。肿瘤标志物是肿瘤细胞本身合成、释放到组织或体液中或由于机体对肿瘤细胞反应而产生的一类物质。通过测定其含量可辅助诊断肿瘤、指导治疗、监测疗效、判定复发转移或预后。
研究发现,PET/CT对肺癌诊断的敏感性、特异性、准确性可达到 85%、83%、84%[5],但是由于其采像过程易受呼吸运动影响,对<5 mm的病灶易漏诊,此外诊断结果还易受阅片者的主观臆断,因此需要联合其它诊断方法。其中肿瘤标志物易普及、检验方便、价格较低等特点易被患者接受,本文就我院近3年确诊肺癌患者PET/CT检查联合肿瘤标志物检测作出统计分析。
1 资料与方法
1.1 临床资料 对2009年6月—2012年6月解放军第105医院肿瘤诊疗中心99例肺部病变患者,均行PET/CT检查和TM检测,并与病理检查结果做对照分析。计算出PET/CT检查和肿瘤标志物检测以及联合PET/CT检查和肿瘤标志物检测诊断肺癌的敏感性、特异性和准确性。其中男性54例,女性45例,年龄39~85(63.37±10.60)岁。
1.2 方法
1.2.1 病理学检查 以术后病理、纤维支气管镜活检、超声或CT引导下原发病灶穿刺活检、痰脱落细胞学或随访1年以上等为最终诊断标准。其中纤维支气管镜活检、穿刺活检、病理诊断均为我院资深医师专人操作,中级以上职称医师复核。
1.2.2 PET/CT检查 本实验仪器是由德国西门子公司生产的Biograph 40 Ttue Point PET-CT(39环PET 40排螺旋CT)。所有患者扫描前均禁食6 h以上,注药前空腹血糖≤7.0 mmol·L-1,按 3.70 ~5.55 MBq·kg-1于肘静脉注射18F-FDG,安静状态下,药物在体内分布60 min后,进行全身PET/CT检查。PET显像利用感兴趣区(ROI)技术测定病灶的最大标准摄取值(SUVmax),SUVmax>2.5判为阳性[6];CT检查时观察病灶有无毛刺、分叶、有无支气管阻塞、肺不张、远处转移等指标综合判断。
1.2.3 血清TM检测 所有患者在空腹状态下抽静脉血5 mL,以 2 500 r·min-1,离心 10 min 后分离血清。ELISA法测癌胚抗原(CEA)、糖类抗原125(CA125)、糖类抗原19-9(CA19-9)、神经元特异性烯醇化酶(NSE)、鳞状上皮细胞抗原(SCC)5种血清肿瘤标志物。
正常值参考范围:CEA <15 μg·L-1,CA125 <3.5 万 U·L-1,CA19-9 <3.7 万 U·L-1,NSE <15 μg·L-1,SCC <1.5 μg·L-1。其中一项或一项以上超出正常范围为阳性,判定为恶性。
1.2.4 PET/CT检查联合血清 TM检测 全身PET/CT检查联合血清TM检测时,其诊断标准为PET/CT检查结果阳性或者5项血清肿瘤标志物中有一项为阳性者,即可判定为恶性。
1.3 统计学方法 两种检查方法判定结果与病理诊断结果相对比,分别计算出用PET/CT检查、血清TM检测、联合运用PET/CT检查和血清TM检测对肺癌诊断的敏感性、特异性、准确性。采用SPSS 11.5统计软件进行相关分析,计量资料采用平均数±标准差(±s)表示,各组间数据比较采用方差分析,阳性率采用χ2检验方法,P<0.05为差异有统计学意义。
2 结果
2.1 病理学诊断结果 99例肺部病变患者中,经病理检查证实为肺癌的81例(其中鳞癌34例,腺癌19例,腺磷癌2例,小细胞癌22例,大细胞癌1例,其它3例),均为原发灶,且未进行任何抗肿瘤治疗;良性病变18例(其中肺炎性假瘤2例,肺结核3例,各种肺炎10例,其它3例)。
2.2 PET/CT检查对肺部病灶的诊断 单独采用PET/CT检查,99例肺部疾病患者中平均SUVmax为(9.84±6.89),典型病变见图1和图2。其中真阳性69例,假阳性4例,真阴性14例,假阴性12例。敏感性、特异性、准确性分别为85.19%(69/81)、77.78%(14/18)、83.84%(83/99)。
2.3 血清TM检测结果 单独采用血清TM检测,99例肺癌患者中CEA真阳性54例,假阳性7例,真阴性11例,假阴性27例;CA125真阳性53例,假阳性5例,真阴性13例,假阴性28例;CA19-9真阳性48例,假阳性6例,真阴性12例,假阴性33例;NSE真阳性45例,假阳性3例,真阴性15例,假阴性36例;SCC真阳性47例,假阳性4例,真阴性14例,假阴性34例。综合判定上述5种血清肿瘤标志物结果为真阳性70例,假阳性4例,真阴性14例,假阴性11例,其敏感性、特异性、准确性分别为86.42%(70/81)、77.78%(14/18)、84.85%(84/99)。
2.4 两种方法联合检查判定结果 两种方法联合检查判定结果,99例肺癌患者中真阳性78例,假阳性3例,真阴性15例,假阴性3例。敏感性、特异性、准确性分别为 96.30%(78/81)、83.33%(15/18)、93.94%(93/99),见表1。
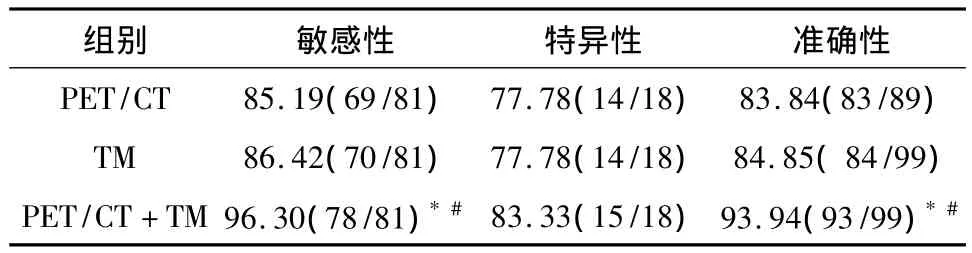
表1 PET/CT检查、TM检测、联合PET/CT检查和TM检测在肺癌诊断中的敏感性、特异性、准确性/%
3 讨论
3.1 PET/CT检查在肺癌诊断中的运用及局限性
PET/CT检查中SUV值(标化摄取值)是用以表达肿瘤组织摄取18F-FDG示踪剂定量指标,指病灶摄取18F-FDG量为全身组织平均摄取量的倍数,临床上通常取SUVmax值的大小结合CT影像学特征来鉴别恶性肿瘤与良性病变,并提示肿瘤的恶性程度,且有助于对纵隔淋巴结有无转移作出判断,避免纵膈镜等有创检查,准确分期[7]。本文对99例患者PET/CT检查结果统计分析,得出其对肺癌的敏感性、特异性、准确性分别为85.19%、77.78%、83.84%,所收集数据分析值比文献报道稍低。但是仍有部分肿瘤患者结节灶FDG呈低摄取[8],恶性肿瘤的18F-FDG的摄取率与肿瘤细胞的生长速度、局部缺氧程度以及表面葡萄糖转运蛋白浓度(Glut-1)相关,其中尤以非小细胞肺癌的18F-FDG的摄取率较其它病理类型低,表现出假阴性结果,影响了PET/CT诊断的准确率。有文献报道[9],PET/CT检查显像假阴性的主要原因与其细胞类型及分化程度有关,某些肺泡细胞癌、类癌及分化程度高的腺癌,肿瘤细胞生长缓慢,增殖活性较低,葡萄糖代谢低,导致18F-FDG在局部摄取率降低,易呈假阴性。另有文献报道[10],PET/CT检查还易形成假阳性,主要是一些良性病变如炎性假瘤、结核、结节病、霉菌感染,以及长期使用药物,其局部大量粒细胞和活性巨噬细胞聚集,导致18F-FDG在局部异常聚集,代谢增高。
3.2 血清肿瘤标志物检测在肺癌中的意义及不足
血 CEA、CA125、CA19-9、NSE、SCC 等肿瘤标志物与肺癌相对关系密切。CEA[11]是具有人类胚胎抗原特性决定簇的酸性糖蛋白抗原,是最早发现的肺癌肿瘤标记物,肺癌患者血清高于正常人,有报道称敏感性、特异性、准确性分别为45.2%、92.6%、77.4%。CA125[12]是一种相对分子量 >2 ×106的糖蛋白表面抗原,在肺癌血清中阳性率可达33.5%,其增高水平与肿瘤负荷水平有关,且检出肿瘤复发比临床早1~14月。CA19-9[13]是一种类糖脂,存在于胎儿胃肠、胰腺上皮,正常成人胃肠、胰腺、肺中浓度较低,在肺癌中有表达,当肺癌发生时,癌细胞产生的CA19-9可通过胸导管进入血循环,使血清CA19-9升高,为48.2%,但敏感性低。NSE[14-15]存在于神经组织,在神经内分泌系统相关肿瘤中明显升高,如小细胞肺癌、嗜络细胞瘤、神经母细胞瘤等,可作为小细胞肺癌的特异性和敏感性标志物。SCC[16]存在于肺、食管、咽、子宫等多部位肿瘤中,尤其以肺鳞癌阳性表达最高,为50.7%,可作为肺鳞癌预后和检测疾病进展的指标。本文联合上述5种血清肿瘤标志物检测其敏感性、特异性、准确性分别为 86.42%、77.78%、84.85%,其敏感性较文献报道较高,特异性较文献报道较低,准确性与文献报道相符,敏感性高特异性低可能与我院采用多种血清肿瘤标志物联合检测检出率高有关。
3.3 联合PET/CT检查与血清TM检测在肺癌诊断中的意义及展望 本研究可得出,联合PET/CT检查与血清TM检测对肺部恶性肿瘤诊断的敏感性、特异性、准确性分别为 96.30%、83.33%、93.94%,其敏感性及准确性与单用PET/CT组相比,P<0.05;敏感性及准确性与TM组比,P<0.05,说明本研究方法对肺癌的诊断明显优于单独采用PET/CT检查或TM检测,具有统计学意义。本研究中联合组的特异性稍高于PET/CT组及TM组,但不具备统计学意义,说明在现有条件下我们可通过新的无创诊断手段无限接近肿瘤明确诊断,但病理诊断在恶性肿瘤中的地位是无法撼动的。
因此联合PET/CT检查及检测肿瘤标志物有助于肺癌的早期诊断[17],排除单一检查假阳性和假阴性的干扰,为肺癌的辅助诊断多了一条可靠途径,尤其适用于对病理检查恐惧、排斥的患者或经病理检查失败者,此外还可作为肿瘤患者确诊后治疗疗效、病情进展、复发判定及指导治疗方案的重要依据。本研究将二者结合进行综合分析,研究结果得出联合PET/CT检查及检测肿瘤标志物检测对于肺癌早期确诊具有较高的敏感性、特异性、准确性,值得临床推广应用。
[1]徐广文,马冬春.非小细胞肺癌患者血清CA21-1、CEA、NSE手术前后表达水平变化及意义[J].安徽医药,2013,17(3):415 -416.
[2]韩 雪,李亚明,李雪娜.18F-FDG PET-CT在肺结核诊断中的研究进展[J].首都医科大学学报,2013,34(1):49 -52.
[3]丁重阳,黄庆娟,李天女,等.18F-FDG PET/CT显像诊断肺癌的价值[J].南京医科大学学报(自然科学版),2010,30(2):191 -194.
[4]Cappabianca S,Porto A,Petrillo M,et al.Preliminary study on the correlation between grading and histology of solitary pulmonary nodules and contrast enhancement and[18F]Fluorodeoxy glucose standardised uptake value after evaluation by dynamic multiphase CT and PET/CT [J].J Clin Pathol,2011,64(2):114.
[5]张曙光,宋平平,张百江.PET/CT在肺癌治疗应用价值研究的现状[J].中华肿瘤防治杂志,2013,20(5):392 -395.
[6]杨 鹏,龚静山,陈立光,等.双时相18F-FDG PET鉴别诊断肺内良恶性病变的价值[J].中国医学影像技术,2011,27(10):2017 -2020.
[7]李向东,尹吉林,柳伟坤,等.PET/CT对评价非小细胞肺癌纵膈淋巴结转移的诊断价值[J].南方医科大学学报,2010,30(3):506-508.
[8]李文婵,姚稚明,屈婉莹,等.SUV小于2.5的孤立性肺结节18F-FDGPET/CT 诊断价值初探[J].医学研究杂志,2011,40(9):47-51.
[9]郑大东,钟 勇.肿瘤标志物及PET未见异常的肺癌1例[J].东南国防医药,2012,14(1):70 -71.
[10]江吕泉,高坤祥,郑 健,等.PET-CT联合检测肿瘤标志物对肺癌术后随访的价值[J].武警医学,2011,22(9):744 -749.
[11]陈 玉,汪伟民.老年肺癌患者血清CEA、NSE、CYFRA21-1检测的临床意义[J].安徽医科大学学报,2010,45(3):411 -414.
[12]崔永琴.检测血清CA125对恶性肿瘤的诊断价值[J].中国现代药物应用,2010,4(4):96 -97.
[13]宋志军,吴广平.CA724和CA199在肺癌患者临床诊断意义[J].中国医药指南,2011,9(19):18 -19.
[14]吴在德.肿瘤标志物在肺癌联合诊断的临床应用分析[J].安徽医药,2013,17(5):793 -795.
[15]马开慧,金 晔,王 炜.四项肿瘤标志物联合检测在肺癌辅助诊断中的应用价值[J].中国实验诊断学,2012,16(12):2288 -2289.
[16]曾聪,全国莉,王春莲.联合检测6种血清肿瘤标志物在肺癌诊断中的意义[J].广东医学,2012,33(6):808 -810.
[17]张铁梅,张连民,刘 洋,等.18F-FDG PET/CT联合肿瘤标志物对肺癌的诊断价值及SUVmax的临床意义[J].中华医学杂志,2012,92(41):2901 -2904.
