光谱法研究羧甲基壳聚糖与牛血清白蛋白的相互作用
2015-12-09葛杏莉夏彩芬
葛杏莉,贾 弦,汪 鑫,齐 炎,夏彩芬
(湖北工程学院 化学与材料科学学院,湖北 孝感 432000)
光谱法研究羧甲基壳聚糖与牛血清白蛋白的相互作用
葛杏莉,贾弦,汪鑫,齐炎,夏彩芬*
(湖北工程学院 化学与材料科学学院,湖北 孝感 432000)
摘要:采用荧光光谱法、紫外光谱法、红外光谱法和圆二色谱法研究了羧甲基壳聚糖(CMCS)与牛血清白蛋白(BSA)的相互作用过程及机理。研究结果表明,CMCS对BSA的内源荧光有猝灭作用,且为静态猝灭;紫外光谱分析表明,CMCS与BSA分子发生了相互作用,形成了基态复合物;圆二色谱和红外光谱分析结果表明,CMCS与BSA中肽键发生作用,α-helix结构含量发生改变,使BSA二级结构发生变化;三维荧光的实验结果表明,当在BSA中加入CMCS后,分子全局的内源荧光强度明显降低;同步荧光和位点竞争实验结果表明,CMCS与BSA 的结合位点更接近于色氨酸残基,结合部位为Site I。
关键词:羧甲基壳聚糖;牛血清白蛋白;荧光光谱法;圆二色谱法;紫外光谱法
中图分类号:O636.1
文献标志码:码:A
文章编号:号:2095-4824(2015)03-0005-07
收稿日期:2015-03-25
基金项目:湖北工程学院生物质资源转化利用湖北省协同创新中心项目(XTCX041)
作者简介:葛杏莉(1962-),女,湖北通城人,湖北工程学院化学与材料科学学院实验师。
通讯作者夏彩芬(1979-),女,湖北武汉人,湖北工程学院化学与材料科学学院讲师,博士,本文。
Abstract:The interaction process and mechanism between carboxymethyl chitosan (CMCS) and bovine serum albumin (BSA) are investigated by means of fluorescent spectrometry, ultraviolet spectroscopy, infrared spectroscopy, and circular dichroism (CD). And it is found that the fluorescence quenching of BSA accorded with the CMCS concentration-dependent. And the Stern-Volmer curve of the fluorescence quenching of BSA by CMCS shows that the mechanism is mainly static quenching. The UV indicates that the BSA molecules are combined with the CMCS, forming a complicated ground-state. The analytical results with the CD and infrared spectroscopy indicate that the peptide bonds within the CMCS and the BAS are affected each other and the α-helix content of BSA is changed with CMCS by CD, leading to the changes of secondary structure in the BSA. The experimental result with three-dimension fluorescence shows that the strength of overall intrinsic fluorescence is significantly reduced when the CMCS is added into the BAS. The results with the synchronous fluorescence and the site competition suggest that the binding sites between the CMCS and the BSA are more close to tryptophan residues, where the binding sites are located at Site I.
贾弦(1991-),女,湖北荆州人,湖北工程学院化学与材料科学学院学生。
羧甲基壳聚糖(CMCS)是壳聚糖的高级衍生物之一。近年来,由于羧甲基壳聚糖在药物载体体系、组织工程及生物改良支架等方面具有广泛的应用前景,已成为发展迅速的一种生物医用材料[1-3]。
CMCS是由壳聚糖衍生而来的一种两亲性醚,与壳聚糖相比,有更好的水溶性、更优异的生物相容性、可控生物降解性、成骨能力及一些其他优秀的物理化学、生物学性能[4-5]。更为独特的是,CMCS可负载疏水性药物并显示出良好的生物活性,这种优良特性使其在生物医用材料领域有望成为明星材料,它不仅可作为药物载体,也可制备无纺布、流延膜、涂层纱布、止血海绵、术后防粘连材料等多种医用敷料。
作为具有重要应用前景的生物医用材料,CMCS一旦作用于生命体系,必然会与体内生物大分子发生相互作用。尽管目前CMCS用于大分子检测方面的研究已有相关报道[6-7],但多是从体系是否符合经典的Stern-Volmer方程线性相关来做出判断,显然并不全面系统。血清白蛋白常作为代表性蛋白质用于生物医用材料领域的研究[8],它可以与许多外源性物质(如有机小分子、金属离子等)结合,在生物体内起到存储与转运作用[9],是科学研究中经常使用的药物靶标蛋白之一[10]。
本文主要利用多种光谱联合使用的手段研究近似生理条件下CMCS与牛血清白蛋白(BSA)的相互作用,探讨CMCS-BSA体系的猝灭作用机理、结合模式、结合部位等内容,并深入考察了CMCS对BSA二级结构的影响以及两者结合点的部位。
1 材料与方法
表1是试验所用的主要试剂。

表1 实验试剂
1.2 主要实验仪器

表2是试验中所用的主要仪器。
1.3 实验方法
1.3.1 荧光光谱法
①荧光变温实验:配制4×10-3mol/L的CMCS溶液。以280 nm为激发波长,先测试BSA(1×10-5mol/L)的荧光吸收光谱,再依次加入一定量的CMCS溶液,分别测试293 K、298 K、303 K时各体系的荧光吸收光谱,根据所得数据计算猝灭常数和结合常数。
②位点竞争实验:采用荧光光谱法,固定BSA的浓度,向BSA-CMCS体系中分别加入一定量的华法林和布洛芬,以280 nm为激发波长,绘制研究体系的荧光光谱,根据所得数据判断结合位点。
③三维荧光光谱:分别扫描BSA和BSA-CMCS体系的三维荧光光谱,初始激发波长选择280 nm,在200~400 nm之间记录发射光谱,选择间距为10 nm,扫描次数为20次。
④同步荧光试验:采用荧光光谱法,固定BSA的浓度,逐次加入等量CMCS溶液,分别测试Δλ= 15 nm 和Δλ= 60 nm下的荧光光谱图。
1.3.2 紫外光谱法
分别测试BSA和BSA-CMCS体系的紫外光谱,其中 BSA-CMCS体系中CMCS浓度为梯度分布。
1.3.3 红外光谱法
用傅立叶红外光谱仪分别测试CMCS与CMCS-BSA体系的在室温下的FTIR图谱。其中CMCS-BSA体系预先在2~8 ℃下温浴1 h而得,分别测试各体系的红外光谱。
1.3.4 圆二色谱法
测定20 ℃下BSA和CMCS-BSA体系的远紫外圆二色谱,分析CMCS作用前后BSA二级结构变化。
2 分析与讨论
2.1 CMCS与BSA相互作用的稳态荧光分析
BSA分子中色氨酸和酪氨酸残基是其内源荧光的主要来源,当激发光波长为280 nm时,在340 nm附近有很强的荧光峰;而CMCS在340 nm 处没有荧光特性(图1中未标出),表明CMCS不会产生与BSA相互影响的荧光。本实验中,设定BSA的浓度为1.0×10-5mol/L,随着体系中CMCS用量的增加,BSA的内源荧光发生显著的猝灭现象,实验结果如图1所示。
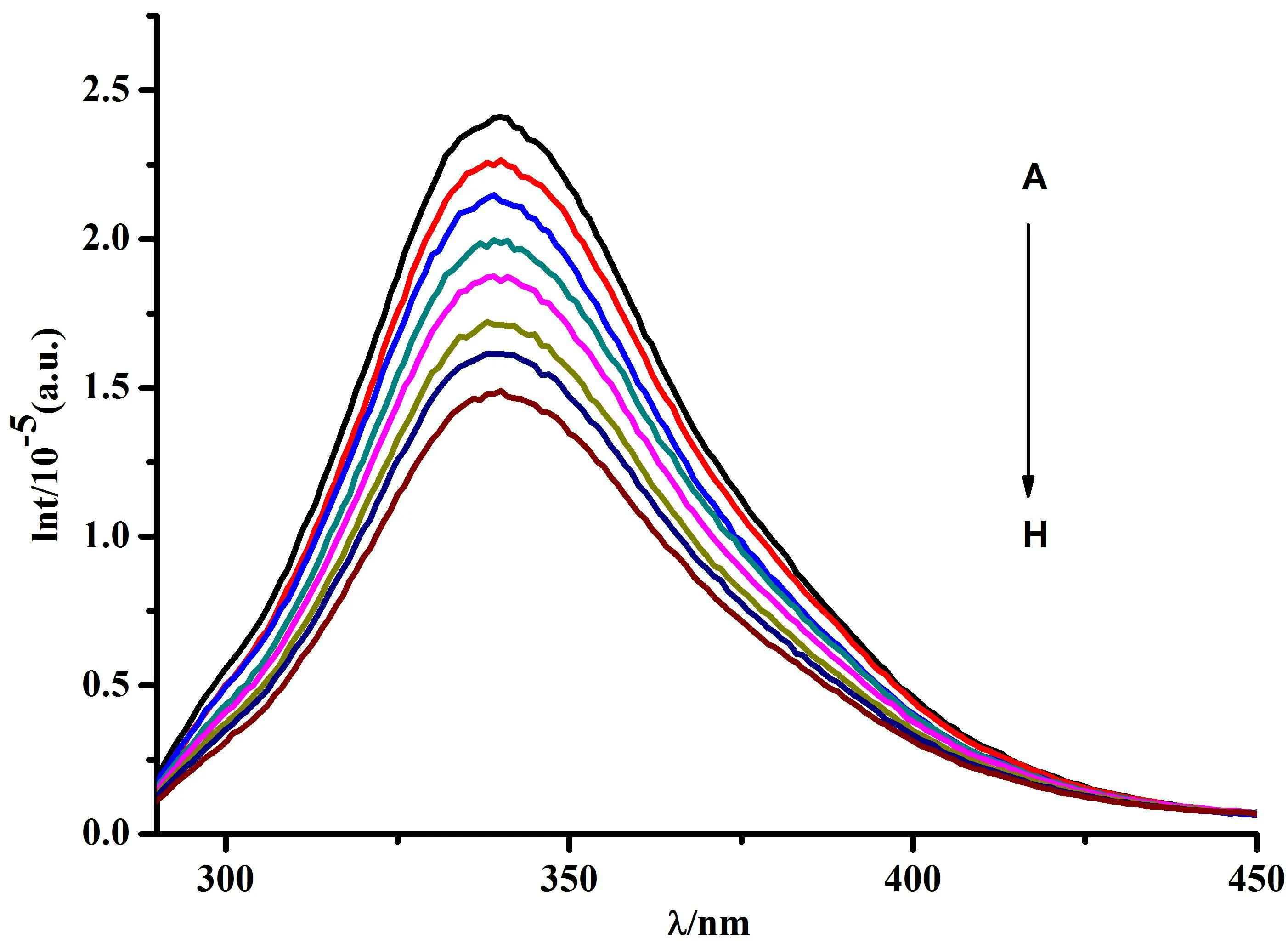
图1 CMCS对BSA荧光光谱的影响(T=298 K)
由图1结果可知,在BSA中加了CMCS后,BSA的荧光强度显著降低,表明CMCS对BSA的内源荧光有猝灭作用,且猝灭作用显示出明显的CMCS浓度依赖性。
2.2 CMCS与BSA相互作用的猝灭类型
2.2.1 变温荧光实验
为研究荧光的猝灭机理,通常将猝灭过程分为动态猝灭和静态猝灭来讨论[11]。整体而言,任何一个猝灭过程均是包含动态和静态猝灭的混合过程,可用如下方程来描述:
(1)
式中:F代表体系中存在猝灭剂时体系的荧光强度,F0代表不存在猝灭剂时体系的荧光强度:KD与KS分别为动态与静态的猝灭常数,[Q]是猝灭剂的浓度[12-14]。
若猝灭过程表现为静态猝灭(动态部分可忽略),即猝灭剂与荧光物质在基态时生成较稳定的不产生荧光的复合物,从而导致荧光强度降低,则式(1)变为:
(2)
式中:Ksv是静态猝灭常数。
由公式(1)和(2)可知,在猝灭剂合适的浓度范围,静态猝灭过程中F0/F 与浓度[Q]之间应存在线性关系。通常,判断猝灭方式的本质可通过变温荧光实验得出。对于动态猝灭,其猝灭常数会随着温度升高而增大,而温度升高可能导致基态配合物稳定常数(Ksv)下降,从而削弱静态猝灭的程度。因此,可以通过考察不同温度下BSA的Ksv变化来区分猝灭类型。为此,实验中检测了不同温度(293K、298K和303K)时,CMCS对BSA的荧光猝灭情况,结果如图2所示。

图2 不同温度时CMCS与BSA相互作用的猝灭常数
根据公式(2),以(F0-F)/F对[Q]作图,发现在293 K时,CMCS与BSA的相互作用猝灭常数Ksv= 3.80×103L/mol;在298 K时,Ksv= 3.25×103L/mol;在303 L/mol;在298 K时,Ksv= 3.25×103L/mol;在303 K时,Ksv=2.73×103L/mol。该结果表明,随着温度的升高,CMCS与BSA的相互作用猝灭常数Ksv随着体系温度的升高呈现规律性的减小,由此推断CMCS对BSA的猝灭过程符合静态猝灭特征。
2.2.2 CMCS与BSA相互作用的结合常数
CMCS对BSA的猝灭过程具有静态猝灭特征,因此其实验数据可用修正的Stern-Volmer方程处理[15]:
(3)

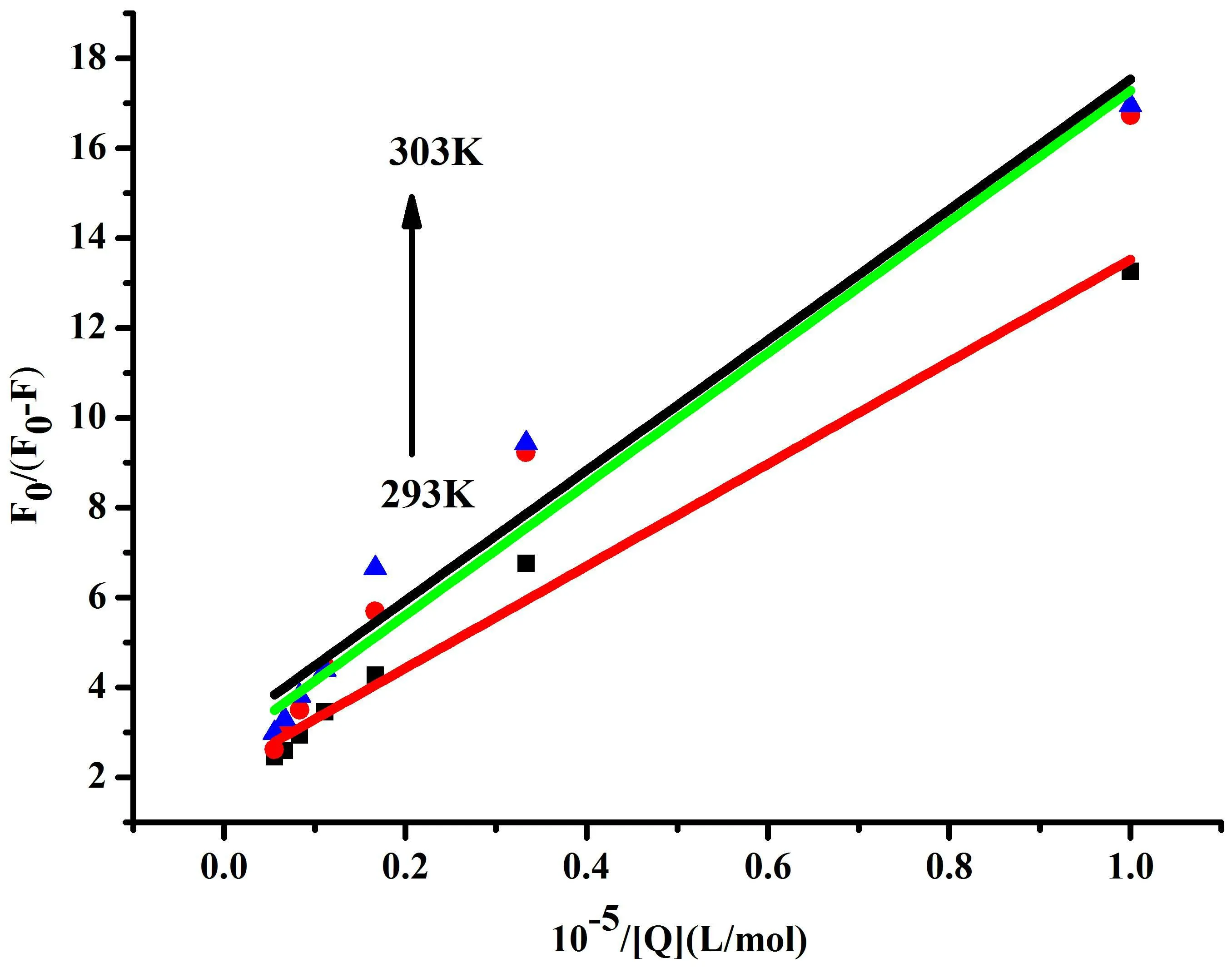
图3 CMCS猝灭BSA荧光的关系图
根据公式(3), 对1/[Q]作图,线性拟合后Ka分别为1.84×104mol/L (293 K)、1.90×104mol/L(298 K)、2.09×104mol/L(303 K),结果如图3所示。图3的结果表明,随着温度升高,CMCS-BSA体系结合常数呈增大趋势,这一结果符合CMCS对BSA的静态猝灭机理。
2.2.3 紫外光谱分析
文献[15]表明:动态分子只在荧光分子处于激发态时才存在,因而猝灭剂对荧光分子的紫外可见吸收光谱一般不产生影响;而静态猝灭则涉及基态复合物的生成,该复合物一般会使荧光分子的吸收光谱发生改变[16-17]。据此,本文又设计了CMCS对BSA的紫外吸收光谱的影响,结果如图4所示。
从图4的结果可以看出,BSA分子在280 nm处有很强的吸收峰,当把CMCS加入BSA中时,其紫外图谱在280 nm处的吸收增强,且发生微弱蓝移,说明CMCS与BSA分子间发生了作用,形成基态复合物,进一步证明了其猝灭类型为静态猝灭。

图4 CMCS对BSA紫外光谱的影响(T=298 K)
综合以上变温荧光和紫外光谱的分析结果,可以判定CMCS对BSA的猝灭过程符合静态猝灭特征。
2.3 CMCS对BSA二级结构的影响
2.3.1 红外光谱分析
BSA分子中肽键(-NHCO-)的特征振动谱带、主链骨架及侧链的振动谱带等都能通过红外光谱进行表征。-NHCO-的结构环境是蛋白质主链构象的重要反映,也是其能正常发挥生理功能的重要依据[13]。因此,可以根据-NHCO-的特征振动谱带来推测BSA的主链构象。本实验中也检测了CMCS存在时BSA结构的变化,结果如图5所示。
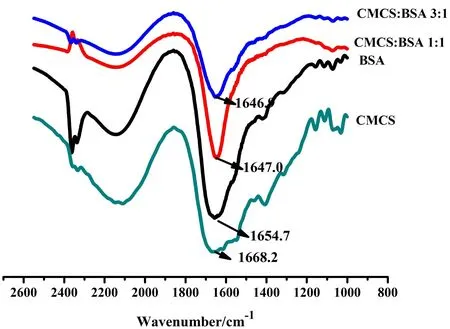
图5 CMCS与BSA相互作用的FTIR图
从图5的结果可以看出,BSA分子中的肽键在1 644.0 cm-1处有很强的吸收,当把CMCS溶液加入到BSA中时,其红外图谱在1 647.0 cm-1处的吸收峰变窄,吸收减弱,且发生了蓝移,说明CMCS与BSA分子的肽键发生了相互作用。波数在1 650~1 658 cm-1处的峰面积代表蛋白质中α-helix的含量[12],可知在CMCS存在的情况下,BSA中α-螺旋的含量有所减少。
根据以上分析结果,可以推断CMCS与BSA分子的肽键发生了作用,其相互作用过程中使BSA的二级结构发生了变化,即α-helix含量减少。
2.3.2 圆二色谱分析
圆二色谱(CD)在研究蛋白质结构方面具有独特的优势,不仅可以在接近生理条件下对蛋白质实行低浓度、无损伤的分析,为蛋白质的构象变化提供相关信息,而且还可以定量推算出其分子中ɑ-helix、β-fold以及无规则卷曲的含量等。因此,该方法在蛋白质立体结构分析中具有广泛的应用前景,成为解析蛋白质构象变化的有效方法。为了进一步验证CMCS对BSA构象变化的影响,本实验中还考察了BSA、CMCS-BSA两个体系中CD谱的变化,实验结果如图6所示。
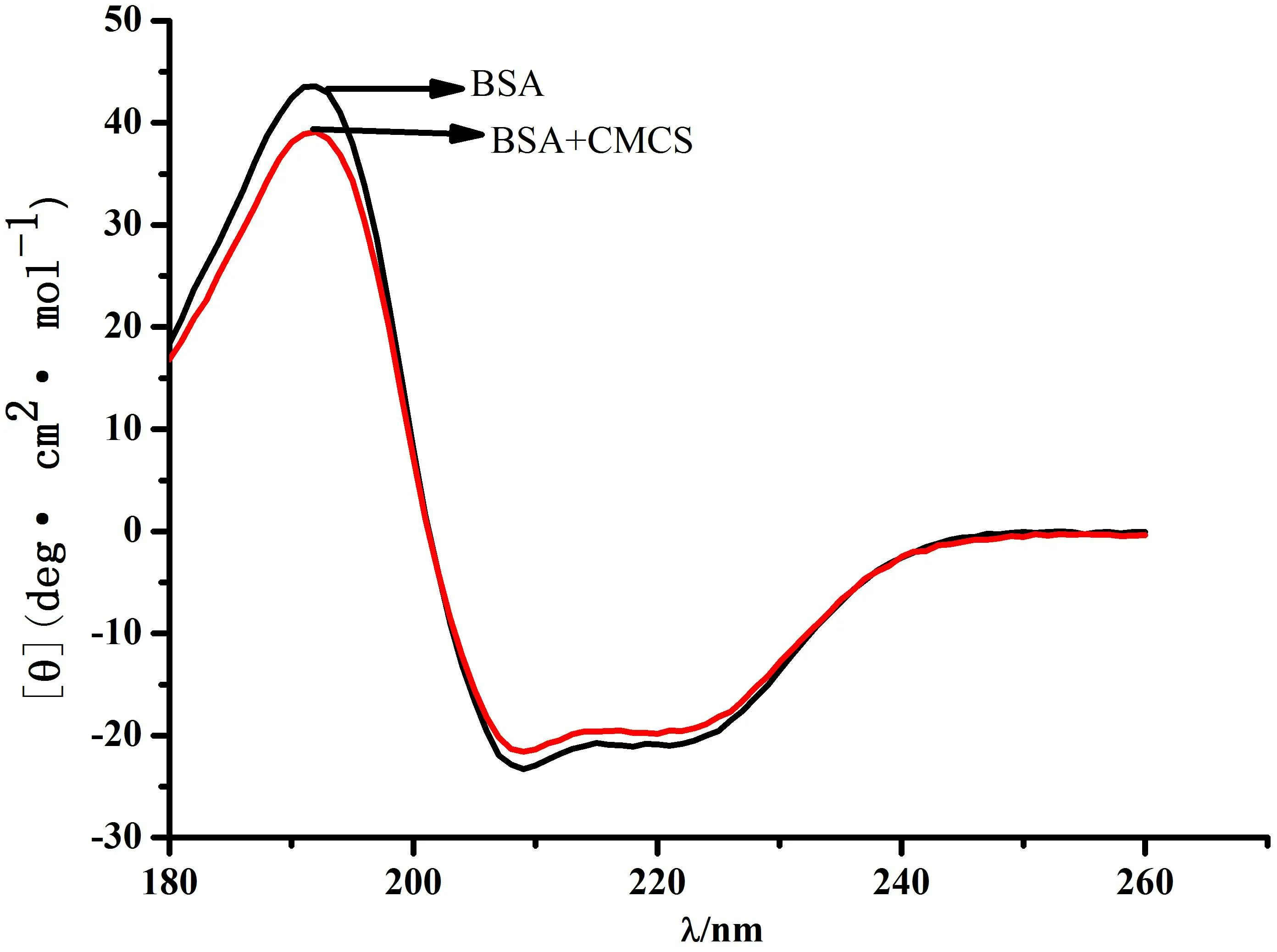
图6 CMCS与BSA相互作用的CD谱
从图6中的结果可知,BSA分子的CD谱是双负峰形的,分别位于208 nm和222 nm处,随着CMCS加入到BSA中,BSA分子在208 nm和222 nm这两处的负峰振幅缓慢降低,表明BSA分子的二级结构发生了改变,ɑ-helix含量出现减少现象,该结果与前述FTIR的分析一致,表明BSA分子的肽链结构在CMCS的作用下有所伸展。
2.3.3 CMCS与BSA的同步荧光分析
同步荧光光谱可以反映外源物对蛋白质构象变化的影响。Δλ=60 nm 的同步荧光谱代表着色氨酸残基的光谱特征,而Δλ=15 nm 的同步荧光谱则显示出酪氨酸残基的光谱特征。由于芳香氨基酸残基的λem与其所存在环境的极性有关联,因此,蛋白质构象的改变可由λem的变化来进行判断[15]。
图7(Δλ = 60 nm)的结果表明,在固定BSA 浓度时,随着CMCS浓度的逐渐增加,BSA荧光强度逐渐降低,λem也略有蓝移,表明色氨酸残基所处的微环境疏水性缓慢增加,其亲水性逐渐降低。图8(Δλ = 15 nm)显示,随着CMCS浓度的增加,BSA荧光强度与稳态荧光结果(见图1)相比没有变化。由图8和图9结果可知,同步谱中色氨酸残基荧光强度的降低程度比酪氨酸残基的更加明显。因此,可以推测CMCS与BSA的结合位点更趋近于色氨酸残基。
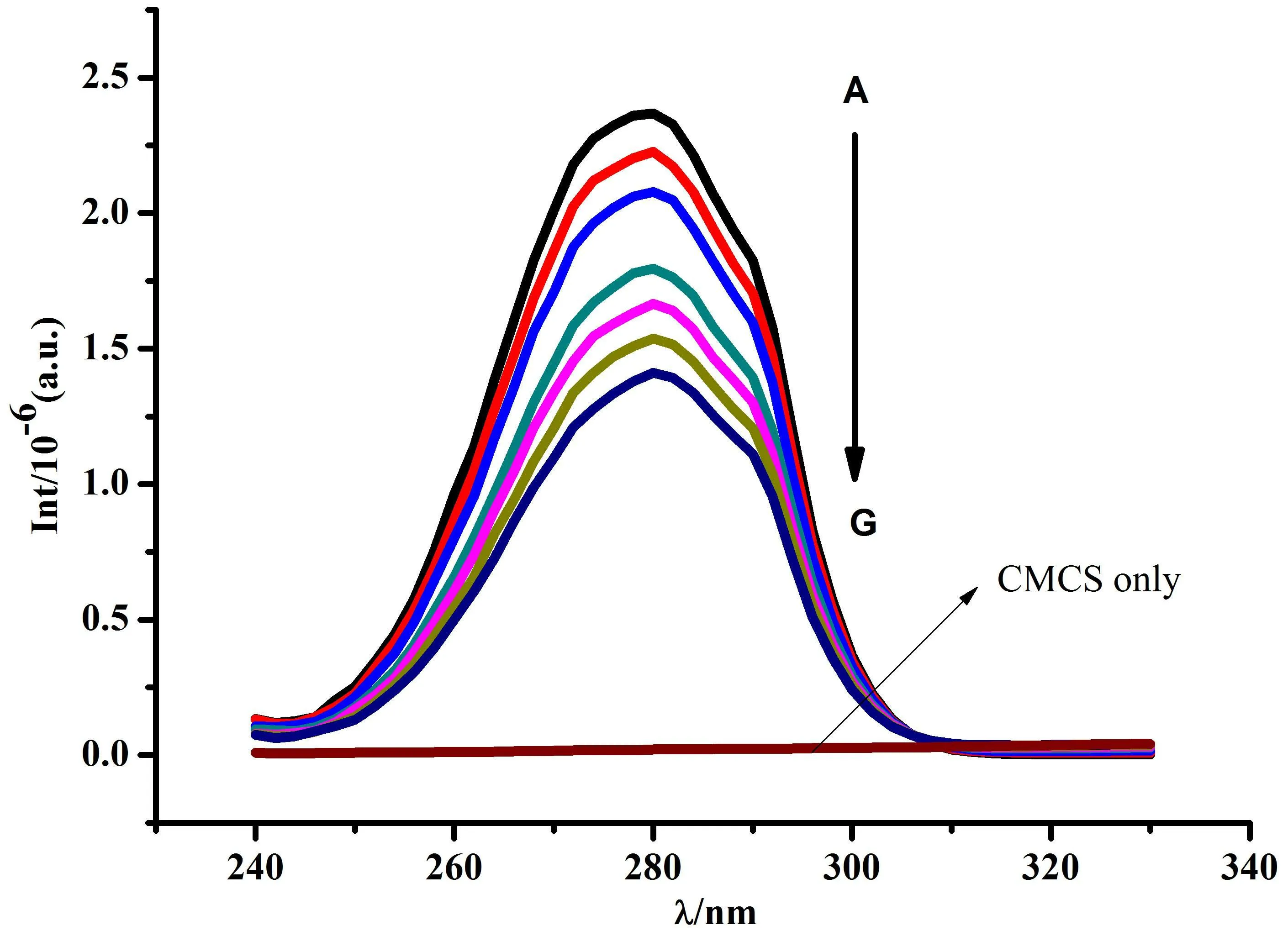
图7 Δλ=60 nm时CMCS-BSA体系的同步荧光光谱
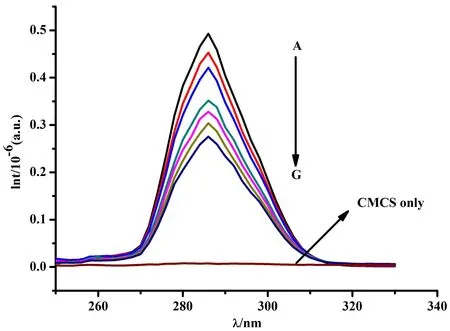
图8 Δλ=15 nm时CMCS-BSA体系的同步荧光光谱
2.4 CMCS作用于BSA体系的三维荧光光谱
三维荧光光谱不仅能够直观地体现蛋白质分子在不同条件下的构象(微环境)变化,而且可以全面显示出待测物的荧光信息,据此可以得到更加科学可靠的蛋白质特征构象变化信息。
BSA的三维荧光图谱如图9(a)所示。可以看出,当在BSA中加入CMCS后,其强度则明显降低,这是由于与BSA发生静态猝灭导致体系的荧光强度全面下降的结果。上述结果表明在BSA中加入CMCS后,分子全局的内源荧光强度明显降低。
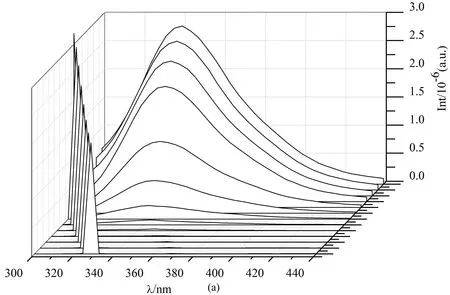
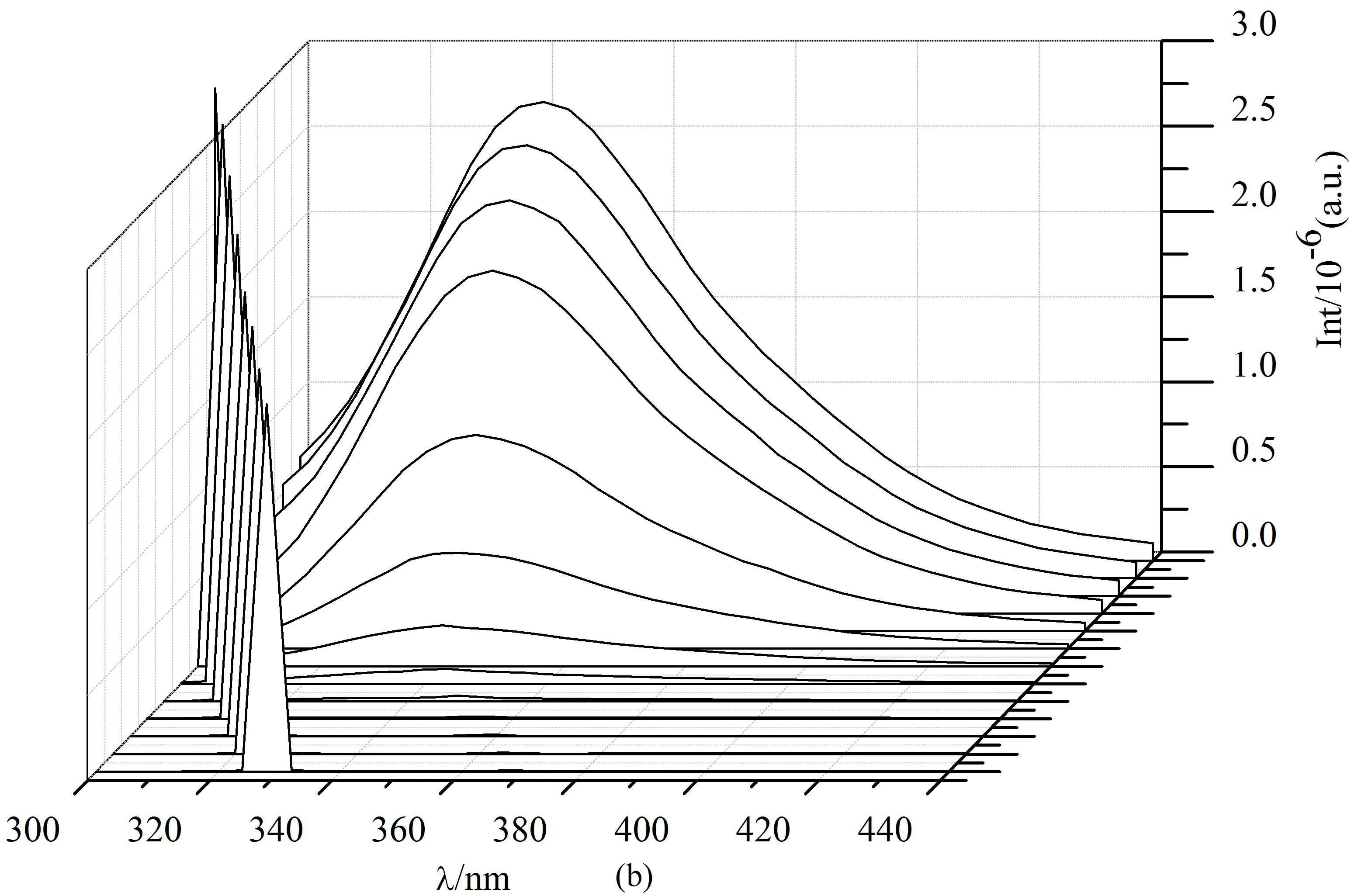
图9 CMCS作用于BSA体系的三维荧光光谱
2.5 CMCS与BSA结合部位的确定
为明确CMCS与BSA相互作用的结合位点,本实验设计并检测了位点标记物布洛芬(ibuprofen)和华法林(warfarin)对CMCS-BSA体系的影响。
从X-射线结晶学研究结果得知,标记物华法林(warfarin)的结合位点位于亚结构域IIA(site I),而布洛芬(buprofen)的结合位点位于亚结构域IIIA(site II)处[18-19]。本实验通过检测标记物存在时CMCS与BSA作用体系的荧光强度的变化,从而确定CMCS的结合位点。
由图10可知,向BSA溶液中加入布洛芬后荧光强度有所下降,依次向BSA与布洛芬体系混合液中逐渐滴加CMCS,体系的荧光强度有规律地下降,此时荧光谱与不存在布洛芬时大致相同。相比而言,华法林的存在对CMCS-BSA体系的荧光强度的影响较为明显(见图11)。当加入过量的华法林后BSA溶液的荧光强度显著下降,向混合液中连续滴加CMCS,荧光强度缓慢降低,其荧光强度远小于不存在华法林时的荧光强度。上述现象表明,华法林对CMCS-BSA体系的荧光强度的影响较大,而布洛芬对其几乎没有影响。由此可以推断,华法林与CMCS竞争同一个位点,CMCS在BSA上的主要结合位置为Site I。

图10 布洛芬对CMCS-BSA体系的影响
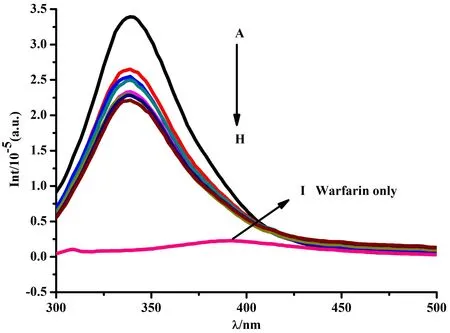
图11 华法林对CMCS-BSA体系的影响
3 结论
本文采用荧光光谱法、紫外光谱法、圆二色谱法和红外光谱法系统考察了CMCS与BSA的相互作用方式及机理。研究结果表明,CMCS可使BSA的内源荧光发生猝灭,且猝灭作用表现出对CMCS浓度的依赖性,猝灭过程符合静态猝灭机理。进一步研究还发现,BSA经CMCS作用后,其二级结构发生变化,α-helix的含量有所减少,同步荧光光谱和位点竞争的实验证实了CMCS与BSA的结合位点更接近于色氨酸残基,具体结合位置为BSA的亚结构域IIA (Site I)处。
[参考文献]
[1]Upadhyaya L,Singh J,Tewari R P,et al.The implications of recent advances in carboxymethyl chitosan based targeted drug delivery and tissue engineering applications[J].Journal of Controlled Release,2014,186:54-87.
[2]Maya S,Kumar L G,Sarmento B,et al.Cetuximab conjugated O-carboxymethyl chitosan nanoparticles for targeting EGFR overexpressing cancer cells[J].Carbohydrate Polymer,2013,93:661-669.
[3]Zou A,Chen Y,Huo M,et al.In vivo studies of octreotide-modified N-octyl-O,N-carboxymethyl chitosan micelles loaded with doxorubicin for tumor-targeted delivery[J].Journal of Pharmaceutical Sciences, 2013,102:126-135.
[4]Jayakumar R,Prabaharan M,Nair S V,et al.Novel carboxymethyl derivatives of chitin and chitosan materials and their biomedical applications[J].Progress in Materials Science, 2010,55:675-709.
[5]Lin Q,Lan X,Lu C,et al.Anti-washout carboxymethyl chitosan modified tricalcium silicate bone cement:preparation,mechanical properties and in vitro bioactivity[J].Journal of Materials Science - Materials in Medicine, 2010,21:3065-3076.
[6]李小芳,冯小强,黄晨亮,等.羧甲基壳聚糖-Ag配合物与鲱鱼精DNA的相互作用[J].化学通报,2014,77(3):285-288.
[7]冯小强,李小芳,苏中兴,等.O-羧甲基壳聚糖稀土配合物的制备及与牛血清白蛋白的作用[J].分析实验室,2010,29(11):5-8.
[8]郑彩虹,梁文权,虞和永.海藻酸-壳聚糖-聚乳酸羟乙醇酸复合微球的制备及其对蛋白释放的调节[J].药学学报,2005,40(2):182-186.
[9]魏永巨,李克安,童沈阳.溴甲酚绿与血清白蛋白的结合反应[J].分析化学,1996,24(4):387-391.
[10]玄光善,吴效楠,李玉平.荧光光谱法研究乙酰水杨酸和牛血清蛋白的相互作用[J].光谱实验室,2005,22(7):861-864.
[11]赵玉清.白藜芦醇、补骨脂及熊果酸与蛋白质的相互作用[D].武汉:中南民族大学,2009.
[12]蔡雪梅,刘冷,李建晴.金属离子对一种ICT荧光探针与人血清白蛋白作用的影响[J].晋中学院学报,2010,27(3):43-45.
[13]Qin Y,Zhang Y X,Ye L,et al.A comparison study on the interaction of hyperoside and bovine serum albumin with Tachiya model and Stern-Volmer equation[J].Spectrochimica Acta Part A:Molecular and Biomolecula Spectroscopy,2010,75:1506-1510.
[14]赵晓飞,徐靖源,谢承志,等.两个多吡啶铜配合物与人血清蛋白的相互作用[J].天津医科大学学报,2013,19(4):279-281.
[15]胡艳军.生物活性小分子与蛋白质和DNA相互作用的研究[D].武汉:武汉大学,2007.
[16]Naik P N,Chimatadar S A,Nandibewoor S T.Interaction between a potent corticosteroid drug-dexamethasone with bovine serum albumin and human serum albumin:a fluorescence quenching and fourier transformation infrared spectroscopy study[J].Journal of Photochemistry and Photobiology B:Biology, 2010,100:147-159.
[17]Hu Y J,Liu Y,Xiao X H,et al.Investigation of the interaction between berberine and human serum albumin[J].Biomacromolecules,2009,10:517-521.
[18]Li D. BSA-stabilized molecular hydrogels of a hydrophobic compound[J]. Nanoscale, 2012, 4(10):3047-3049.
[19]张国文,王安萍,蒋婷.山姜素与人血清白蛋白相互作用的荧光光谱法研究[J].光谱学与光谱分析,2008,28(4):908-911.
Study on Interaction of Carboxymethyl Chitosan and Bovine Serum Albumin by Spectrometry
Ge Xingli, Jia Xian,Wang Xin,Qi Yan,Xia Caifen*
(SchoolofChemistryandMaterialsScience,HubeiEngineeringUniversity,Xiaogan,Hubei432000,China)
Key Words:carboxymethyl chitosan; bovin serum albumin; fluorescent spectrometry; circular dichroism; ultraviolet spectrometry
(责任编辑:张凯兵)
