桔小实蝇超氧化物歧化酶基因SOD3的克隆及表达分析
2015-12-09申建梅陈炳翰廖泓之柳建良胡黎明
申建梅,陈炳翰,李 森,廖泓之,柯 智,柳建良,胡黎明
(仲恺农业工程学院植物保护系,广州 510225)
生物体多种生理代谢中都会生成一种超氧阴离子自由基(·O2)-的中间产物。(·O2)-是活性氧的一种,具有极强的氧化能力,是生物氧毒害的重要因素之一。超氧化物歧化酶(Superoxide Dismutase,EC1.15.1.1,SOD)是机体内天然存在的超氧自由基清除因子(Bannister et al.,1987)。该酶是一种含有金属元素的蛋白酶,广泛分布于各种生物体内。SOD 按照与其结合的金属辅基的不同,主要可分为3种,分别为:Cu/Zn SOD、Mn SOD、Fe SOD (Weisiger and Fridovich et al.,1973)。在生物体内,SOD 把有害的超氧自由基转化为过氧化氢后,进一步在过氧化氢酶(CAT)和过氧化物酶(POD)的作用下分解为完全无害的水而使生物细胞内核酸、蛋白、脂质等生物大分子免受损害(Fridovich,1995)。因此,SOD 在昆虫的生命活动中具有重要作用,对其开展深入研究可为害虫控制提供新的作用靶标。
桔小实蝇Bactrocera dorsalis (Hendel)属双翅目Dipter 实蝇科Tetriphitedae,该虫主要危害番石榴、蓝莓、杨桃、桃、芒果、柑桔、李、枇杷等多种水果(Alyokhin et al.,2001;Nakahara et al.,2008)。目前,桔小实蝇的防治主要以化学农药为主,但目前桔小实蝇已对多种化学农药产生抗性,并且化学农药也对水果的品质造成了严重的影响(Hsu and Feng,2000)。因此,寻找新的药物作用靶标,设计新型桔小实蝇控制剂是减少化学农药使用进而提高水果品质的重要措施之一。
为更好地从分子生物学角度研究Cu/Zn SOD基因在桔小实蝇生命活动中的重要作用,本研究在从噬菌体文库获得桔小实蝇Cu/Zn SOD 部分核苷酸序列的基础上,克隆获得桔小实蝇Cu/Zn SOD基因序列,采用半定量分析方法分析大肠杆菌对Cu/Zn SOD 表达的影响,进一步揭示了桔小实蝇Cu/Zn SOD 的生理功能,本结果将为设计以Cu/Zn SOD 蛋白为靶标的桔小实蝇控制剂提供科学依据。
1 材料与方法
1.1 材料
1.1.1 供试昆虫 桔小实蝇由仲恺农业工程学院昆虫学实验室采用人工饲料饲养 (袁盛勇等,2006)。
1.1.2 试剂 RNA 提取试剂盒(6733-2)购于Omega 公司,5'-RACE 试剂盒购于Invitrogen 公司,pMD20-T 克隆载体、反转录系统、ExTaq DNA 聚合酶及SYBR Premix ExTaq 荧光试剂,均购于TaKaRa 公司,核酸琼脂糖凝胶回收试剂盒购于Tiangen 公司。
1.2 桔小实蝇RNA 的提取和反转录
按照RNA 提取试剂盒使用说明提取桔小实蝇不同发育时期的总RNA。经琼脂糖凝胶电泳和紫外分光光度计检测后,按照反转录系统说明书以Oligo-dT (引物序列见表1)为引物反转录获得cDNA,并以此作为PCR 和荧光定量PCR 反应的模板。
1.3 BdorSOD 基因的克隆及序列分析
1.3.1 引物设计与合成 根据噬菌体文库中测序得到的BdorSOD 基因的EST 序列(该序列为ORF 的中间序列),设计2 条基因特异引物(B-SOD-51和B-SOD-52)(序列见表1),分别与GeneRacer 5'Primer 和GeneRacer 5' Nested Primer搭配,用以扩增BdorSOD 基因5'端序列;再根据序列拼接结果设计1 条特异性引物(B-SOD31)(序列见表1)与Oligo-dT 搭配,用于扩增BdorSOD 基因的3'序列。所有引物均由广州英骏生物技术有限公司合成。
1.3.2 PCR 扩增与RACE 反应 以合成的cDNA为模板,加入10×ExTaq 聚合酶反应缓冲液5 μL(含Mg2+),正向和反向引物各1 μL (10 μmol/L),dNTP 4 μL (2.5 mmol/L),ExTaq DNA 聚合酶0.25 μL (5 U/μL),加ddH2O 至50 μL,轻微涡旋混匀并离心(3000 rpm/min,5 s)后进行PCR扩增。反应程序为:94℃变性3 min;94℃30 s,61℃45 s,72℃1 min 34 个循环,循环完毕后,72℃保温10 min。RACE 反应体系及程序参照试剂盒说明书。扩增产物用1.0%琼脂糖凝胶电泳检测,回收目的片段。

表1 本研究中所用的引物Table 1 Primers used in this study
PCR 及RACE 产物经回收纯化后连接到pMD-20 载体,进一步转化到感受态大肠杆菌DH5α中,经氨苄青霉素和蓝白斑筛选,扩大培养重组质粒,提取质粒DNA,交由广州英骏生物技术有限公司测序。利用Blast 在NCBI 网站进行序列相似性比对分析,采用Megalign 程序中的Jotun Hein方法进行序列进化关系分析。
1.4 大肠杆菌诱导前后的半定量分析
桔小实蝇化蛹48 h 后,采用Dang 等人的方法用大肠杆菌Escherichia coli DH5α 感染诱导。处理24 h、48 h 后取样,样品迅速置液氮中冷却后保存于-80℃冰箱备用。以桔小实蝇actin 基因为参照基因(扩增引物见表1 BactF 、BactR)对大肠杆菌感染引起的SOD 基因(扩增引物见表1,SOD ORF1 及SOD ORF2)表达量变化进行半定量分析。
1.5 BdorSOD 蛋白三维结构建模
采用SWISS-MOLDLE 软件对BdorSOD 蛋白进行三维结构的模建(Arnold et al.,2006)。
2 结果与分析
2.1 BdorSOD 基因的克隆及序列分析
根据噬菌体文库中测序得到的BdorSOD 基因的EST 序列设计2 条特异引物分别与试剂盒中的5'RACE 引物搭配进行槽式扩增,扩增产物电泳后得到450 bp 左右的特异条带,将测序结果拼接后得到BdorSOD 基因的cDNA5'序列。以B-SOD31和Oligo-dT 为引物,扩增获得BdorSOD 基因的3'序列,该基因ORF 全长531 bp,编码176 个氨基酸(图1),预测其编码的蛋白分子质量约为18.348 kD,等电点为6.45,第1-20 位氨基酸为其信号肽区域。BdorSOD 序列含有SOD 蛋白的特征序列 (图1 中用阴影框进行了标示),如GFHVHEEGDLT (68-78 位氨基) 及GNAGGRLACQVI (162-173 位氨基酸);70,72,87,144 位的4 个组氨酸为Cu 离子结合位点(图中用空心的三角框标示),87,95,104 位的3 个组氨酸及107 位的天冬氨酸(用空心圆圈标示)为蛋白的Zn 离子结合位点。
根据SOD 蛋白结合的金属离子的不同,可将其分为Cu/Zn SOD、Mn SOD、Fe SOD 三类。Cu/Zn SOD 又分为胞内SOD 与胞外SOD 两类。本研究结合前期工作中克隆到的胞内SOD (本文命名为SOD1 Bactrocera dorsalis),分别选取昆虫及脊椎动物SOD 序列,采用Megalign 软件中的Jotun Hein 方法构建系统进化树,结果如图2。

图1 BdorSOD3 ORF 区域及其对应的氨基酸序列Fig.1 The ORF region of BdorSOD3 and the deduced amino acid sequences

图2 不同物种SOD 蛋白序列的系统进化树Fig.2 Phylogenetic relationship of SOD protein in different species
由图2 可知,29 条来自双翅目、膜翅目昆虫及部分脊椎动物的SOD 序列,可聚为I 和II 两个大类。I类中主要为胞内SOD类,II类中主要为胞外SOD类蛋白。前期工作中的桔小实蝇SOD1 及本研究中的BdorSOD3 分别聚到第I、II 大类中。各类中大多数序列的聚类关系与昆虫的分类地位表现出较高的一致性。序列一致性分析表明,BdorSOD3 与胞外SOD 的序列一致性超过50%,被聚到第II 大类中;与桔小实蝇AGE89778.1 的序列的一致性最高,达 98.7%,与摇蚊序列AFM78035.1 的一致性值为50.9%。
2.3 BdorSOD3 蛋白三维结构模拟
通过对 PDB 库比对,BdorSOD3 与菠菜Spinach 中的Cu/Zn SOD 蛋白1 srd 的一致性最高,进一步以二聚体的1 srd 为模版,构建了BdorSOD3的三维结构,获得了的BdorSOD3 二聚体的模建结构(图3)。
由图3A 可知BdorSOD3 蛋白的三维结构主要由β 片层构成。两个亚基聚成二聚体后,β 片层形成“V”型的钳状结构(图3B 虚线所示)。
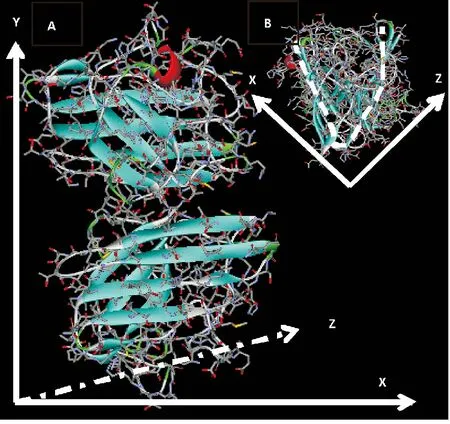
图3 BdorSOD3 的三维结构模型Fig.3 Three-dimensional model of BdorSOD3
2.4 BdorSOD3 基因的诱导表达分析
用大肠杆菌(E.coli DH5α)诱导处理2 d 蛹,对处理后24、48 h 的BdorSOD3 的表达量进行半定量分析,结果如图4。由图4 可见,actin 基因的表达量在处理及未处理样本中的表达量大致相当(泳道1-4),而BdorSOD3 在处理后24 h,其表达量略有升高(泳道7),而处理后48 h 的表达量明显升高(泳道8)。

图4 大肠杆菌处理后24、48 h BdorSOD3 的表达量分析Fig.4 Relative amount of BdorSOD3 mRNA in 24 and 48 hours pupa treated with Escherichia coli DH5α
3 结论与讨论
哺乳动物中的Cu/Zn SOD 按照其在细胞及细胞器中的位置分为胞内型 (SOD1)和胞外型(SOD3)两类。SOD3 在功能、结构上与SOD1 相似,但在SOD3 的 N 端往往包含一段信号肽(Okado-Matsumoto and Fridovich,2001;Stenlund et al.,2002)。本研究结合前期噬菌体文库的研究结果,进一步采用RACE 技术克隆获得一种桔小实蝇SOD 基因。该蛋白N 端含有20 个氨基酸信号肽,属于胞外型SOD,故将其命名为BdorSOD3。
Colinet 等(2011)对果蝇两种寄生蜂的毒液器官(venom apparatus)中发现的SOD 蛋白与部分膜翅目昆虫的SOD 蛋白进行序列聚类分析表明胞内型与胞外型具有较远的遗传距离。本研究聚类结果显示,第I 和II 大类中均包含了双翅目、膜翅目昆虫及部分脊椎动物的SOD 蛋白。聚类结果中,昆虫及脊椎动物的胞内和胞外型SOD 序列分别被聚到I、II 两个不同的大类中,在每个大类中序列的相似性与其分类地位具有较好的一致性,表明胞内和胞外型SOD 在物种进化的早期已经发生进化分离。
昆虫主要依靠其自身的天然免疫来抵御各种病原物的入侵(Leulier and Lemaitre,2008)。昆虫的天然免疫包括细胞免疫和体液免疫,细胞免疫依赖血细胞对外来异物进行吞噬和包囊,而体液免疫则是以抗菌肽、凝集素、溶菌酶及酚氧化酶原级联反应等发挥作用(Lazzaro,2008)。研究表明,桔小实蝇4 日龄幼虫被长尾潜蝇茧蜂寄生后,体内SOD、POD、CAT 等抗氧化酶的活性明显提高(王勇等,2013)。党向利等发现大肠杆菌感染处理桔小实蝇的蛹,会诱导蛹内抗菌肽的表达(党向利等,2012)。而本研究表明,在大肠杆菌处理后48 h BdorSOD3 的表达量明显升高,暗示BdorSOD3 与桔小实蝇蛹对外界微生物的免疫机制有关,但其机制有待于进一步的研究。
References)
Alyokhin AV,Mille C,Messing RH.Selection of pupation habitats by oriental fruit fly larvae in the laboratory [J].Journal of Insect Behavior,2001,14 (1):57-68.
Arnold K,Bordoli L,Kopp J,et al.The SWISS-MODEL Workspace:A web-based environment for protein structure homology modeling[J].Bioinformatics,2006,22:195-201.
Bannister JV,Bannister W,Rotilio G.Aspects of the structure,function and applications of Superoxide dismutase [J].CRC Critical Reviews Biochemistry,1987,22 (2):111-180.
Colinet D,Cazes D,Belghazi M,et al.Extracellular superoxide dismutase in insects:characterization,function,and interspecific variation in parasitoid wasp venom[J].The Journal of Biological Chemistry,2011,286 (46):40110-40121.
Dang XL,Tian JH,Yi HY,et al.Purification and characterization of bactrocerin-2 from oriental fruit fly Bactrocera dorsalis Hendel[J].Chinese Journal of Tropical Crops,2012,33 (3):556-561.[党向利,田金环,易辉玉,柴一秋.桔小实蝇抗菌肽Bactrocerin-2 的分离纯化与鉴定.热带作物学报,2012,33 (3):556-561]
Fridovich I.Superoxide radical and superoxide dismutases[J].Annual Review of Biochemistry,1995,64,97-112.
Hsu JC,Feng HT.Insecticide susceptibility of the oriental fruit fly(Bactrocera dorsalis (Hendel))(Diptera:Tephritidae)in Taiwan[J].Chinese Journal of Entomology,2002,20:109-118.
Lazzaro BP.Natural selection on the Drosophila antimicrobial immune system[J].Current Opinion in Microbiology,2008,11 (3):284-289.
Leulier F,Lemaitre B.Toll-like receptors-taking an evolutionary approach [J].Nature Reviews Genetics,2008,9 (1):165-178.
Nakahara S,Kobashigawa Y,Muraji M.Genetic variations among and within populations of the oriental fruit fly,Bactrocera dorsalis(Diptera,Tephritidae),detected by PCR-RFLP of the mitochondrial control region[J].Journal of Applied Entomology and Zoology,2008,43 (3):457-465.
Okado-Matsumoto A,Fridovich I.Subcellular distribution of superoxide dismutases (SOD)in Rat Liver:Cu,Zn-SOD in mitochondria[J].The Journal of Biological Chemistry,2001,276 (42):38388-38393.
Stenlund P,Lindberg MJ,Tibell LA.Structural requirements for highaffinity heparin binding:Alanine scanning analysis of charged residues in the c-therminal domain of human extracellular superoxide dismutase [J].Biochemistry,2002,41 (9):3168-3175.
Weisiger RA,Fridovich I.Superoxide dismutase.Organelle specificity[J].Journal of Biological Chemical,1973,248 (10):3582-3592.
Wang Y,Guo JJ,Chen JH,et al.The changes of the activity of four enzymes in larvae of Bactrocera dorsalis (Hendel)parasitized by Diachasmimorpha longicaudata [J].Chinese Journal of Tropical Crops,2013,34 (2):335-338.[王勇,郭俊杰,陈家骅,季清娥.长尾潜蝇茧蜂寄生后橘小实蝇幼虫体内4种酶活性的变化[J].热带作物学报,2013,34 (2):335-338]
Yuan SY,Kong Q,Xiao C,et al.Introduction to two kinds of artificial diets for mass rearing of adult Bactrocera dorsalis (Hendel)[J].Journal of Huazhong Agricultural University,2006,25 (4):371-374.[袁盛勇,孔琼,肖春,等.桔小实蝇成虫人工饲料的筛选[J].华中农业大学学报,2006,25 (4):371-374]
