孟氏隐唇瓢虫细胞色素P450 基因的克隆与序列分析
2015-12-09张宇宏郑基焕毛润乾
张宇宏,郑基焕,毛润乾*,庞 虹
(1.广东省昆虫研究所,广东省农业害虫综合治理重点实验室,广东省野生动物保护与利用公共实验室,广州 510260;2.中山大学生命科学学院,有害生物控制与资源利用国家重点实验室,广州 510275)
细胞色素P450 蛋白是细胞色素P450 单加氧酶系的末端氧化酶,属于CYP 基因家族,决定着P450 酶系催化底物的广泛性和专一性(Backes,1993;Namiki,2005)。细胞色素P450 不仅对多种外源化合物和内源化合物的氧化代谢起作用,还参与一些起重要生理功能的内源性物质如激素、脂肪酸的代谢,在生物体中起十分重要的作用。在昆虫体内,细胞色素P450 参与各类外源性物质(药物、植物次生物质、植物毒素)和内源性物质(保幼激素及其类似物、蜕皮激素、脂肪酸和信息素)的合成代谢(Maibèche-Coisne et al.,2002;Helvig et al.,2004),其中对杀虫剂的代谢是昆虫产生抗药性的主要机制(陈秋霞和黄炯烈,2001;邱星辉等,2003)。因其生物学的重要性,一直是生物学研究的一个重要对象(邱星辉和冷欣夫,1998;Wong,1998)。
孟氏隐唇瓢虫Cryptolaemus montrouzieri Mulsant属鞘翅目Coleoptera 瓢甲科Coccinellidae,原产于澳大利亚,1888-1891年间首次由Albert Koeble 引进美国加利福尼亚州用于防治柑橘上的粉蚧(李丽英,1993),由于其作为捕食性天敌的优良特性,被广泛引种到世界各地进行害虫防治(汤才等,1995;Attia & El-Arnaouty,2007;Mani &Krishnamoorthy,2008)。据报道,孟氏隐唇瓢虫可以捕食20 多种介壳虫(蒋瑞鑫等,2009),在世界范围内的分布,主要包括我国的广东、福建、台湾,以及印度尼西亚、菲律宾、俄罗斯、法国、意大利、新西兰、非洲、美国、西印度群岛、密克罗尼西亚、澳大利亚、泰国、印度、肯尼亚、西班牙、埃及等亚热带和热带地区(曾涛和庞虹,2000)。目前国内外对昆虫抗药性的研究主要集中在一些著名的模式生物或世界范围发生的害虫上,对天敌尤其是瓢虫的抗药性发生机理的研究并不多见(Zhang et al.,2012),本研究对孟氏隐唇瓢虫P450 家族的基因进行克隆并分析,为瓢虫抗药性研究提供理论依据。
1 材料与方法
1.1 试验材料与仪器
1.1.1 孟氏隐唇瓢虫的饲养与材料收集
孟氏隐唇瓢虫由中山大学昆虫园在25℃±1℃,14L∶10D 条件下饲养。大肠杆菌DH5α 菌株由广东省昆虫研究所保存。液氮处理孟氏隐唇瓢虫成虫,快速置于冰浴的EP 管中,-80℃保存备用。
1.1.2 主要试剂
UNIQ-10 柱式Trizol 总RNA 抽提试剂盒、cDNA 第一链合成试剂盒购自上海生工公司,SMARTTMRACE cDNA Amplification Kit (Clontech)购自宝生物(大连)公司,TaqDNA 聚合酶、核酸分子量标准D2000、琼脂糖凝胶回收试剂盒和pGM-T 载体购自天根生化科技(北京)有限公司,PCR 引物由华大科技(深圳)公司合成。其他试剂均为国产分析纯。
1.1.3 引物序列及作用

表1 CYP 9Z401 基因的cDNA 扩增的策略和引物Table 1 Cloning strategy and primers for CYP9Z401 cDNA
1.2 实验方法
1.2.1 总RNA 的抽提、cDNA 合成和PCR 反应
按UNIQ-10 柱式Trizol 总RNA 抽提试剂盒提供的方法提取孟氏隐唇瓢虫的总RNA。取昆虫样品,每15-25 mg 组织加入0.5 mL Trizol,用匀浆器匀浆处理。将裂解后样品或匀浆液室温放置5-10 min,加入0.2 mL 氯仿,剧烈振荡30 s,室温放置3 min。12000 rpm 4℃离心10 min。吸取上层水相转移至干净的离心管中,加入1/2 倍体积无水乙醇,混匀。将吸附柱放入收集管中,用移液器将溶液和半透明纤维状悬浮物全部加至吸附柱中,静置2 min,12000 rpm 离心3 min,倒掉废液。将吸附柱放回收集管中,加入500 μL RPE Solution,静置2 min,10000 rpm 离心30 s,倒掉废液。重复上一步。将吸附柱放回收集管中,10000 rpm 离心2 min。将吸附柱放入干净1.5 mL离心管中,在吸附膜中央加入30 μL DEPC-H2O,静置5 min,12000 rpm 离心2 min,-70℃保存RNA 溶液。
先采用紫外分光光度计测定总RNA 溶液的浓度,再按cDNA 第一链合成试剂盒的方法合成cDNA 第一链。在总体积为25 μL 的EP 管中依次加入1 μg 总RNA,5 μL 的5×buffer,2 μL 的dNTP(10 mM),1 μL 的AMV 反转录酶,补充DEPC 处理水到25 μL,在42℃的水浴中保温1 h 后,再放入70℃的水浴10 min 灭活AMV 反转录酶,即获得一链 cDNA。引物:P450-DF 和 P450-DR(表1)根据已知的昆虫P450 基因的保守结构域和本实验室保存的孟氏隐唇瓢虫EST 序列比对后设计。反应体系:25 μL 反应体系中含2.5 μL 10×PCR buffer,0.01 μmol/each dNTP,10 pmol/each primer,1.5 units Taq-Polymerase,约2 ng cDNA。按下述条件进行PCR:样品先94℃预变性3 min,94℃30 s,50℃ 30 s,72℃ 90 s,30 个循环后72℃ 10 min,扩增完毕后4℃终止反应。
1.2.2 PCR 产物的克隆与测序
将PCR 产物采用琼脂糖凝胶电泳回收目的条带后,连接到Tiangen 的pGM-T 载体中,然后将其转入DH5α 细胞中,挑取单个白斑验证后送往深圳华大科技公司测序。
1.2.3 cDNA 的末端快速扩增(RACE)
根 据 Clontech 的 SMARTTMRACE cDNA Amplification Kit 分别构建孟氏隐唇瓢虫的3'和5'RACE 文库。P450-3A,P450-3B,P450-5A,P450-5B 和P450-5C 引物根据获得中间片段序列来设计(表1),分别用于扩增孟氏隐唇瓢虫P450 基因的3'和5 '端序列。3'RACE 扩增采用试剂盒中的UPM 引物和P450-3A,二次巢式PCR时采用NUP 和P450-3B。同样5'RACE 扩增采用试剂盒中的UPM 引物和P450-5A,二次巢式PCR时采用NUP 和P450-5B。采用一样的PCR 程序:94℃10 min 后,30 个循环的94℃30 s,48℃30 s和72℃120 s。P450-3B 和P450-5C 分别用于验证3'和5'RACE 的菌落PCR。
1.2.4 序列分析及系统学分析
序列分析和基因特性分析采用 Dnastar、Dnaman、Vector 等软件和TMHMM Server v.2.0:http://www.cbs.dtu.dk/services/TMHMM-2.0/SignalP 3.0 Server:http://www.cbs.dtu.dk/services/SignalP/和Multiple sequence alignment by Florence Corpet:http://bioinfo.genotoul.fr/multalin/multalin.html 等在线分析软件进行。序列比对、氨基酸同源性分析及系统树构建等采用Blast、ClustalX 和MEGA5.2 等分析。蛋白结构同源建模通过SWISS-MODEL:http://swissmodel.expasy.org 在线工具获得,用 PSIPRED:http://bioinf.cs.ucl.ac.uk/psipred/预测蛋白二维结构,用 SWISS-PDBViewer 软件观察蛋白三维结构。
2 结果与分析
2.1 孟氏隐唇瓢虫的P450 基因的克隆和序列分析
孟氏隐唇瓢虫的P450 基因的克隆中,首先经过两次PCR,利用P450-DF 和P450-DR 作为引物,获得了一段约1500 bp 左右的片段。测序结果显示为P450 基因,根据这段序列,分别在3'和5'端设计了特异性引物,具体见图1。利用孟氏隐唇瓢虫的3'和5'RACE 文库作为模板经过两轮的PCR扩增后,各显示出300 bp 左右的条带。回收、连接、转化、验证和测序的结果表明为所需要的P450 基因序列。
拼接3'和5'RACE 的序列和中间片段,获得的孟氏隐唇瓢虫的 P450 基因全长,命名为CYP9Z401。该基因的cDNA 全长为1722 bp,编码528 个氨基酸,并预测出分子量为61.27,等电点为6.58。翻译的起始密码子为50 位的ATG,终止密码子TGA 位于1634-1636 位,其后有终止信号AATAAA (图1)。采用TMHMM Server v.2.0 和SignalP 3.0 Server 在线分析,没有发现其含有信号肽,而在2-20 氨基酸处存在跨膜结构。推导的氨基酸序列中包含有一系列昆虫细胞色素P450 基因共有的序列,即螺旋C 区的保守序列WXXXR(126-130);螺旋K 区的保守序列EXXRXXP(380-386);以及“Meander”区域的特征序列PXXFXPXXF (436-444);而血红素结合区的细胞色素P450 标志性特征序列FXXGXRXCXG 变为FGAGPRNCIA (460-469);螺旋I 区的A/GGXD/ETT/S 变为AGYESG (324-329)。应用SWISS-MODEL 进行孟氏隐唇瓢虫CYP9Z401 蛋白的同源建模,得到模拟的蛋白三维结构(图3),其中有18 个α 螺旋(Helix),12 个β 折叠(Sheet),没有发现无序蛋白结构(Disordered protein)。

图1 孟氏隐唇瓢虫CYP9Z401 基因的核苷酸和推导的氨基酸序列Fig.1 Nucleotide and amino acid sequences of CYP9Z401 from Cryptolaemus montrouzieri

图2 孟氏隐唇瓢虫CYP9Z401 的基因结构预测Fig.2 Structure of CYP9Z401 cDNA from Cryptolaemus montrouzieri
2.2 昆虫的CYP9 家族基因同源性和进化分析
从NCBI 中找到与孟氏隐唇瓢虫CYP9Z401 遗传相似性较高的20种昆虫的CYP9 基因序列,将孟氏隐唇瓢虫与已知昆虫的CYP9 基因蛋白序列比对结果如下:山松大小蠹Dendroctonus ponderosae CYP9Z19 (AFI45046)43%、赤拟谷盗Tribolium castaneum CYP9Z4 (NP_ 001164248)47%、红脂大小蠹Dendroctonus valens CYP9Z18 (AGF69216)42%、德国小蠊 Blattella germanica CYP9E2(Q964T2)39%、家蚕 Bombyx mori CYP9A19(BAM73827)41%、蝇蛹金小蜂Nasonia vitripennis CYP9P3 (NP_ 001165945)40%、野桑蚕Bombyx mandarina CYP9A21 (ACJ04711)41%、太平洋折翅蠊 Diploptera punctata CYP9E1 (AAR97606)38%、果蝇 Drosophila mojavensis CYP9 (XP _001999792) 41%、草地贪 蛾 Spodoptera frugiperda CYP9A58 (AID55429)41%、二化螟Chilo suppressalis CYP9A69 (AHW57316)40%、黑腹果蝇 Drosophila melanogaster CYP9F2 (NP _650189)40%、印度刻茧蜂Glyptapanteles indiensis CYP9 (ACE75339) 40%、欧洲熊蜂 Bombus terrestris CYP9E2 (XP_ 003393388)38%、切叶蚁Acromyrmex echinatior CYP9E2 (EGI69987)39%、甘蓝夜蛾Mamestra brassicae CYP9 (AAR26518)39%、小蜜蜂 Apis florea CYP9E2 (XP _003697796)38%、棉铃虫 Helicoverpa armigera CYP9A14v2 (AID54902) 42%、苜蓿切叶蜂Megachile rotundata CYP9E2 (XP _ 003705491)37%、谷实夜 Helicoverpa zea CYP9A14(ABH09253)42% (图5)。从不同目的昆虫挑选了有代表性的物种:赤拟谷盗、德国小蠊、家蚕、印度刻茧蜂、黑腹果蝇与孟氏隐唇瓢虫采用Multiple 进行比对分析结果发现,昆虫的CYP9 家族基因同源性不高,在37%-47%之间(图4)。
将上述21种昆虫的CYP9 基因蛋白序列进行系统发育分析,结果表明,孟氏隐唇瓢虫和鞘翅目的赤拟谷盗亲缘关系最近,其次是山松大小蠹和红脂大小蠹,再次是双翅目和鳞翅目的昆虫,与膜翅目和蜚蠊目的昆虫遗传距离较远。

图3 孟氏隐唇瓢虫CYP9Z401 理论蛋白结构图Fig.3 The theoretical three-dimensional structure of Cryptolaemus montrouzieri CYP9Z401 protein
3 结论与讨论
细胞色素P450 蛋白的氨基酸序列普遍同源性不高,一般在30%-50%之间,最低不足20%,孟氏隐唇瓢虫CYP9Z401 与其他20种昆虫昆虫的CYP9 家族基因比较,同源性最高的为赤拟谷盗47%,最低的为苜蓿切叶蜂37%。但是,细胞色素P450 蛋白拥有共有的保守氨基酸序列,越来越多的P450 晶体结构显示,P450 的结构折叠具有高度保守性(Graham & Peterson,1999)。P450 结构中最保守的部分是围绕在血红素周围的蛋白的中心,该保守中心由螺旋束D、E、I、L,螺旋J、K,2 套β 折叠构成。这些区域包含血红素结合环(heme-binding loop)。血红素结合环位于血红素的近表面,大部分包含有P450 最具特征的共有序列(FXXGXRXCXG)和绝对保守的半胱氨酸(C)。螺旋K 中绝对保守的EXXRXXP 元件,螺旋C 区有保守序列WXXXR。螺旋I 的中心部分,该部分包含有P450 的另一个共有序列(A/GGXD/ETT/S)。P450 的可变区通常与N-端锚定,可以识别不同底物并与之结合(Gotoh,1992)。
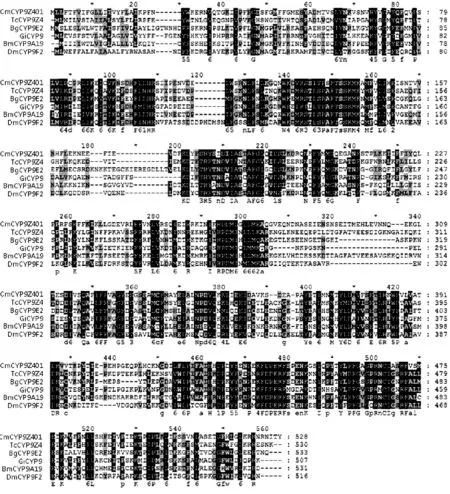
图4 孟氏隐唇瓢虫与其他昆虫CYP9 基因氨基酸序列比较Fig.4 Alignment of the amino acid sequence of insect CYP9 proteins

图5 与孟氏隐唇瓢虫CYP9Z401 相关蛋白的聚合进化分析Fig.5 Phylogenetic analysis of Cryptolaemus montrouzieri CYP9Z401 and other related proteins
自1967年RAY 首先在家蝇Musca domestica 中确定细胞色素P450 的存在,此后在其他许多昆虫相继发现细胞色素P450 基因(刘月峰等,2011)。目前已经发现,该基因家族包括36 个基因族(程家安和唐振华,2001),其中包括昆虫的4 个家族,分属于CYP4 、CYP6 、CYP9 和CYP18 家族(Sushmita et al.,1996)。孟氏隐唇瓢虫CYP9Z401属于P450 家族中的CYP9 家族。大部分P450 家族基因与昆虫抗药性密切相关,普遍认为,细胞色素P450 介导的昆虫抗药性是通过解毒代谢酶基因扩增或过量表达,导致解毒代谢酶的活性显著升高,解毒代谢能力增强而对杀虫剂形成抗性(Berge et al.,1998;刘月峰等,2011)。因此,研究昆虫P450 蛋白的产生、变化可以了解昆虫对外界环境适应性变化规律,尤其对于天敌昆虫的抗药性机制的研究,有利于天敌的释放和评价对害虫的控制潜能。
References)
Attia AR,El-Arnaouty SA.Use of the coccinellid predator,Cryptolaemus montrouzieri Mulsant against the striped mealybug,Ferrisia virgata (Ckll.) on the ornamental plant,Agalypha macrophylla in Egypt [J].Egyptian Journal of Biological Pest Control,2007,17:71-76.
Backes WL.NADPH-Cytochrome P450 reductase.In:Schenkman JB,Griem H,eds.Cytochromes P450 [M].Berlin:Springer-Verlag,1993,15-34,
Berge JB,Feyereisen R,Amichot M.Cytochrome P450 monooxygenases and insecticide resistance in insects[J].Philos.Trans.R.Soc.Lond.B Biol.Sci.,1998,353 (1376):1701-1705.
Chen QX,Huang JL.Insect cytochrome P450 induction and resistance[J].Journal of Tropical Medicine,2001,1 (1):67-71.[陈秋霞,黄炯烈.昆虫细胞色素P450 的诱导和抗药性[J].热带医学杂志,2001,1 (1):67-71]
Cheng JA,Tang ZH.Insect Molecular Science [M].Beijing:Science press,2001:218.[程家安,唐振华.昆虫分子科学[M].北京:科学出版社,2001:218]
Gotoh O.Substrate recognition sites in cytochrome P450 family 2(CYP2)protein inferred from comparative analyses of amino acid and coding nucleotide sequences[J].Biol.Chem.,1992,267:83-90
Graham SE,Peterson JA.How similar are P450s and what can their differences teach us[J].Arch.Biophys.Biochem.,1999,369:24-29.
Helvig C,Koener JF,Unnithan GC,et al.CYP15A1,the cytochrome P450 that catalyzes epoxidation of methyl farnesoate to juvenile hormone Ⅲin cockroach corpora allata[J].Proc.Natl.Acad.Sci.,2004,101:4024-4029
Jiang RX,Li S,Guo ZP,et al.Research status of Cryptolaemus montrouzieri Mulsant and establishing its description criteria[J].J.Environ.Entomol.,2009,31 (3):238-247.[蒋瑞鑫,李姝,郭泽平,庞虹.孟氏隐唇瓢虫研究现状及其种质资源描述规范的建立[J].环境昆虫学报,2009,31 (3):238-247]
Li LY.The research and application prospects of Cryptolaemus montrouzieri in China [J].Natural Enemies of Insects,1993,15 (3):142-152.[李丽英.我国孟氏隐唇瓢虫研究与应用展望[J].昆虫天敌,1993,15 (3):142-152]
Liu YF,Jin DC,Li SW.Cloning and sequence analysis of CYP 6K1 of P450 gene in Cnaphalocrocis medinalis[J].Guizhou Agricultural Sciences,2011,39 (5):119-122.[刘月峰,金道超,李尚伟.稻纵卷叶螟P450 基因CYP6K1 的克隆与序列分析[J].贵州农业科学,2011,39 (5):119-122]
Maibèche-Coisne M,Jacquin JE,Francois MC,et al.cDNA cloning of biotransformation enzymes belonging to the cytochrome P450 family in the antennae of the noctuid moth Mamestra brassicae[J].Insect Molecular Biology,2002,11 (3):273-281.
Mani M,Krishnamoorthy A.Biological suppression of the mealybugs Planococcus citri (Risso),Ferrisia virgata (Cockerell) and Nipaecoccus viridis (Newstead)on pummelo with Cryptolaemus montrouzieri Mulsant in India[J].Journal of Biological Control,2008,22:169-172.
Namiki T,Niwa R,Sakudoh T,et al.Cytochrome P450 CYP307A1/Spook:a regulator for ecdysone synthesis in insects [J].Biochemical and Biophysical Research Communications,2005,337:367-374.
Qiu XH,He FQ,Li M.Cytochrome P450 mediated insect resistance[J].Chemistry of Life,2003,23 (4):279-281.[邱星辉,何凤琴,李梅.细胞色素P450 介导的昆虫抗药性[J].生命的化学,2003,23 (4):279-281]
Qiu XH,Leng XF.Research of insect cytochrome P450:P450 gene[J].Chinese Bulletin of Entomology,1998,35 (1):48-51.[邱星辉,冷欣夫.昆虫细胞色素P450 研究:P450 基因[J].昆虫知识,1998,35 (1):48-51]
Sushmita M,Dombrowski SM,Waters LC,et al.Three second chromosome-linked clustered Cyp6 genes show differential constitutive and barbital-in-duced expression in DDT-resistant and susceptible strains of Drosophila melanogaster [J].Gene,1996,180 (1-2):165-171.
Tang C,Pang H,Ren SX.Studies on the Cryptolaemus montrouzieri,feeding on loblolly pine mealybug Oracella acuta (Lobdell)[J].Natural Enemies of Insects,1995,17 (1):9-12.[汤才,庞虹,任顺祥,等.孟氏隐唇瓢虫捕食湿地松粉蚧的研究[J].昆虫天敌,1995,17 (1):9-12]
Wong LL.Cytochrome P450 monooxygenases[J].Current Opinion in Chemical Biology,1998,2:263-268
Zeng T,Pang H.Chech list of Coccidophagous species of ladubirds(Coleoptera:Coccinellidae)from China[J].Natural Enemies of Insects,2000,22 (2):279-281.[曾涛,庞虹.中国食蚧瓢虫名录[J].昆虫天敌,2000,22 (2):59-67]
Zhang Y,Jiang R,Wu H,et al.Transcriptome profiling analysis of insecticide stress Cryptolaemus montrouzieri reveals resistance-relevant genes in ladybird[J].Genomics,2012,100:35-41.
