FSHβ基因-211G→T多态性与多囊卵巢综合征的相关性研究
2015-12-08宋倩倩杨梦云赵学科邱慧玲
宋倩倩,杨梦云,赵学科,邱慧玲
多囊卵巢综合征(polysistic ovary syndrome,PCOS)是育龄期妇女常见的异质性内分泌疾病,发病率5% ~10%[1]。PCOS临床表现复杂多样,如月经稀发甚至闭经、无排卵、高雄激素血症、胰岛素抵抗等,其并发症也表现各异,不仅2型糖尿病、糖耐量受损及代谢综合征的发生率较高[2-3],而且子宫内膜癌、妊娠及新生儿并发症、心血管病等的发生风险也高于正常人群[4-6],PCOS的病因至今尚未阐明。基因多态性研究是近年来学者们研究的热点,多数学者认为PCOS的发病可能与基因调控有关。卵泡刺激素(follicle stimulating hormone,FSH)由α和β亚基组成,β亚基具有特异性并使FSH具有生物活性,由卵泡刺激素β亚基(follicle stimulating hormone β-subunit,FSHβ)基因编码,FSH 对卵泡生长发育及排卵以及雄激素转化为雌激素起到重要的作用。而PCOS患者内分泌特征有:雄激素过多、雌激素过多、黄体生成素与卵泡刺激素比值(luteinizing hormone/follicle stimulating hormone,LH/FSH)增大等。因此,FSHβ基因是PCOS病因研究的相关因素,但目前尚缺乏FSHβ-211G→T与PCOS的相关性研究。本研究特探讨FSHβ-211G→T与PCOS的关系如下。
1 对象与方法
1.1 对象 病例组:收集2013年3-8月就诊于厦门解放军174医院妇科的18~35岁PCOS 100例,均为福建省汉族人,诊断标准参照2003年欧洲人类生殖协会和美国生殖医学协会推荐的诊断标准[7],即:①稀发排卵或无排卵;②雄激素水平升高的临床表现和(或)高雄激素血症;③B超监测下的卵巢多囊改变,一侧或双侧卵巢中直径2~9 mm的卵泡数≥12个,和(或)单侧卵巢体积增大>10 mL;符合以上3条中的2条,并排除其他致雄激素水平升高的病因,包括先天性肾上腺皮质增生、分泌雄激素的肿瘤、库欣综合征等,以及其他引起排卵障碍的疾病,如高催乳素血症、垂体或下丘脑性闭经、卵巢早衰、甲状腺功能异常等。对照组:选择同期因输卵管因素(慢性输卵管炎)不孕而就诊的女性154例,入选标准为:年龄18~35岁、福建省汉族人;月经规律(25 d<月经周期<35 d);B超监测正常排卵;均无慢性疾病;至少3个月未服用过激素类药物。本研究经174医院伦理委员会批准,获得每位研究对象的知情,并签署知情同意书。
1.2 试剂与仪器 DNA提取试剂盒(Roche公司),DNA聚合酶(北京全式金生物技术有限公司),部分激素检测试剂盒(瑞士 Roche公司);Unicel DXI 800化学发光免疫分析仪及配套生殖激素检测试剂(BECKMAN COULTER公司),Bioer lifepro PCR扩增仪(北京东方安诺生化科技有限公司),Cavoy电泳仪(上海京工实业有限公司),ABI3730测序仪(厦门闽博生物技术有限公司)。
1.3 实验方法 收集入选对象的年龄、血压、腹围、身高、体重、体质指数、月经史及B超监测排卵情况。所有入选对象至少3个月未服用过激素类药物,均于月经来潮第2~3天(闭经者任何时期),禁食12 h,抽取静脉血,检测血清FSH、LH、雌二醇(estradiol,E2)、孕激素(progesterone,P)、睾酮(testosterone,T)、泌乳素(prolactin,PRL)、促甲状腺激素(thyroid stimulating hormone,TSH)、空腹胰岛素(fasting insulin,FINS)、空腹血糖(fasting plasma glucose,FPG),以及空腹总胆固醇(total cholesterol,TC)、三酰甘油(triglycerides,TG)、低密度脂蛋白(low-density lipoprotein,LDL)、高密度脂蛋白(highdensity lipoprotein,HDL)、血清硫酸脱氢表雄酮(dehydroepiandrosterone sulfate,DHEAS)、性激素结合球蛋白(sex hormone-binding globulin,SHBG)。以稳态模型评估-胰岛素抵抗指数[8](HOMA-IR)=(FPG×FINS)/22.5。并于同样条件下各抽取静脉血5 mL,EDTA抗凝,于-80℃储存。
提取全血DNA,PCR总反应体积20 μL,上下游引物(l1 μmol/L)各 1 μL、DNA 模板 4 μL、超纯水9.4 μL、10 × Easytaq Buffer 2 μL、2.5 mM dNTPs 2 μL、Easytaq DNA Polymerase 0.6 μL;FSHβ-211G→T基因引物序列[英潍捷基(上海)有限公司合成]:上游引物为:5'-GGTAGTGATTATGGTTCTCCCTCAC-3',下游引物为:5'-CCACTTGAAAACGGTAGATGC-3'。PCR扩增程序为:94℃预变性4 min,94℃变性30 s,59 ℃退火30 s,72 ℃延伸1 min,循环35 次,72℃最后延伸5 min,扩增结束后存于4℃。取PCR扩增产物 2 μL,在琼脂糖凝胶(1.2%)上,用稳压100 V,电泳15 min,于凝胶成像分析仪上成像,进行基因测序,获得突变位点基因序列,与已获取的基因序列比对后,根据测序图进行基因型鉴定。
1.4 统计学处理 采用SPSS 16.0软件进行统计分析。计量资料以均数±标准差(±s)表示,计量资料组间比较若符合正态分布采用t检验,不符合正态分布则采用Mann-Whitney U检验;计数资料以例(率)[n(%)]表示,组间比较采用χ2检验。P<0.05示差异有统计学意义。
2 结果
2.1 PCR扩增及测序结果 PCR扩增目的基因片段长811 bp,于凝胶成像分析仪上成像见图1。基因测序结果示FSHβ-211G→T基因变异有两个基因型G/G及G/T(图2)。

图1 FSHβ-211G→T基因PCR产物凝胶成像
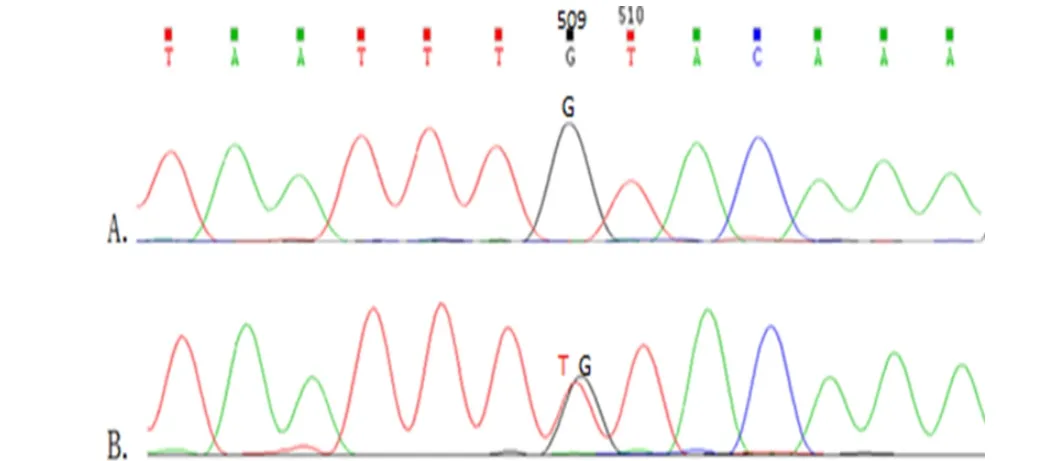
图2 病例组和对照组FSHβ-211G→T基因测序结果
2.2 病例组和对照组的FSHβ-211G→T的基因型及等位基因分布 经Hardy-Weinberg平衡检验[9],两组等位基因分布符合Hardy-Weinberg平衡定律。在PCOS人群中FSHβ-211G→T突变 GT基因型频率为14.0%,对照组中 GT基因型频率为6.5%,FSHβ-211G→T的基因型在两组中的分布差异有统计学意义(P <0.05,表1)。
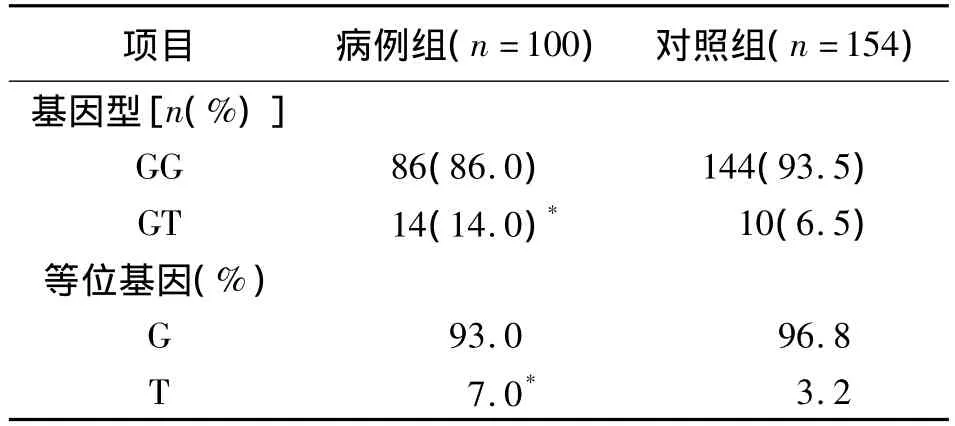
表1 两组的FSHβ-211G→T的基因型及等位基因分布比较
2.3 不同FSHβ-211G→T基因型对病例组及对照组内分泌代谢指标的影响 携带GT基因型的患者较GG基因型患者具有低FSH水平及高LH/FSH比值(P<0.05);同时在对照组中发现具有GT基因型者较GG基因型者具有高LH/FSH比值及高TC水平(P <0.05,表 2)。
3 讨论
PCOS是育龄期妇女一种常见的异质性内分泌疾病,临床表现及近远期并发症复杂多样[2-6],严重影响女性生殖及内分泌健康。但PCOS的病因至今尚未阐明,目前多数学者认为PCOS的发病可能与基因调控有关。人体内基因具有自然变异和多态性的特征,基因学研究有助于了解人类复杂疾病。最近被确认的FSHβ-211G→T,位于FSHβ基因启动子区的第 211 个位点(rs10835638)[10]。有研究[11-12]表明,FSHβ-211G→T对生育期女性的下丘脑-垂体-卵巢轴(hypothalamic pituitary ovarian axis,HPO)有一定的影响,FSHβ基因和FSH受体(follicle stimulating hormone receptor,FSHR)基因联合突变可能会影响血清FSH水平。有研究[13]认为女性HPO轴有影响的基因变异对PCOS的相关表型也有一定的影响。
本研究发现FSHβ-211G→T基因变异具有两个基因型GG及GT,在PCOS人群中FSHβ-211G→T突变GT基因型频率为14.0%,T等位基因频率高于对照组(PCOS为7.0%,对照组为 3.2%),两组间FSHβ-211G→T基因型分布存在差异(P<0.05),表明该单核苷酸位点多态性对PCOS的发病易感性有影响,并明确了FSHβ-211G→T基因多态性对PCOS的内分泌代谢有一定的影响。有学者研究发现[12],FSHβ-211G→T突变基因T与高FSH水平及高LH水平相关。但本研究发现,FSHβ-211G→T与血清FSH水平之间的关系明显不同于先前的研究,这可能与不同人种、不同地区群体的基因突变频率差异及研究设计方案、分析方法的不同有关。在PCOS患者中FSHβ-211G→T多态性对 FSH及LH/FSH比值有影响,携带GT基因型的患者较GG基因型患者具有低FSH水平及高LH/FSH比值(P<0.05),同时TC水平也有上升趋势;在对照组中携带GT基因型者较GG基因型者具有高LH/FSH比值及高TC水平(P<0.05),而FSH水平也有下降趋势;该基因多态性对 LH、FPG、FINS、LDL、HDL、DHEAS、SHBG等指标无明显影响。因此,笔者推断FSHβ基因启动子区的多态性通过影响FSH、TC水平来影响PCOS的内分泌代谢。根据Falck在1959年提出的学说[14]:在颗粒细胞中,FSH与颗粒细胞上的FSHR结合,激活颗粒细胞内的芳香化酶活性,将雄激素转化为雌激素。因此笔者推测,FSHβ-211G→T通过影响FSH水平,改变PCOS体内雄激素和雌激素的水平,引起激素水平的紊乱,以致PCOS临床内分泌代谢的变化,最终导致PCOS的发生。总之FSHβ-211G→T基因多态性对PCOS的发病易感性及临床内分泌特征有影响,FSHβ-211G→T基因多态性可能是PCOS发病的原因之一。
表2 病例组与对照组不同FSHβ-211G→T基因型的内分泌代谢指标比较(±s)
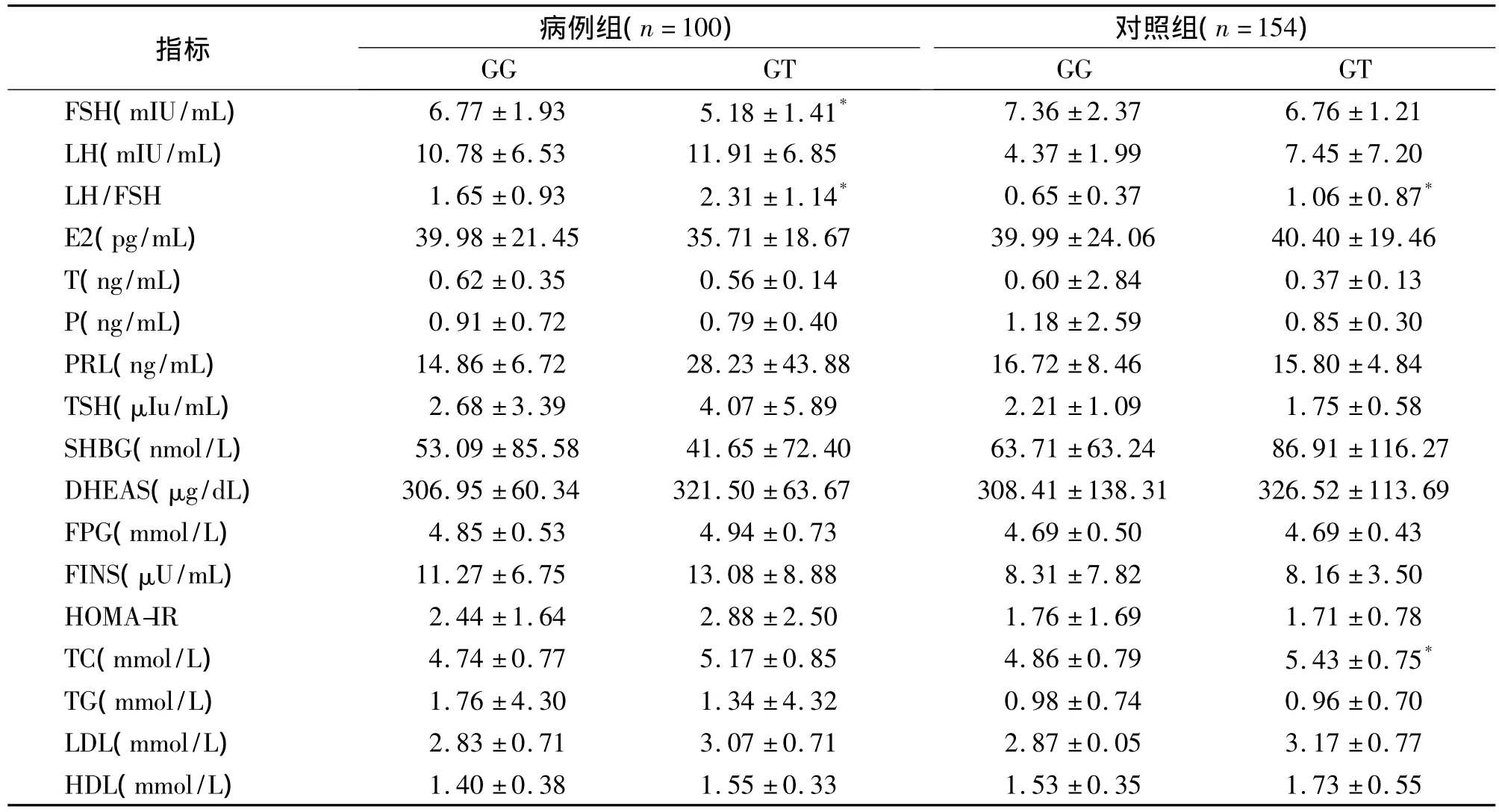
表2 病例组与对照组不同FSHβ-211G→T基因型的内分泌代谢指标比较(±s)
注:与本组GG基因型比较,*P<0.05
指标 病例组(n=100)对照组(n=154)GG GT FSH(mIU/mL) 6.77 ±1.93 5.18 ±1.41*GG GT 1.40 ±0.38 1.55 ±0.33 1.53 ±0.35 1.73 ±0.55 7.36 ±2.37 6.76 ±1.21 LH(mIU/mL) 10.78 ±6.53 11.91 ±6.85 4.37 ±1.99 7.45 ±7.20 LH/FSH 1.65 ±0.93 2.31 ±1.14* 0.65 ±0.37 1.06 ±0.87*E2(pg/mL) 39.98 ±21.45 35.71 ±18.67 39.99 ±24.06 40.40 ±19.46 T(ng/mL) 0.62 ±0.35 0.56 ±0.14 0.60 ±2.84 0.37 ±0.13 P(ng/mL) 0.91 ±0.72 0.79 ±0.40 1.18 ±2.59 0.85 ±0.30 PRL(ng/mL) 14.86 ±6.72 28.23 ±43.88 16.72 ±8.46 15.80 ±4.84 TSH(μIu/mL) 2.68 ±3.39 4.07 ±5.89 2.21 ±1.09 1.75 ±0.58 SHBG(nmol/L) 53.09 ±85.58 41.65 ±72.40 63.71 ±63.24 86.91 ±116.27 DHEAS(μg/dL) 306.95 ±60.34 321.50 ±63.67 308.41 ±138.31 326.52 ±113.69 FPG(mmol/L) 4.85 ±0.53 4.94 ±0.73 4.69 ±0.50 4.69 ±0.43 FINS(μU/mL) 11.27 ±6.75 13.08 ±8.88 8.31 ±7.82 8.16 ±3.50 HOMA-IR 2.44 ±1.64 2.88 ±2.50 1.76 ±1.69 1.71 ±0.78 TC(mmol/L) 4.74 ±0.77 5.17 ±0.85 4.86 ±0.79 5.43 ±0.75*TG(mmol/L) 1.76 ±4.30 1.34 ±4.32 0.98 ±0.74 0.96 ±0.70 LDL(mmol/L) 2.83 ±0.71 3.07 ±0.71 2.87 ±0.05 3.17 ±0.77 HDL(mmol/L)
本研究对FSHβ-211G→T与PCOS的相关性进行首次研究,选取的人群仅为中国福建汉族女性人群,具有一定的局限性,有待对更多地区、更多人种进行研究。
[1] Li R,Zhang Q,Yang D,et al.Prevalence of polycysticovary syndrome in women in China:a large community-based study[J].Hum Reprod,2013,28(9):2562-2569.
[2] Moran LJ,Misso ML,Wild RA,et al.Impaired glucose tolerance,type 2 diabetes and metabolic syndrome in polycystic ovary syndrome:a systematic review and meta-analysis[J].Hum Reprod Update,2010,16(4):347-363.
[3] 徐碧红,张 凤.肥胖与非肥胖多囊卵巢综合征患者内分泌激素对比研究[J].华南国防医学杂志,2011,25(5):446-447.
[4] Boomsma CM,Eijkemans MJ,Hughes EG,et al.A meta-analysis of pregnancy outcomes in women with polycystic ovary syndrome[J].Hum Reprod Update,2006,12(6):673-683.
[5] Haoula Z,Salman M,Atiomo W.Evaluating the association between endometrial cancer and polycystic ovary syndrome[J].Hum Reprod,2012,27(5):1327-1331.
[6] Rizzo M,Berneis K,Spinas G,et al.Long-term consequences of polycystic ovary syndrome on cardiovascular risk[J].Fertil Steril,2009,91(4 Suppl):1563-1567.
[7] Rotterdam.ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group.Revised 2003 consensus on diagnostic criteria and longterm health risks related to polycystic ovary syndrome(PCOS)[J].Fertil Steril,2004,81(1):19-25.
[8] 吴静静,刘锦霞,吴元赭,等.观察二甲双胍和螺内酯对多囊卵巢综合征患ghrelin的影响[J].东南国防医药,2009,11(4):289-292.
[9] 罗助荣,林 毅,张克己,等.福建地区汉族人群骨保护素基因rs2073617T/C多态性与急性冠脉综合征病变程度的关系[J].东南国防医药,2011,13(5):385-388.
[10] Grigorova M,Punab M,Ausmees K,et al.FSHΒ promoter polymorphism within evolutionary conserved element is associated with serum FSH level in men[J].Hum Reprod,2008,23(9):2160-2166.
[11] Schüring AN,Busch AS,Bogdanova N,et al.Effects of the FSH-βsubunit promoter polymorphism 211G→T on the hypothalamic-pituitary-ovarian axis in normally cycling women indicate a genderspecific regulation of gonadotropin secretion[J].J Clin Endocrinol Metab,2013,98(1):E82-E86.
[12] La Marca A,Papaleo E,Alviggi C,et al.The combination of genetic variants of the FSHΒ and FSHR genes affects serum FSH in women of reproductive age[J].Hum Reprod det,2013,28(5):1369-1374.
[13] Valkenburg O,Uitterlinden AG,Piersma D,et al.Genetic polymorphisms of GnRH and gonadotrophic hormone receptors affect the phenotype of polycystic ovary syndrome[J].Hum Reprod,2009,24(8):2014-2022.
[14]谢 幸,苟文丽.妇产科学[M].8版.北京:人民卫生出版社,2013:19.
