纵隔神经内分泌癌的影像学表现
2015-12-08卢海波吴建伟
卢海波,朱 丽,钟 晶,吴建伟
纵隔神经内分泌癌(mediastina neuroendocrine carcinoma,MNC)比较少见,起源于神经嵴的胸腺细胞,较易误诊为胸腺瘤、淋巴瘤等纵隔其他肿瘤,本文回顾性分析经病理证实的纵隔神经内分泌癌影像表现,旨在提高影像诊断的准确性。
1 对象与方法
1.1 对象 收集本院2006年6月-2014年5月经手术或病理穿刺活检证实的纵隔神经内分泌癌5例,其中男4例,女1例,中位年龄60岁(52~73岁)。临床表现主要为胸闷胸痛,其中1例伴进食哽咽,1例以库欣综合征就诊,1例以咳嗽、咳痰伴声嘶就诊,1例体检发现。
1.2 检查方法 4例行CT扫描,采用CT(德国GE LightSpeed VCT)螺旋扫描,管电压120 kV,电流150~180 mA。扫描螺距为1.0,层距5 mm,重建层厚5 mm。使用双筒高压注射器,经肘静脉团注碘海醇(300 mgI/mL)60~100 mL,注射速率为 2.5~3 mL/s)延迟40~50 s增强扫描。1例行MR(GE Signa HDxt 3T)检查,采用8通道胸部线圈,扫描序列为轴位SPGR T1WI(TR250 ms,激励角80度,矩阵384×180,FOV42 cm,层厚 7 mm,间距 3 mm)和呼吸门控FSE-XL T2WI(层厚、间距同T1WI,矩阵为320×224)和冠状位 SPGR T1WI扫描。3例行PET/CT(Seimens biograph 16 HR PET/CT机)检查,检查前空腹4~6 h,控制血糖在7.0 mmol/L以内,按体重静脉注射显像剂,18F-FDG为3.8~4.6 MBq/kg后平卧休息40~60 min,排尿后行PET/CT全身扫描,检查范围自头顶至大腿中部,共6~8个床位,每床位3 min,三维采集,并用CT数据进行衰减校正,迭代法重建获得全身各方位重建的融合图像。
2 结果
本组病例全部经病理证实(3例术后病理、1例食管超声内镜下细针穿刺活检术、1例经颈部淋巴结活检)。其中2例为小细胞型神经内分泌癌,2例为类癌,1例为大细胞型纵隔神经内分泌癌。免疫组化结果显示,3例CgA在细胞质中呈点状颗粒状阳性,4例Ki67在细胞核中呈阳性。5例Syn在细胞质中呈阳性,其中3例呈弥漫性分布(占比3/5),2例呈灶性分布(占比2/5),而 CgA均为小灶性分布。
本组2例病灶位于前纵隔、2例位于中纵隔、1例位于后纵隔。4例呈浸润性生长、包绕周围血管,1例位于隆突下膨胀性生长。4例平扫CT值18~53,平均48,增强后 CT 值 28 ~91,平均 62,呈中等度至明显强化;1例行MRI检查,呈不均性长T1长T2信号(图1~3)。3例有PET-CT资料,表现为上纵隔肿块呈明显 FDG高摄取,SUVmax为6.7 ~28.5(图4~6),SUVmax中位数为9.2。本组5个病例全部发生远处转移,其中肺转移1例,肝转移1例,骨转移2例,淋巴结转移5例(图7~10)。5例肿瘤分期均为Ⅳ期,均接受放化疗。

图1~3 患者女,55岁,咳嗽半年(干咳为主、咳少量白粘痰),声嘶伴胸闷1月余。前纵隔肿块,CT直接增强(图1)示病灶密度较肌肉略低,MRI(图2、3)为不均匀稍长T1稍长T2信号,术后为胸腺大细胞型低-未分化神经内分泌癌

图4~6 患者男,60岁,胸闷伴干咳3个月,PET-CT发现前纵隔肿块,图4为CT平扫,CT值37 HU,图5为CT增强68 HU,图6为PET-CT融合相,SUVmax为28.5,术后为纵隔小细胞型低分化神经内分泌癌
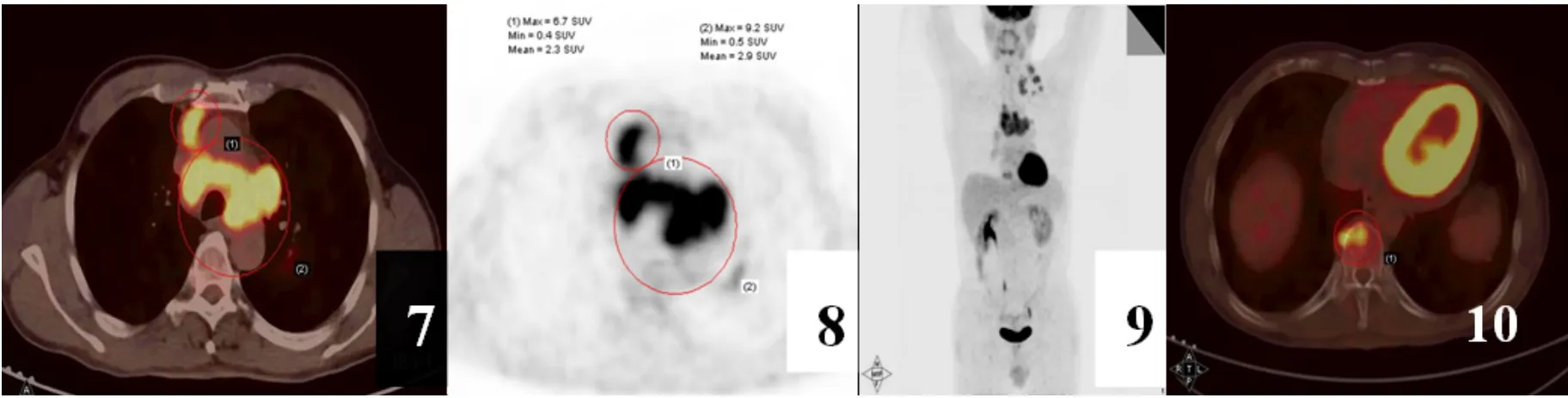
图7~10 患者男,52岁,胸闷及胸痛半年余,进食哽咽1个月,PET-CT发现纵隔内肿块(图7、8)伴左锁骨上淋巴结转移(图9)及胸椎骨转移(图10),术后为纵隔小细胞型神经内分泌癌
3 讨论
3.1 纵隔神经内分泌癌的起源、临床、病理及免疫组化特点及镜下表现。神经内分泌癌起源于神经内分泌细胞。神经内分泌细胞广泛分布于人体消化、呼吸等系统,而发生在纵隔的神经内分泌癌很罕见。纵隔神经内分泌肿瘤病理上分为典型类癌、非典型类癌、小细胞癌及大细胞神经内分泌癌4类,可按照TNM分期系统进行临床分期[1]。
纵隔神经内分泌癌由Rosai等[2]于1972年首先报道。但随着影像技术的发展及免疫组化的广泛推广应用,神经内分泌癌的发现率明显提高,现在多数研究者已不认为这是一种非常罕见疾病[3]。纵隔神经内分泌癌占纵隔肿瘤的5%,多位于胸腺,胸腺神经内分泌癌好发于中老年人,以40~60岁发病居多,男女之比大约为3∶1。胸闷胸痛,以及咳嗽,呼吸困难、进食哽咽等是本病常见症状。少部分纵隔神经内分泌癌伴有神经内分泌功能,以库欣综合征和神经内分泌瘤综合征最常见。所收集病例中有1例伴有神经内分泌症状。镜下多呈实性巢团状或弥漫的、不规则的细胞索状排列,通常伴大量坏死。核质比例高,细胞质少,染色质稍粗糙,可见小核仁,核分裂象易见。电镜下可见直径为200~300 nm的神经内分泌颗粒。
免疫组化方面,CgA、Syn、CD56、NSE等为特异性较高的神经内分泌标记物,其中CgA是特异性较高的神经内分泌标记物,对该瘤的诊断有很高的价值。Weissferdt等[4]报道CgA对于神经内分泌癌具显著特异性。故在纵隔神经内分泌癌的病理诊断及免疫组化分析中,需相互结合应用、综合分析。
3.2 纵隔神经内分泌癌的影像学表现及意义 纵隔神经内分泌癌影像学表现缺乏特异性,前中后纵隔内都可能发生,因此发生部分缺乏纵隔常见肿瘤的特异性;国内外文献[5-8]均报道病灶体积较大,密度欠均匀,呈浸润性生长,常沿血管间隙生长,易包绕血管及压迫周围食管及气管出现压迫症状,内部容易出现液化坏死区;该病属于富血供肿瘤,增强扫描通常强化较明显。本组病例增强扫描均出现中等以上的强化,2例内部出现液化坏死区,与文献基本一致。文献报道[9-10]神经内分泌癌病灶内可出现散在点状钙化,本组病例未出现钙化,可能与总结病例数较少有关。纵隔神经内分泌癌比较少见,手术切除是首选治疗方案,3、5与10年生存率分别为79%、75%和58%[11-12]。纵隔神经内分泌癌易出现远处转移,早期手术并联合放疗和化疗可以有效提高远期生存率。
本组病例显示18F-FDG PET-CT不仅能够确定原发病灶位置,还能发现隐匿的微小病灶(大于5 mm),神经内分泌癌PET-CT表现文献报道较少,本组资料18F-FDG PET/CT不仅可显示病灶糖代谢特点,还可发现远处骨骼以及淋巴结转移,为本病临床分期、治疗以及预后打下基础。
3.3 鉴别诊断 纵隔神经内分泌癌较难与部分肿瘤鉴别,如胸腺肿瘤,胸腺瘤易合并重症肌无力,约1/3胸腺瘤具有侵袭性,常合并多种副瘤综合征,FDG摄取值较低。胸腺癌呈形态不规则软组织肿块,肿瘤较大时易伴液化坏死区,增强强化较均匀,坏死区无强化,部分也具有很高的糖代谢[13],鉴别诊断有一定困难。
淋巴瘤:淋巴瘤多呈多发结节状肿块,多相互融合,增强扫描一般呈轻度强化,强化程度低于神经内分泌癌,且易于并发全身其他部位多发淋巴瘤浸润。
纵隔型肺癌:纵隔型肺癌为累肺上叶大气道形成肺不张,病灶紧贴与纵隔,常呈分叶状,边缘不规则,肿瘤常部分位于肺内。
纵隔神经内分泌癌的影像学,尤其是PET/CT影像学表现虽然具有一些特点,但与该部位的恶性肿瘤鉴别困难,确诊仍需要结合病理,尤其是免疫组化检查。文献[14-16]报道神经内分泌肿瘤细胞膜上生长抑素受体表达,而使用68Ga标记的生长抑素类似物68Ga-DOTATOC、68Ga-DOTATATE 与68Ga-DOTANOC常用于神经内分泌肿瘤及其各种生长抑素受体亚型的鉴别诊断,能够提高肿瘤分期的准确性,但国内尚未进入临床应用。本组病例较少,需有较多病例进行进一步总结讨论。
[1] 杨秋霞,吴 静,张 嵘.神经内分泌肿瘤的诊断研究进展[J].国际医学放射学杂志,2011,34(5):418-421.
[2] Rosai J,Higa E.Mediastinal endocrine neoplasm of probable thymic origin related to carcinoid tumor[J].Cancer,1972,29(4):1061-1074.
[3] Yao JC,Hassan M,Phan A,et al.One hundred years after“carcinoid”:epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United states[J].Clin Oncol,2008,26(18):3063-3072.
[4] Weissferdt A,Moran CA.Spindle cell thymomas with neuroendocrine morphology:a clinicopathological and immunohistochemical study of 18 cases[J].Histopathology,2014,65(1):111-118.
[5] 刘仁伟,曹火乃,杨亚英,等,纵隔神经内分泌癌的CT诊断与鉴别诊断[J].医学影像学杂志,2012,22(1):65-67.
[6] 刘海龙,刘 敏,刘 艳.纵膈神经内分泌癌的CT表现[J].医学影像学杂志,2013,23(4):510-513.
[7] 王东宝,张爱兵,赖 灿,等.胸腺神经内分泌癌的影像学表现(附5例报告)[J].中国临床医学影像学杂志,2007,18(1):46-49.
[8] 王俊鹏,孙 琳.纵隔类癌1例[J].实用放射学杂志,2008,24(10):13-27.
[9] Li J,Xia T,Zhang W,et al.Primary small cell neuroendocrine carcinoma of the mediastinum:computed tomography and histopathological correlation[J].Comput Assist Tomogr,2014,38(2):174-178.
[10]俞泽阳,龚建平,钱铭辉,等.胸腺神经内分泌肿瘤的临床、病理及 CT 表现[J].临床放射学杂志,2012,31(2):291-292.
[11] Stamatis G.Neuroendocrine tumors of the lung:the role of surgery in small cell lung cancer[J].Thorac Surg Clin,2014,24(3):313-326.
[12] Filosso PL,Guerrera F,Rendina AE,et al.Outcome of surgically resected thymic carcinoma:a multicenter experience[J].Lung Cancer,2014.83(2):205-210.
[13] Shintani Y,Inoue M,Kawamura T,et al.Multimodality treatment for advanced thymic carcinoma:outcomes of induction therapy followed by surgical resection in 16 cases at a single institution[J].Gen Thorac Cardiovasc Surg,2015,63(3):159-163.
[14] Schartinger VH,Dudas J,Url C,et al.68Ga-DOTA(0)-Tyr(3)-octreotide positron emission tomography in nasopharyngeal carcinoma[J].Eur J Nucl Med Mol Imaging,2014,42(1):20-24.
[15] Banerjee SR.Pomper MG.Clinical applications of 68 Gallium[J].Appl Radiat Isot,2013,76(10):2-13.
[16] Lopci E,Zanoni L,Fanti S,et al.Gallium-68 DOTANOC imaging in paraganglioma/pheochromocytoma:presentation of sample cases and review of the literature[J].Q J Nucl Med Mol Imaging,2013,57(2):134-145.
