海兰褐蛋鸡卵巢与输卵管FSHR及LHR基因定量的研究
2015-12-08何晶耿仁德计红马莉张虹亮孔凡志程晓旭杨焕民
何晶,耿仁德,计红,马莉,张虹亮,孔凡志,程晓旭,杨焕民
(1.黑龙江省农垦哈尔滨管理局动物卫生监督所,哈尔滨 150090;2.黑龙江省农垦总局建三江分局勤得力农场第六管理区;3.黑龙江八一农垦大学动物科技学院)
海兰褐蛋鸡卵巢与输卵管FSHR及LHR基因定量的研究
何晶1,耿仁德2,计红3,马莉3,张虹亮3,孔凡志3,程晓旭3,杨焕民3
(1.黑龙江省农垦哈尔滨管理局动物卫生监督所,哈尔滨 150090;2.黑龙江省农垦总局建三江分局勤得力农场第六管理区;3.黑龙江八一农垦大学动物科技学院)
为了研究鸡卵巢、输卵管子宫部、输卵管漏斗部FSHR及LHR基因表达水平差异,实验从海兰褐蛋鸡的子宫部、卵巢、漏斗部中提取总RNA,利用RT-PCR技术获得FSHR、LHR目的基因,并应用实时荧光定量PCR进行定量检测。结果显示卵巢组织FSHR mRNA表达水平显著高于子宫部与漏斗部组织(P<0.01),子宫部与漏斗部组织FSHR mRNA表达水平没有显著性差异;子宫部组织LHR mRNA表达水平极显著高于其他两组(P<0.01),但卵巢、漏斗部组织LHR mRNA表达水平没有显著性差异。实验通过研究鸡卵巢、输卵管子宫部、输卵管漏斗部FSHR及LHR基因表达水平差异,研究为今后研究禽类生殖生理提供基础数据和科学依据。
蛋鸡;促卵泡激素受体;促黄体生成素受体;基因表达量;荧光定量
促卵泡素(FSH)和促黄体素(LH)是家禽生殖系统的主要调控激素,其他有许多激素是通过对这两种激素分泌的影响而间接发挥调节作用的。FSH是垂体分泌的一种糖蛋白激素,是促进和维持性腺的正常发育和生殖功能的重要激素。它的生理作用是通过分布于颗粒细胞的特异性受体—FSH受体(FSHR)所介导。黄体生成素受体(Luteinizing hormone receptor,LHR)属于G蛋白偶联受体超家族
中的糖蛋白亚家族成员[1],可以加快卵巢的血液循环,促进被FSH预处理过的卵泡成熟并诱发排卵。尽管LH对卵泡发育和排卵的作用明显,但这种影响往往与其和FSH的协同是分不开的。
禽类的卵巢是产生卵细胞的部位;输卵管漏斗部,即输卵管的伞状部,是运送卵细胞和提供受精的部位,也是卵子的受精部位。而子宫部(壳腺部)主要是形成石灰质卵壳,防止细菌的侵入。目前,作为FSH和LH两种生殖激素受体FSHR与LHR在上述部位的表达水平少有研究,因此研究主要应用荧光定量PCR法检测海兰褐蛋鸡输卵管子宫部、卵巢、输卵管漏斗部FSHR及LHR受体基因表达水平,为今后研究禽类生殖生理、产蛋性能及生殖激素与抱性方面的学者提供基础数据和科学依据。
1 试验材料与方法
1.1 样品采集和试剂
选取实验室饲养的产蛋期海兰褐鸡6只,通过科学饲养并同时记录产蛋情况,可提前预测排卵时间。临检健康后,取海兰褐蛋鸡的卵巢、输卵管的子宫部和漏斗部样品,置于-80℃保存。
实验中采用的试剂主要有氯仿,异丙醇,乙醇,DEPC处理水,TRIzol,M-MLV反转录酶,TaKaRa Taq,反转录试剂盒,DNA marker,DNA凝胶回收与纯化试剂盒,6*loading Buffer,培养液(Hyclone M199),琼脂糖,Tris,EDTA,荧光染料等。
1.2 提取颗粒细胞总RNA
从-80℃冰箱中取出装有卵巢、输卵管子宫部和漏斗部样品各0.2 g,置于液氮预冷的研钵中用石英砂研磨至无可见颗粒。参考Trizol法RNA提取试剂盒操作说明提取细胞总RNA。
1.3 总RNA质量的检测
采用琼脂糖凝胶电泳与核酸定量分析仪鉴定RNA质量和浓度。
检测总RNA浓度及其纯度:将1 μL总RNA溶解于99 μL DEPC处理水中,应用核酸定量分析仪测定提取的RNA的OD值,OD260与OD280之间的比值应在1.6~2.0之间。
检测总RNA完整性以及有无严重的污染现象:取1 μL总RNA,1%琼脂糖凝胶电泳,检测5 S、18 S和28 S三条带,从而确定提取的总RNA是否能用于下一步试验。
1.4 PCR引物设计与合成
参考NCBI上注册发表的FSHR、LHR以及GAPDH(内参)原鸡核苷酸序列,利用Primer Primer5.0引物设计软件设计扩增海兰褐蛋鸡FSHR、LHR以及GAPDH基因的引物,以上引物均由上海生工生物工程技术服务有限公司合成,引物如下表1所示。
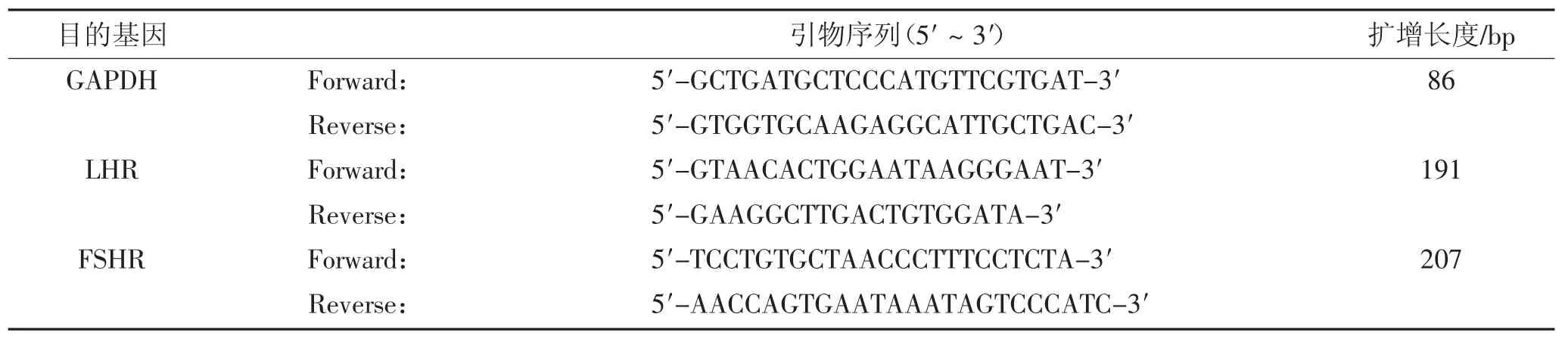
表1 目的基因引物与PCR扩增产物长度Table 1Primers of purpose gene and product length of PCR amplification
1.5 RT-PCR反应
分别加入1 μL 50 μM的Oligo(dT18),4 μL DEPC处理水到各样品提取的1 μL总RNA模板中,总体积为6 μL。均匀混合后70℃水浴10 min,取出后迅速放置于冰上2 min。离心使混合液沉于管底。在管中加入2 μL的5xM-MLV Buffer,0.5 μL的 10 mM的dNTP,0.25 μL的40 U·μL-1RNase Inhibitor,0.25~1 μL的DEPC处理水,使总体积为10 μL。混匀后42℃水浴60 min。完成上步骤,则置于70℃水浴15 min,取出后在冰上急冷1 min,离心使溶液沉于管底。将获得的cDNA用于下步PCR扩增试验。
1.6 PCR反应体系
将反转录cDNA作为模板,设计合成的FSHR、LHR和GAPDH基因的引物进行PCR反应,扩增达到相应的基因片段。50 μL PCR体系如表2:cDNA模板1.0 μL;10×PCR Buffer 5.0 μL;P1(20 pmol·μL-1)1.0 μL;P2(20 pmol·μL-1)1.0μL;dNTP Mixture(2.5 mmol·L-1each)8.0 μL;Taq酶(5 U·μL-1)0.5 μL,加水至总体积50 μL。
扩增FSHR基因的PCR反应参数为:94℃预变性5 min;94℃变性30 sec,56℃退火30 sec,35个循环;最后72℃延伸5 min。扩增LHR基因的PCR反应参数为:94℃预变性5 min;94℃变性30 sec,52℃退火30 sec,35个循环;最后72℃延伸5 min。GAPDH在以上两个PCR反应参数下均能反应。每个样品设3个重复孔,利用实时荧光PCR仪进行扩增。PCR反应后吸取5 μL反应产物进行凝胶检测,由于所扩增的基因片段都小于400 bp,故选用2.0%的琼脂糖凝胶电泳来检验扩增的结果,并应用紫外灯观察结果。
1.7 基因测序验证
从琼脂糖胶上切下与预期大小一致的PCR扩增产物,用DNA片段纯化试剂盒进行纯化,将其与PMD-18-T载体进行连接反应,转化DH5α感受态细胞,均匀涂布与氨苄抗性的LB固体培养基平板上,37℃温育12 h,挑取白色单个菌落,转移有约3~4 mL氨苄抗性的液体LB培养基中,37℃过夜。碱裂解法小剂量制备质粒,酶切和PCR鉴定,将鉴定为阳性的重组质粒送上海生工生物工程公司进行测序。测定结果应用生物信息学软件DNAstar与引物设计所参考的DNA序列,进行同源性分析,从而验证PCR产物的准确性。
1.8 荧光定量
使用SYBR Premix Ex TaqⅡ(宝生物染料法荧光定量试剂盒)进行荧光定量试验,反应体系与1.6一致。
2 结果
2.1 总RNA电泳结果
提取的蛋鸡组织总RNA,在1.0%琼脂糖凝胶电泳检测后,图1中可看到28 S、18 S和5 S这几条带。从上至下可观察到,28 S条带最亮,18 S条带略暗,5 S条带较暗,由此可知,提取的RNA较为完整,符合继续试验的要求。核酸蛋白测定仪测定RNA的OD260/280值在1.80~2.00之间,同样也符合试验要求。
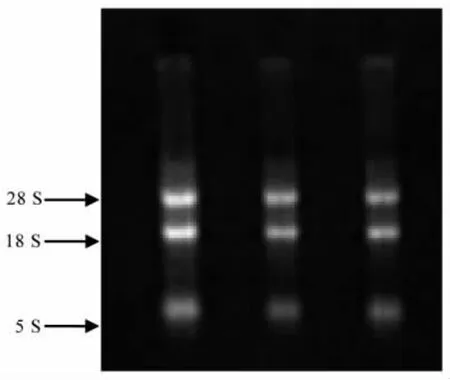
图1 RNA提取结果Fig.1Agarose gel electrophoresis of total RNA
2.2 RT-PCR扩增目的片段结果
采用RT-PCR扩增目的片段后,1%琼脂糖凝胶电泳。将凝胶置于紫外灯下观察,观察到与预期大小相符的目的条带(86 bp、207 bp、191 bp),且PCR扩增的产物条带单一,证明引物序列设计特异性较高,结果如图2。
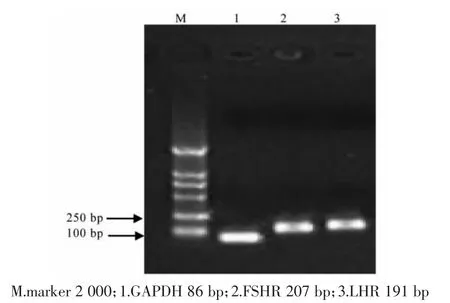
图2 GAPDH,FSHR,LHR目的基因PCR产物Fig.2Agarose gel electrophoresis of PCR product for GAPDH,FSHR and LHR
2.3 核酸序列测定结果与序列分析
利用DNAstar等软件分别对GAPDH、FSHR、LHR、基因重组质粒核酸序列,将其与参考序列进行同源性分析(进行序列对比时,上排序列为了试验扩增的鸡基因,下排为NCBI上发表的原鸡基因),结果如下。
GAPDH核酸测序结果与原鸡比对同源性为98.9%,如图3:
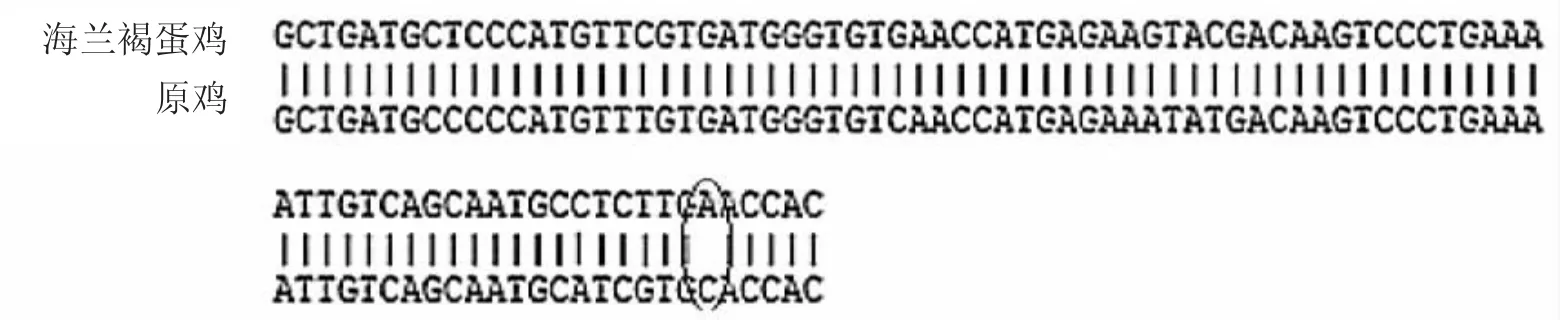
图3 克隆蛋鸡GAPDH基因片段与NCBI发表的原鸡序列的同源性分析Fig.3Homology analysis of the target gene segment of GAPDH clone and NCBI gallus
FSHR核酸测序结果与原鸡比对同源性为96.2%,如图4。
图4 克隆蛋鸡FSHR基因片段与NCBI发表的原鸡序列的同源性分析Fig.4Homology analysis of the target gene segment of FSHR clone and NCBI gallus
LHR核酸测序结果与原鸡比对同源性为98.95%,如图5。

图5 克隆蛋鸡LHR基因片段与NCBI发表的原鸡序列的同源性分析Fig.5Homology analysis of the target gene segment of LHR clone and NCBI gallus
2.4 荧光定量检测mRNA表达结果
应用荧光定量仪检测输卵管子宫部、卵巢、输卵管漏斗部三组中FSHR和LHR的表达情况(见图6和图7)。结果显示:如图6子宫部与漏斗部FSHR表达水平差异不显著,卵巢组织FSHR mRNA表达水平与其他两组存在极显著性差异(P<0.01);图7卵巢与漏斗部LHR表达水平差异不显著,子宫部LHR mRNA表达水平与其他两组存在极显著差异(P<0.01)。
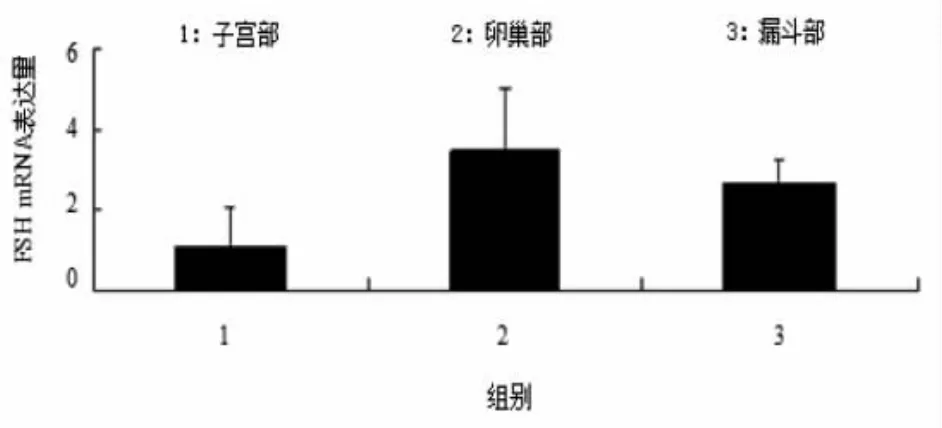
图6 FSHR mRNA的表达情况Fig.6Gene expression quantities of FSHR mRNA
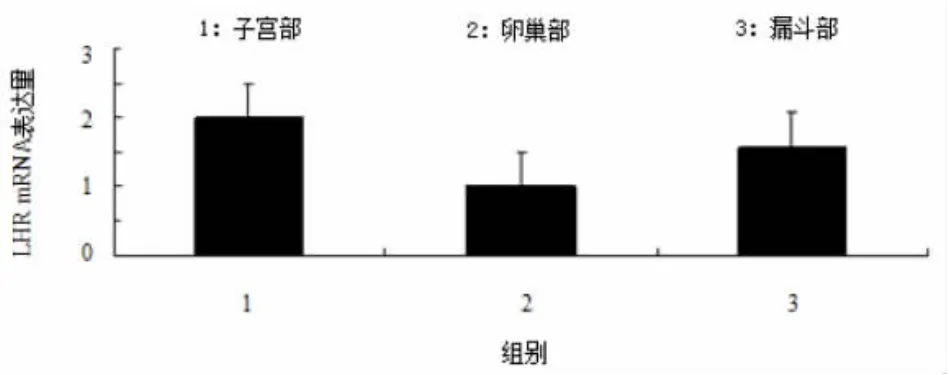
图7 LHR mRNA的表达情况Fig.7Gene expression quantities of LHR mRNA
3 讨论
与哺乳动物一样,禽类生殖活动也主要受生殖轴下丘脑、垂体、性腺轴的激素调节,受GnRH对促性腺激素细胞的刺激,垂体中促卵泡素(FSH)开始合成、分泌、转运[2]并最终作用于卵巢和睾丸的FSHR,合成并分泌相应的生殖腺激素参与繁殖行为的调节,诱导促黄体素(LH)等激素的合成与释放,从而促进卵泡的发育和成熟,对动物繁殖性状的调控起着重要作用。在过去的十多年里,人们也逐渐发现FSH和LH除了影响传统的性腺靶位点(如卵巢)外,促性腺激素受体还存在于整个生殖道的输卵管、子宫内膜、子宫肌层、子宫颈和子宫血管中[3]。
FSHR与LHR分别是FSH与LH发挥作用的结合位点,FSH和LH在动物繁殖领域具有重要作用,即能够调节性腺发育,调控性激素的分泌,维持动物第二性征和性行为,这使FSHR和LHR成为提高禽类产蛋性能的研究目标之一。方弟安等研究发现皖西白鹅在产蛋前1周FSHβ mRNA表达维持较高水平直至产蛋10天达最高,到休产期和就巢前期迅速下降,进入就巢末期,FSHβ mRNA水平在此上升达到较高水平[4-5]。FSHβ mRNA水平规律性变动说明FSH与皖西白鹅的产蛋关系密切[7]。试验检测了LHR和FSHR在蛋鸡的子宫部、卵巢、漏斗部的表达量差异,结果显示子宫部、卵巢、漏斗部FSHR存在显著差异,卵巢FSHR极显著高于其他两个部位,提示实验动物正处于产蛋高峰期,卵巢机能处于良好水平。输卵管漏斗部的FSHR有具有较高的表达量,因为漏斗部是禽类卵泡受精部位,提示FSH与FSHR结合后对禽类的受精有重要作用。
黄体生成素(LH)是由垂体前叶促黄体素细胞(嗜碱性细胞)产生的一种糖蛋白激素,在FSH的协同作用下促使排卵,形成黄体并分泌孕激素。在雌禽的排卵周期内,由于垂体不断释放FSH和LH,刺激卵泡生长发育,不断生长的卵泡合成孕酮逐渐增加,刺激垂体释放LH,当孕酮对垂体的刺激达到一定的阐值,引起LH的大量释放,使排卵前的LH达峰值,高水平的LH作用于成熟的卵泡促发排卵[8]。LH是潜在的能够调节输卵管功能的循环激素中的一种,并且已经在人、牛、猪和山羊的输卵管中证实了LHR的存在[9-10]。但是在研究中发现子宫部LHR mRNA显著高于其他两组,漏斗部和卵巢之间差别却不显著,提示LH对鸡输卵管子宫部功能可能有较大的调节作用。
实验成功提取了总RNA,反转了cDNA,成功的通过荧光定量PCR的技术检测LHR和FSHR在蛋鸡的子宫部、卵巢、漏斗部的表达量差异,为探索禽类产蛋性能机制奠定了重要基础。
[1]Menon K M,Munshi U M,Clouser C L,et al.Regulation of luteinizinghormone/humanchor-ionicgonadotropin receptor expression:a perspective[J].Biol Reprod,2004,70(4):861-866.
[2]陈永华.自然光周期条件下种鹅血清生化指标、生殖激素水平和组织中GnRH、FSH基因表达量的研究[D].扬州:扬州大学,2012.
[3]申颖,侯志高,王树迎.促性腺激素受体在子宫和输卵管中分布和作用的研究进展[J].动物医学进展,2007,28(6):86-88.
[4]方弟安,耿照玉,罗朝晖,等.皖西白鹅生殖周期中PRL、E2、LH和P4变化规律的研究[J].上饶师范学院学报,2009,29(3):71-76.
[5]姜润深,杜晓东,陈兴勇,等.皖西白鹅繁殖周期中垂体FSHmRNA的表达规律[J].中国农业大学学报,2010,15(6):84-88.
[6]谢佳,陈忠,王博,等.热应激对蛋鸡繁殖性能影响研究进展[J].动物医学进展,2011,32(6):112-115.[7]姜润深,杜晓东,陈兴勇,等.皖西白鹅繁殖周期中垂体FSH mRNA的表达规律[J].中国农业大学学报,2010,15(6):84-88.
[8]迟晓星,陈容,张丽媛.金雀异黄素对青年雌性大鼠血清性激素水平的影响[J].黑龙江八一农垦大学学报,2013,25(2):36-38.
[9]李广君,王慧,王树迎,等.济宁青山羊发情周期不同阶段LHR在输卵管的分布及其mRNA表达[J].中国农业科学,2011,44(15):3235-3245.
[10]Elizabeth A,Aaron M,Hsueh J W.Initial and cyclic recruit-mentofovarianfollicles[J].EndocrRev,2000,21:200-214.
Genetic Quantitative Research of FSHR and LHR in Ovary and Oviduct of Hy-line Brown Laying Hens
He Jing1,Geng Rende2,Ji Hong3,Ma Li3,Zhang Hongliang3,Kong Fanzhi3,Cheng Xiaoxu3,Yang Huanmin3
(1.Institute of Animal Health Supervision,Harbin Urban Administration of Land Reclamation Bureau in Heilongjiang Province,Harbin 150036;2.The Sixth District of Qindeli Farm of Jiansanjiang Land Reclamation Bureau,Heilongjiang Land Reclamation Bureau;3.College of Animal Science and Technology,Heilongjiang Bayi Agricultural University)
In order to study the expression level of FSHR and LHR in ovary,the tubal uterine department and fallopian tube funnel department,ovary,tubal uterine department and fallopian tube funnel department were obtained from Hy-line brown laying hens,and the total RNA was extracted.FSHR and LHR target genes were amplificatied by using qRT-PCR,and the amount of FSHR and LHR were detected by fluorescent quantitative PCR.The results showed that FSHR mRNA expression level in ovarian tissue was extremely significantly higher than in the tubal uterine department and fallopian tube funnel department(P<0.01),and FSHR mRNA expression level in the tubal uterine department and fallopian tube funnel department had no significant difference.LHR mRNA expression level in tubal uterine department was extremely significantly higher than in ovary and fallopian tube funnel department(P<0.01),and LHR mRNA expression level in ovary and fallopian tube funnel department had no significant difference.The study illustrated the expression of FSHR and LHR in ovary,tubal uterine department and fallopian tube funnel department,which provided the foundation for the study on reproductive physiology of poultry.
hens;FSHR;LHR;gene expression level;fluorescence quantitative
S879.3
A
1002-2090(2015)02-0027-05
10.3969/j.issn.1002-2090.2015.02.007
2014-08-15
何晶(1965-),女,高级兽医师,黑龙江八一农垦大学毕业,现主要从事禽类生殖生理学方面的研究工作。
杨焕民,男,教授,博士研究生导师,E-mail:yanghuanmin@aliyun.com。
