烟草NCED3基因的克隆及其干旱胁迫表达分析
2015-12-08牛志强刘国顺师婷婷张松涛贾宏昉张洪映崔红杨永霞
牛志强,刘国顺,师婷婷,张松涛,贾宏昉,张洪映,崔红,杨永霞
河南农业大学烟草学院,烟草行业栽培重点实验室,郑州市文化路95号 450002
生物技术
烟草NCED3基因的克隆及其干旱胁迫表达分析
牛志强,刘国顺,师婷婷,张松涛,贾宏昉,张洪映,崔红,杨永霞
河南农业大学烟草学院,烟草行业栽培重点实验室,郑州市文化路95号 450002
为揭示9-顺式环氧类胡萝卜素双加氧酶( 9-cis-epoxycarotenoid dioxygenase,NCED)在烟草生长发育过程中的功能,通过同源克隆方法获得烟草品种K326类胡萝卜素降解关键基因NCED3两个cDNA全长序列。序列分析表明:K326 NCED3-1和NCED3-2基因分别包含一个1842bp和1830bp的开放读码框(ORF),各编码613个和609个氨基酸。预测蛋白质分子量分别为68177.8 Da和67754.2Da,理论等电点(pI)各为7.66和7.28。跨膜区预测、亲水性和信号肽分析表明很可能是定位于线粒体膜上的亲水性跨膜蛋白。二级结构预测模型显示此蛋白结构以β折叠和无规则卷曲为主。蛋白三级结构预测分析表明NCED3-1与NCED3-2空间结构极为相似。PEG6000胁迫分析表明,干旱胁迫可以诱导NCED3基因表达以及内源ABA的积累。且在处理12h之前,NCED3表达与ABA累积速度均呈现升高趋势,之后逐渐降低。研究结果为解析NCED3在烟草抗旱方面的功能提供一定的研究基础。
烟草;NCED3基因;克隆;序列分析;表达;ABA
烟草类胡萝卜素是烟叶重要致香物质的前体物[1-3],其降解和热裂解可产生近百种香气化合物[4-5],同时还是一种防御化合物[6-7]。植物生长发育过程中,类胡萝卜素的含量不仅受到其合成调控的影响[8],还会受到一些生物和非生物途径分解的影响[9]。近年来,一个能裂解类胡萝卜素产生脱辅基类胡萝卜素被称为类胡萝卜素双加氧裂解酶(carotenoid cleavage dioxygenases、CCDs)的基因家族[10]已被鉴定。CCDs普遍存在于哺乳动物、植物和细菌中[11]。在模式植物拟南芥中,CCDs家族有9个成员(CCD1,4,7,8 和 NCED2,3,5,6,9)[12-14],其中 NCED2,3,5,6,9参与植物激素ABA的合成,NCED催化裂解9-顺式新黄质和9-顺式紫黄质,生成C15黄质醛和一个C25的副产物,黄质醛作为C15骨架经一系列变化形成ABA[15-16],ABA作为逆境信号在植物抗逆特别是抗旱中起着重要的作用[17-18]。相对于CCDs基因家族的其它成员而言,ABA合成关键酶基因NCED3的启动一直被认为是操纵ABA信号产生的关键机制[19]。目前,NCED3在大豆[20]、豇豆[21]、鳄梨[22]、拟南芥[23]和苹果[24]等植物中已有详细研究,在烟草中鲜有报道。鉴于此,本研究克隆了烟草K326 NCED3基因的全长cDNA序列,采用生物信息学软件对其进行分析,检测了PEG6000干旱胁迫处理对NCED3基因表达和ABA含量的影响,为进一步研究烟草NCED3基因功能奠定基础。
1 材料和方法
1.1 试验材料
试验材料为普通烟草品种K326。采用漂浮育苗,温室培养至5-6片真叶幼苗,移至含珍珠沙的花盆中培养。在光暗交替周期为12 h/12 h、温度为24℃-26℃、相对湿度为60%的光照培养室中培养,用1/2浓度的Hoagland培养液浇灌,两天一次。待幼苗长至7,8片叶(约6周)时,用于干旱处理。采用20%(200g/L)的PEG6000溶液对烟草幼苗进行渗透胁迫,以不加PEG6000的幼苗作为对照。每个处理3组重复,每组两株,在处理0、1、4、8、12、24、36、48、72h时取第三片叶,称其鲜重后置液氮中冻存备用。
大肠杆菌感受态细胞DH5α为本试验室保存。载体pMD19-T、普通Taq酶、高保真Pfu酶、MarkerDL2000等试剂购自TaKaRa;DNA凝胶纯化回收试剂盒和质粒纯化回收试剂盒购于Omega公司,改良的Hoagland’s (霍格兰氏)营养液,PEG6000(聚乙二醇)购自天津市福晨化学试剂厂,Real Time PCR 采用SYBR Green Master mix试剂盒(Vazyme),购自TaKaRa公司。
1.2 试验方法
1.2.1 NCED3全长基因的克隆
采用Trizol法提取RNA,并通过随机引物法将RNA反转录成cDNA。参考GenBank收录的烟草NCED3基因序列,采用Primer5.0软件设计引物NCED3F (5’-ATCAAAAATAGGTAACTATGGCA TC-3’)和 NCED3R(5’-CCACAACTTCAACTCTT AATTTCAC-3’)扩增烟草NCED3基因序列,PCR扩增程序为:94℃预变性5min;94℃变性30s,50℃退火30s,72 ℃延伸2min,共35个循环;72℃延伸10min。PCR 扩增产物采用1%琼脂糖凝胶分离。回收纯化后连接到 pMD19-T 载体,送生工生物工程(上海)股份有限公司进行测序。
1.2.2 序列分析
利用NCBI网站的软件BLAST和ORFfinder进行核苷酸序列比较和开放阅读框分析。运用DNAstar软件推测该基因编码的氨基酸序列,Expasy Protparam软件分析蛋白质的分子量、等电点和氨基酸组成。蛋白质的结构功能域用Conserved Domains和SMART软件进行预测。采用ProtScale、和TMpred软件进行蛋白质疏水性分析和跨膜区预测。用SignalP 4.1 Server和TargetP 1.1 Server分别进行蛋白的信号肽与导肽分析。蛋白质的二级结构使用在线工具SOPMA进行预测。三级结构采用在线软件Swiss-model进行模拟。在NCBI数据库下载与烟草K326 NCED3基因同源的氨基酸序列,采用ClustalW进行序列的多重比对分析,然后利用PHYLIP程序进行系统进化分析。
1.2.3 NCED3的表达分析
采用Primer 5.0软件设计引物(见表1),以烟草组成型表达的核糖体蛋白基因L25为内参。采用半定量RT-PCR和Real Time PCR进行表达差异研究。参照Invitrogen公司的RealMasterMix (SYBR Green)试剂盒说明书进行实时定量RT-PCR,每个样品3次重复。Real Time PCR 数据采用 2-ΔΔCt算法[25]进行分析,假设目的基因在PEG6000胁迫处理下的表达量是对照(不添加PEG6000)的N倍,N = 2-ΔΔCt,ΔΔCt =Treat(Ct样品 - Ct L25 ) - CK(Ct样品 - Ct L25)。
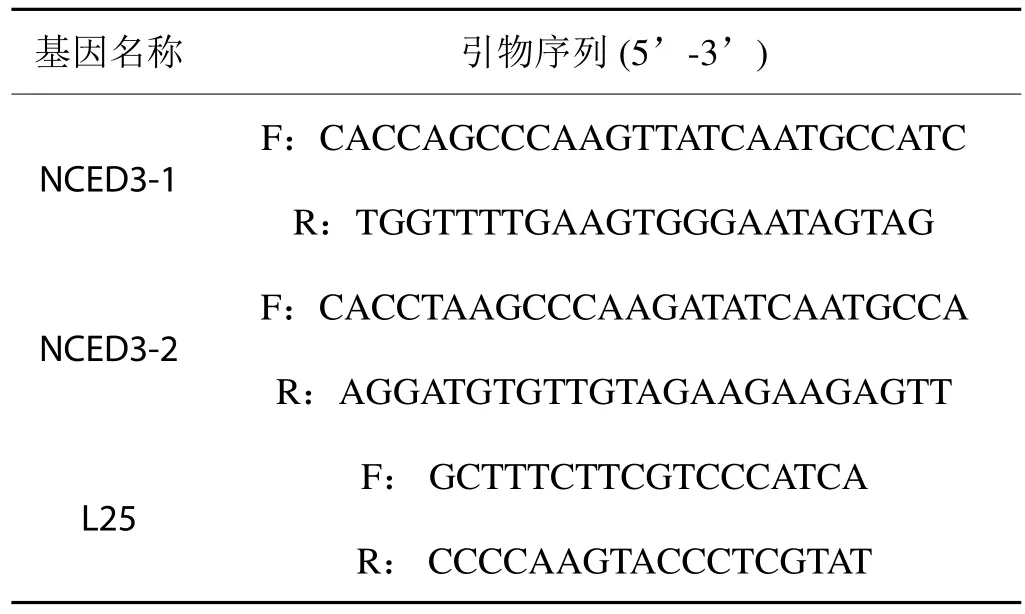
表1 引物序列Tab.1 Primer sequences
1.2.4 ABA含量测定
取样方法同上,按照ELISA试剂盒说明书进行ABA的提取和含量测定,用冰冷的80%甲醇提取,过C18柱以纯化激素提取液,用于酶联免疫测定,在酶联免疫分光光度计上依次测定标准物浓度和样品490nm处的OD值,根据logit曲线法计算样品ABA浓度。
1.3 数据处理
采用SPSS17.0数据处理系统软件进行数据的统计分析和Excel 2007作图。
2 结果与分析
2.1 NCED3全长基因的克隆
采用 TRIzol RNA方法提取K326的总RNA,并反转录为cDNA。经NCED3F/NCED3R引物PCR扩增,得到1800 bp左右的片段,回收目的片段,连接 pMD19-T 后转化DH5α感受态细胞,运用菌落 PCR 方法鉴定阳性克隆,送生物公司测序。结果表明 K326 包含两个NCED3 (NCED3-1与NCED3-2),序列提交Genbank,登录号分别为KM605434和KM605435,与NCBI收录的K326 NCED3-1基因序列(登录号JX101472.1)相似性分别为99%和97%。
2.2 NCED3基因和蛋白序列分析
2.2.1 NCED3基因与氨基酸序列分析
通过 ProtParam 和 ORFfinder 对所得到的K326 NCED3-1和K326 NCED3-2基因序列进行分析发现,NCED3-1基因包含一个 1842bp 的完整开放读码框(ORF),GC含量为40.99%。NCED3-2基因包含一个1830bp的ORF,GC含量为40.87%。NCED3-1和NCED3-2基因分别编码613个和609个氨基酸,其中碱性氨基酸(Arg、Lys)分别为70个和69个,强酸性氨基酸(Asp,Glu)各69个。预测的蛋白质分子量分别为68177.8 Da和67754.2Da,理论等电点(pI)分别为 7.66和 7.28。
2.2.2 NCED3氨基酸序列同源性分析
在NCBI的GenPept数据库中检索与烟草K326 NCED3同源的氨基酸序列,公共数据库中的同源序列多被命名为示9-顺式环氧类胡萝卜素双加氧酶,预测参与对干旱胁迫的应答反应。采用ClustalW进行序列多重比对,利用PHYLIP进行系统进化分析。结果表明,克隆得到的NCED3的两个 拷贝与普通烟草NCED3-1(分别为99%和97%)亲缘关系最近,其次为枸杞(分别为90%和89%)和马铃薯(分别为90%和89%)等茄科植物,而与葡萄(分别为74%和76%)和柑橘(均为76%)亲缘关系较远(图1)。
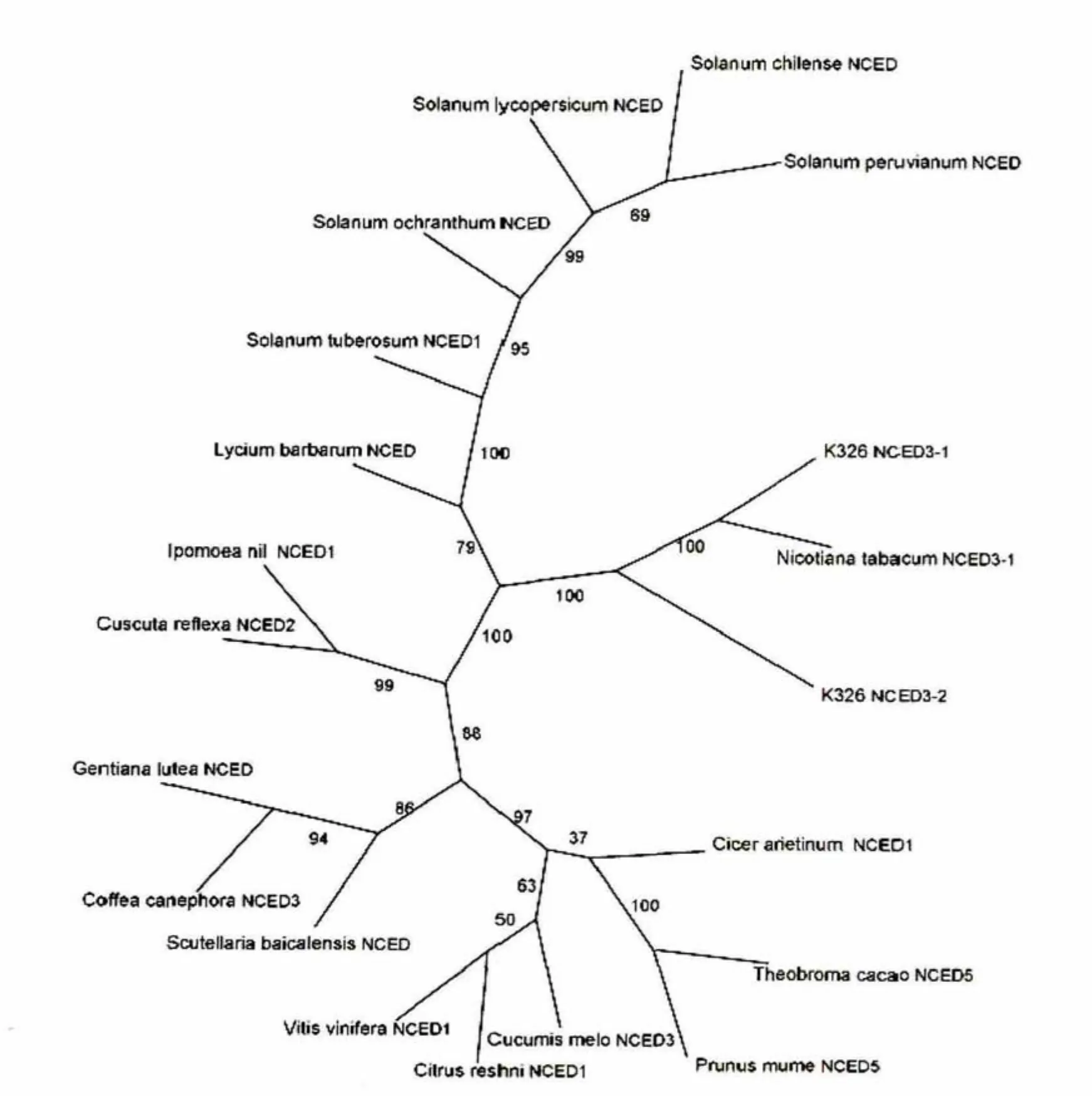
图1 NCED3系统进化树Fig.1 Phylogenetic tree of NCED3
2.2.3 NCED3蛋白质结构域分析
使用Conserved Domains在线分析软件对该基因的蛋白质结构域进行了比对分析和预测。由图2-1与图2-2可知,该基因编码的蛋白含有NCED3蛋白家族保守结构域,进一步表明克隆到的基因为编码NC ED3蛋白的基因。

图2-1 NCED3-1蛋白质结构域分析Fig.2-1 Protein domain analysis of NCED3-1

图2-2 NCED3-2蛋白质结构域分析Fig.2-2 Protein domain analysis of NCED3-2
2.2.4 NCED3蛋白质疏水性分析和跨膜区预测
蛋白质疏水性分析、跨膜区预测分析分别采用ProtScale和TMPRED软件进行。图3-1与图3-2分别表示的是NCED3-1和NCED3-2蛋白质疏水性分析结果。其疏水性最大值都为2.211,最大亲水峰有1处,其亲水性最大值都为-2.967,最大疏水峰有1处。在氨基酸间都找到分值很高的2个跨膜螺旋区,K326 NCED3-1第一个跨膜螺旋区位于239-272位氨基酸间,方向从膜内到膜外。第二个跨膜螺旋区位于235-251位氨基酸间,方向从膜内到膜外。K326 NCED3-2第一个跨膜螺旋区位于235-268位氨基酸间,方向从膜内到膜外。第二个跨膜螺旋区位于231-247位氨基酸间,方向从膜内到膜外。
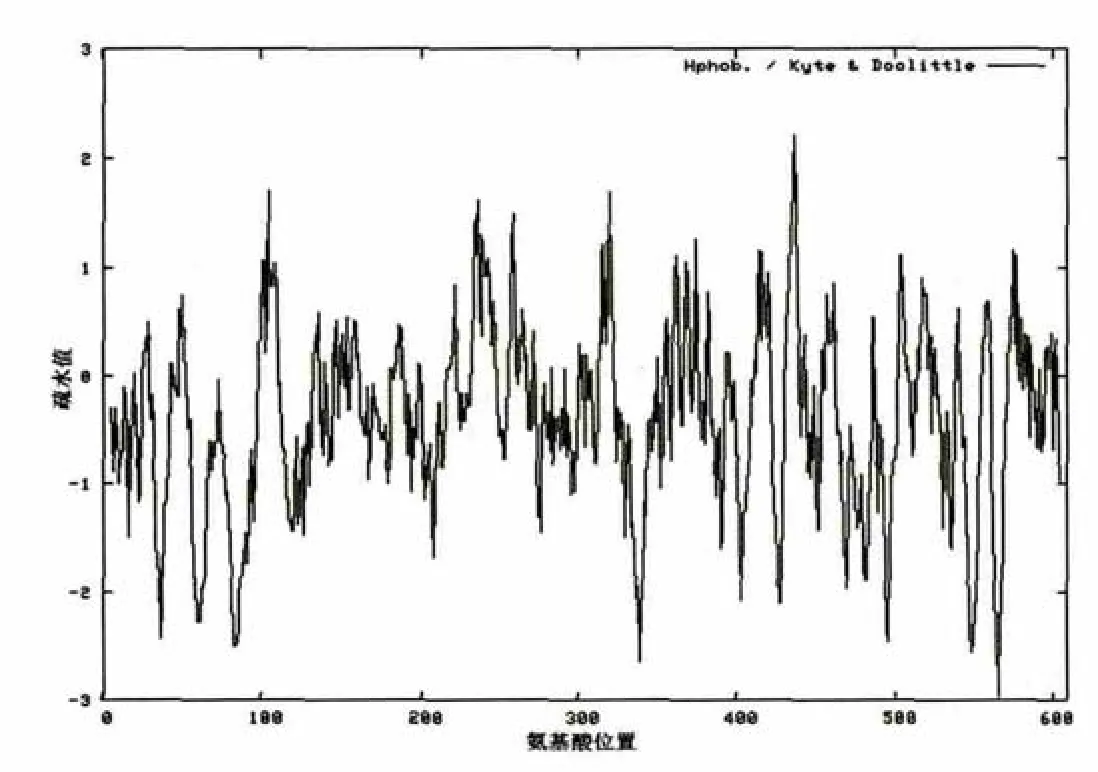
图3-1 NCED3-1蛋白质疏水性分析Fig.3-1 Protein hydrophobicity analysis of NCED3-1

图3-2 NCED3-2蛋白质疏水性分析Fig. 3-2 Protein hydrophobicity analysis of NCED3-2
2.2.5 NCED3蛋白质信号肽与导肽分析
用SignalP 4.1 Server对NCED3蛋白进行信号肽分析,结果表明NCED3-1和NCED3-2蛋白没有信号肽。用TargetP 1.1 Server对NCED3-1和NCED3-2蛋白进行导肽分析,这两种蛋白定位在线粒体上的分值分别为0.461和0.471,通过分泌途径运输的分值分别为0.026和0.030。
2.2.6 NCED3蛋白质二级结构分析
应用在线工具SOPMA预测该蛋白二级结构,结果表明,K326 NCED3-1和K326 NCED3-2蛋白质二级结构中分别含有13.61%和13.96%的α螺旋、23.44%和21.51%的延伸链、6.07%和5.42%的β折叠,56.89%和59.11%的无规则卷曲。β折叠和无规则卷曲是NCED3蛋白二级结构的主要成分。
2.2.7 NCED3蛋白质三级结构
将翻译后的氨基酸序列提交瑞士生物信息研究所Swiss-model,模拟蛋白三级结构,结果如图4所示。NCED3-1与NCED3-2蛋白三级结构极其相似,以β折叠和无规则卷曲为主。仅在无规则卷曲存在部分差异。

图4 NCED3-1与NCED3-2蛋白质三级结构模型Fig.4 Protein tertiary structure model of NCED3-1 and NCED3-2
2.3 PEG6000 胁迫下NCED3基因表达分析
图5为PEG6000处理烟株后NCED3的表达结果。由图可知,PEG6000 干旱胁迫处理可以诱导NCED3基因的表达,尤其是NCED3-2表达更为强烈。总体上,胁迫后NCED3-1和NCED3-2基因表达规律相同,均呈现随着PEG6000干旱胁迫处理时间增加,表达逐渐增强的趋势,且均在处理12h达到最强,之后缓慢减弱。本研究中胁迫处理1h的表达量要高于4h的表达量,这可能是由于烟株受胁迫刺激呈现强烈的应激反应导致。
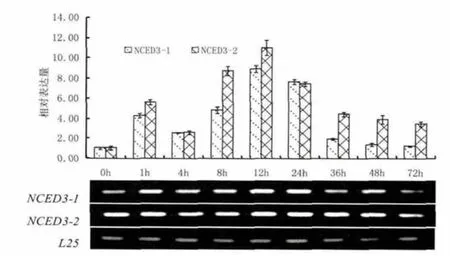
图5 NCED3对PEG6000干旱胁迫的应答模式Fig.5 Response pattern of NCED3 after PEG6000 drought treatment
2.4 ABA含量分析
由图6可知,20%PEG6000处理后,烟草叶片内源ABA含量呈现随着处理时间增加,逐渐升高的趋势。胁迫处理8h前烟草叶片内源ABA含量增加相对缓慢。处理8-12h,烟草叶片ABA含量急剧上升,12h后增速相对变缓。至48 h时,叶片ABA含量已升至94ng/g,是未处理前的3倍。
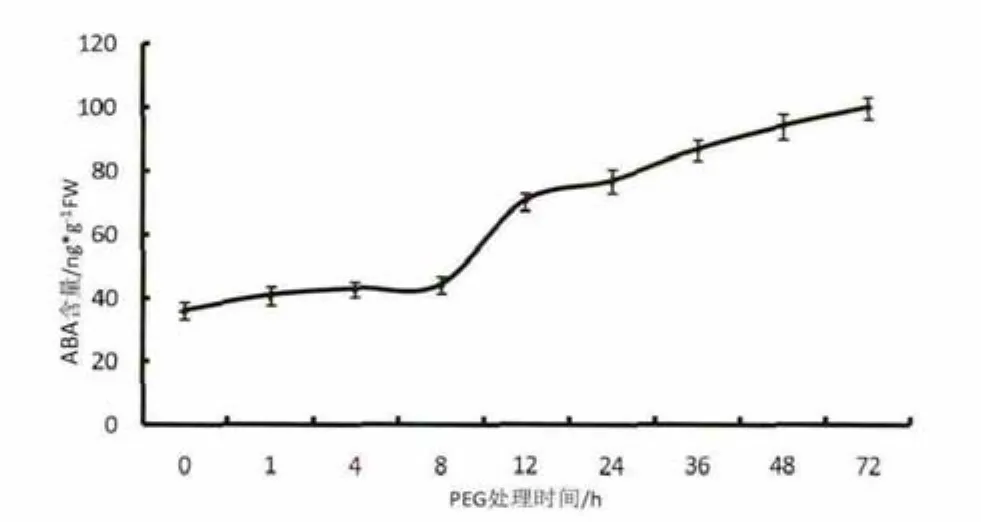
图6 PEG6000干旱胁迫下ABA累积曲线Fig.6 Cumulative curve of ABA after PEG6000 drought treatment
3 结论与讨论
本研究中,我们克隆并获得K326 NCED3基因两个拷贝的全长cDNA序列,同源性分析表明,它们与普通烟草及其它茄科类植物的NCED3基因同源性极高。说明这两个拷贝是烟草K326 NCED3基因。两个拷贝的核苷酸序列相似性达97.12%,长度存在12个碱基的差异,其编码蛋白的二级结构和三级结构也表现出高度的相似性,表明这两个拷贝功能可能类似。疏水性跨膜预测分析表明,K326 NCED3-1和NCED3-2均含有两个跨膜螺旋区,它们具有明显的亲水和疏水区,没有信号肽,这些特点可以推测NCED3-1和NCED3-2可能为跨膜蛋白,蛋白合成之后在细胞质线粒体膜上行使其功能。
以往的研究表明,NCED通过调控ABA合成在植物的抗逆抗旱中起着重要作用[26]。在烟草中过表达柑橘NCED基因,可增加正常和干旱模式下ABA的含量[27]。而外源添加ABA可以提高酸橘NCED3的表达水平[28],这说明,ABA信号的产生受NCED3基因的持续激活和ABA生物合成和分解代谢协同调控[29]。为此,我们采用PEG6000模拟干旱处理,研究了烟草NCED3基因表达及ABA的积累情况。结果发现,干旱胁迫可诱导NCED3-1和NCED3-2基因表达,且在处理12h之前表达急剧增加,之后有所降低。而干旱胁迫后烟草内源ABA的积累规律也说明12h前积累较快,之后呈缓慢增长趋势,这说明NCED3的表达不是瞬时性的,即一旦NCED3被诱导表达后其表达水平也将处于相对稳定的水平,ABA积累规律的研究结果与基因表达规律一致,这与任慧波等[29]的研究结果基本一致。前人研究发现,在烟草中过表达黄龙胆(GentianaLutea)和柱花草等(Stylosanthes guianensis)植物的NCED基因均可提高转基因植物的内源ABA水平、水分胁迫抗性、增加对强光和氧化胁迫的抗性进而提高烟草的耐旱和耐盐能力[30]。这说明NCED可以调节植物对于非生物逆境的适应能力。
本研究对烟草NCED的克隆和表达分析有助于了解烟草响应干旱胁迫的分子机制,为将来应用RNAi干扰和过表达技术研究该基因功能,并通过植物基因工程提高烟草的抗旱性及抗旱育种奠定一定的研究基础。
[1]刘彩云,刘洪样,常忠隆,等.烟草香气品质研究进展[J].中围烟草科学,2010(6): 75-78.
[2]过伟民,李伟脱,刘阳,等.烤烟类胡萝卜索含最与香气质量的关系[J].烟草科技,2010(1): 51-55.
[3]何承刚,曾旭波.烤烟香气物质的影响因素及其代谢研究进展[J].中国烟草科学,2005(2): 40-43.
[4]左天觉.烟草的生产、生理和生物化学[M].朱尊权,等译.上海:上海远东出版社,1993: 146-163.
[5]杨伟祖,谢刚,王保兴,等.烟草中胡萝卜素的热裂解产物的研究[J].色谱,2006,24(6): 611-614.
[6]Giuliano G,Tavazza R,Diretto G,et al.Metabolic Engineering of Carotenoid Biosynthesis in Plants[J].Trends Biotechnol,2008,26(3): 139-145.
[7]Tracewell C A,Cua A,Stewart D H,et al.Characterization of Carotenoid and Chlorophyll Photooxidation in Photosystem Ⅱ[J].Biochemistry,2001,40(1): 193-203.
[8]Moms W L,Ducreux L,Griffiths D W,et al.carotenogenesis during tuber development and storage in potato[J].J Exp Bot,2004,55: 975-982.
[9]Peter F,Holger z.Enzymic pathways for formation of carotenoid cleavage products[M].In: Britton G,Liaaen-Jensen S,Pfander H (eds) Carotenoids: natural functions,1st edn.Birkhäuser,Basel,2008:341-366.
[10]Walter M H,Strack D.Carotenoids and their cleavage products:biosynthesis and functions[J].Nat Prod Rep,2011,28(4):663-692.
[11]Auldridge M E,McCarty D R.Klee H J.Plant carotenoid cleavage oxygenases and their apocarotenoid products [J].Cur Opin Plant Bio,2006,9(3): 315-321.
[12]Schwartz S H,Qin X,Zeevaart J A D.Characterization of a novel carotenoid cleavage dioxygenase from plants[J].J Biol Chem,2001,276(27): 25208-25211.
[13]Auldridge M E,Block A,Vogel J T,et al.Characterization of three members of the Arabidopsis carotenoid cleavage dioxygenase family demonstrates the divergent roles of this multifunctional enzyme family [J].Plant J,2006,45(6):982-993.
[14]Tan Bao Cai,Joseph L M.Deng Wen Tao,et a1.Molecular characterization of the Arabidopsis 9-cis epoxycarotenoid dioxygenase gene family [J].Plant J,2003,35(1):44-56.
[15]Schwartz S H,Qin Xiaoqiong,Zeevaart J A D.Elucidation of the indirect pathway of abscisic acid biosynthesis by mutants,genes,and enzymes[J].Plant Physiol,2003,131:1591-1601.
[16]Milborrow B V.The pathway of biosynthesis of abscisic acid in vascular plant: a review of the present state of knowledge of ABA biosynthesis[J].J Exp Bot ,2001,52:1145-1164.
[17]Davies W J,Zhang J.Root signals and the regulation of growth and development of plants in drying soil[J].Annu Rev Plant Bio,1991,42(1): 55-76.
[18]Zhang Jianhua,Jia Wensuo,Yang Jianchang,et al.Role of ABA in integrating plant responses to drought and salt stresses[J].Field Crop Res,2006,97(1): 111-119.
[19]Ren Huibao,Gao Zhihui,Chen Li,et al.Dynamic analysis of ABA accumulation in relation to the rate of ABA catabolism in maize tissues under water deficit[J].J Exp Bot,2007,58(2): 211-219.
[20]Qin Xiaoqiong,Zeevaart J A D.The 9-cisepoxycarotenoid cleavage reaction is the key regulatory step of abscisic acid biosynthesis in water-stressed bean.Proc Natl Acad Sci U S A,1999,96: 15354-15361.
[21]Iuchi S,Kobayashi M,Yamaguchi K,Shinozaki K.A stress-inducible gene for 9-cis-epoxycarotenoid dioxygenase involved in abscisic acid biosynthesis under water stress in drought-tolerant cowpea.Plant Physiol,2000,123: 553-562.
[22]Chernys,J T,Zeevaart J A D.Characterization of the 9-cisepoxycarotenoid dioxygenase gene family and the regulation of abscisic acid biosynthesis in avocado[J].P1ant Physiol,2000,124:343-353.
[23]Neill S J,Burnett E C,Desikan R,et al.Cloning of a wiltresponsive cDNA from an Arabidopsis thaliana suspension culture cDNA library that encodes a putatived 9-cis-epoxycarotenoid dioxygenase[J].J Exp Bot ,1998,49: 1893-1894.
[24 ]Xia Hui,Wu Shan,Ma Fengwang,et al.Cloning and expression of two 9-cis-epoxycarotenoid dioxygenase genes during fruit development and under stress conditions from Malus[J].Mol Biol Rep,2014,41(10): 6795-6802.
[25]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CT method [J].Methods,2001,25: 402-408.
[26]Zhu Changfu,Kauder F,Romer S,et al.Cloning of Two Individual cDNA encoding 9-Cis-Epoxycarotenoid dioxygenase from Gentiana Lutea,their tissue-specific expression and physiological effect in transgenic tobacco[J].Plant Physiol,2007,164(2): 195-204.
[27]Xian Lihong,Sun Peipei,Hu Shuangshuang,et al.Molecular cloning and characterization of CrNCED1,a gene encoding 9-cis-epoxycarotenoid dioxygenase in Citrus reshni,with functions in tolerance to multiple abiotic stresses[J].Planta,2014,239(1): 61-77.
[28]Neves D M,Filho M A,Bellete B S,et al.Comparative study of putative 9-cis-epoxycarotenoid dioxygenase and abscisic acid accumulation in the responses of Sunki mandarin and Rangpur lime to water deficit[J].Mol Biol Rep,2013,40(9): 5339-5349.
[29]任慧波,范意娟,魏开发,等.NCED3基因的持续诱导及ABA合成与代谢的协同调控在拟南芥ABA信号积累中的作用[J].科学通报,2007,52(1):59-66.
[30]Zhang Yiming,Yang Jinfen,Lu Shaoyun,et al.Overexpressing sgnced1 in tobacco increases ABAlevel,antioxidant enzyme activities,and stress tolerance[J].J Plant Growth Regul,2008,27(2):151-158.
Cloning ofNCED3gene inNicotiana tabacumand analysis of its drought stress-induced expression
NIU Zhiqiang,LIU Guoshun,SHI Tinging,ZHANG Songtao,JIA Hong fang,ZHANG Hongying,CUI Hong,YANG Yongxia
Key laboratory of Tobacco Cultivation,College of Tobacco Science,Henan Agricultural University,Zhengzhou 450002,China
In order to reveal the function of NCED3 gene in tobacco plant growth and development,two copies (NCED3-1 and NCED3-2)of full-length cDNA sequence of tobacco nine-cis-epoxycarotenoid dioxygenase3 were cloned from K326 by homology cloning strategy.Sequences analysis showed that NCED3-1 and NCED3-2 contained 1842-bp and 1830-bp open reading frame (ORF ) and coded 613 and 609 amino acid residues,and the calculated molecular mass was 68177.8Da and 67754.2Da with the theoretical isoelectric point (pI) of 7.22 and 7.28,respectively.Protein hydrophobicity,transmembrane domains and signal peptide analysis indicated that the protein might be transmembrne and hydrophilic,and located on mitochondrial membrane.Secondary structure prediction results showed that they were mainly made up by beta turns and random coil.Tertiary structure prediction results displayed that NCED3-1 showed high similarity with NCED3-2.Expression patterns under abiotic stress responses suggested that PEG6000 could induce expression of NCED3 and accumulation of ABA.Expression of NCED3 and ABA accumulation rate both increased before 12h treatment,and then decreased gradually.These results provided some basis for drought function analysis of NCED3.
tobacco;NCED3;cloning;sequence analysis;expression;ABA
牛志强,刘国顺,师婷婷,等.烟草NCED3基因的克隆及其干旱胁迫表达分析[J].中国烟草学报,2015,21(3)
河南省教育厅自然科学研究项目(No.14B180034);中国烟草总公司特色优质烟叶开发重大专项浓香型项目(No.110201101001 TS-01)
牛志强(1987—),男,在读硕士研究生,研究方向为烟草生物技术,Email: nzq113@163.com
杨永霞(1980—),女,博士,讲师,研究方向为烟草生物技术,Tel: 0371-63558121,Email:yyx624@126.com
2014-10-12
: NIU Zhiqiang,LIU Guoshun,SHI Tinging,et al.Cloning of NCED3 gene in Nicotiana tabacum and analysis of its drought stress-induced expression [J].Acta Tabacaria Sinica,2015,21(3)
