甘木通总黄酮保护H2O2诱导的PC12细胞损伤
2015-12-08黄海潮张小红朱庆玲
黄海潮, 聂 阳, 张小红, 朱庆玲, 巫 玮, 周 捷
(1.广东食品药品职业学院实验实训中心,广东 广州510520;2.中山大学肿瘤防治中心药学部,广东广州510060)
甘木通总黄酮保护H2O2诱导的PC12细胞损伤
黄海潮1, 聂 阳1, 张小红1, 朱庆玲1, 巫 玮1, 周 捷2
(1.广东食品药品职业学院实验实训中心,广东 广州510520;2.中山大学肿瘤防治中心药学部,广东广州510060)
目的 探讨甘木通(Clematis filamentosa)总黄酮(TFC)对H2O2引起的大鼠肾上腺嗜铬细胞瘤细胞(PC12细胞)损伤的保护作用。方法 用H2O2损伤PC12细胞建立神经元氧化应激损伤模型,噻唑蓝 (MTT)法检测细胞存活率,观察甘木通总黄酮对神经元损伤的作用;形态学以及Hoechst 33258染色观察TFC对细胞形态的影响;生化法测定超氧化物歧化酶 (SOD)活性以及丙二醛 (MDA)的量。结果 与200μmol/L H2O2诱导的模型组对比,中 (10 μg/mL)、高 (100μg/mL)剂量甘木通总黄酮预处理细胞形态好于模型组,细胞活性明显增强 (P<0.05),细胞内的SOD活性增强 (P<0.05),MDA水平减低 (P<0.05)。结论 甘木通总黄酮对H2O2引起的神经损伤有保护作用。
甘木通;总黄酮;PC12细胞;SOD;MDA
脑中风是一组以脑部缺血及出血性损伤症状为主要临床表现的疾病,又称脑卒中或脑血管意外。其病因是由于脑血流供应障碍引起缺血和缺氧而导致局限性脑组织缺血性坏死或脑软化的疾病[1]。自由基诱导的脂质过氧化被认为是脑缺血及缺血后再灌注损伤的主要机制之一,使用H2O2诱导神经元凋亡,模拟氧化应激水平的升高对神经元的毒性作用是目前研究脑缺血中风的主要细胞模型[2]。
甘木通为毛茛科丝铁线莲(Clematis filamentosa Dunn)的叶,民间俗称为 “眼蛇药”,有活血通脉降压、镇静安神之功效。据 《全国中草药汇编》记载,甘木通对脑血管意外引起的中风偏瘫患者均有治疗作用。目前,对于甘木通研究集中在
心血管系统方面[3],其在神经系统尤其在脑中风中的作用还未见相关的文献报道。课题组通过提取分离甘木通总黄酮(total flavones from Clematis filamentosa,TFC),运用形态和功能与神经元相似的大鼠肾上腺嗜铬细胞瘤细胞 (PC12细胞)研究其神经保护作用,丰富其药物治疗的理论,便于其深入开发研究。
1 仪器与材料
1.1 细胞与试剂 大鼠肾上腺嗜铬细胞瘤细胞(PC12细胞)(购自中国医学科学院细胞研究所);甘木通药材 (购于广东康美药业中药饮片厂);细胞培养瓶、24孔板、96孔板 (美国Corning公司);DMEM培养基,马血清(美国Gibco公司);胎牛血清 (FBS)(杭州四季青公司);胰蛋白酶(美国Amresco公司分装);Triton X-100、噻唑蓝(MTT)、二甲基亚砜(DMSO)(美国Sigma公司);磷酸缓冲液 (PBS)(pH 7.2)(杭州吉诺生物医药技术有限公司);其他试剂均为分析纯。
1.2 仪器 水平离心机 (湘仪离心机厂);荧光倒置显微镜(德国Leica公司);CO2细胞培养箱、二级生物安全柜 (美国Thermo公司);酶标仪(美国BIO-TEK公司)。
2 方法与结果
2.1 甘木通总黄酮的制备 甘木通药材干燥后,粉碎备用,根据文献[4]采用表面活性剂-超声协同提取,甘木通总黄酮得率为1.06%。所得总黄酮用DMEM培养基超声溶解,无菌过滤备用。
2.2 细胞培养 将PC12细胞接种于含有5%FBS和5%马血清、100 U/mL青霉素、0.1 mg/mL硫酸链霉素的DMEM培养基中,于37℃、饱和湿度、5%CO2细胞培养箱中培养24 h后换液一次,细胞接种第3天,用0.25%的胰酶消化传代。细胞传代至第4代,取对数生长期PC12细胞,调整细胞数至4×104个/mL单细胞悬液,接种于96孔细胞培养板中,每孔加入100μL单细胞悬液,在37℃、体积分数5%CO2培养箱中培养至细胞融合度达到90%时,更换成无血清DMEM培养基,实验待用。
2.3 甘木通总黄酮对PC12细胞增殖的影响 取实验待用细胞,于每孔加入不同质量浓度的甘木通总黄酮,使其最终分别为0、0.1、1、10、100、1 000μg/mL。并设空白调零孔(只加DMEM培养基,不加细胞)。每组均设5个复孔,培养48 h,每孔加入5 mg/mLMTT 10μL,37℃继续培养4 h,弃上清液,每孔加入DMSO 100μL,用酶标仪检测各孔在490 nm波长下的吸光度 (D)值。通过吸光度值高低反映细胞的活力。细胞活性计算如下:细胞活性(%)=D药物组/D空白细胞组×100%
2.4 H2O2对PC12细胞的作用 取实验待用细胞,于每孔加入不同量的H2O2,使其终质量浓度分别为0、50、100、200、400、800μg/mL。每组均设5个复孔,培养12 h,每孔加入5 mg/mL MTT 10μL,37℃继续培养4 h,弃上清液,每孔加入DMSO 100μL,用酶标仪检测各孔在490 nm波长下的吸光度 (D)值。
2.5 不同质量浓度TFC对H2O2引起PC12细胞损伤的影响 取 “2.2”项实验待用细胞,实验分组为空白细胞组,H2O2损伤组(200μmol/L H2O2),并参照相关文献[5]设置阳性对照组 [200μmol/L H2O2+200μmol/L维生素E(VE)],低(200μmol/ L H2O2+1μg/mL TFC)、中(200μmol/L H2O2+ 10μg/mL TFC)、高剂量保护组(200μmol/L H2O2+100μg/mL TFC),TFC先加入PC12细胞中预保护24 h,再加入终浓度为200μmol/L的H2O2作用12 h,用MTT法观察TFC对H2O2引起PC12细胞损伤的影响。
2.6 TFC对PC12细胞形态的影响 取实验待用细胞,实验分成空白细胞组、H2O2损伤组(200μmol/L H2O2)、TFC预保护组(200μmol/L H2O2+100μg/mL TFC)、阳性对照组(200μmol/L H2O2+200μmol/L VE)。先加入药物预处理12 h,再加入终浓度为200μmol/L的H2O2作用12 h后,用倒置显微镜观察细胞形态变化。再加入4%的多聚甲醛固定,用10μg/mL的Hoechst33258对细胞进行染色10 min后,用荧光倒置显微镜观察细胞形态。
2.7 甘木通总黄酮对PC12细胞中SOD、MDA量的影响[6]实验分组为空白细胞组,H2O2损伤组(200μmol/L H2O2),低(200μmol/L H2O2+ 1μg/mL TFC)、中(200μmol/LH2O2+10μg/mL TFC)、高剂量保护组(200μmol/L H2O2+100 μg/mL TFC)。细胞接种于24孔板,先加入TFC预处理12 h,再加入终浓度为200μmol/L的H2O2作用12 h后,去除原培养液,用PBS洗2遍,每孔加入0.1 mol/L的PBS和0.05 mmol/m L的EDTA(pH 8.0)1 m L,再加入50μL 1%的Triton X-100,将培养板置振荡器振荡1 min使之溶解,加
入25%的H3PO4100μL,12 000 r/mim于4℃离心1 h,取上清液,按说明书测定 SOD活性和MDA水平。
3 结果
3.1 不同质量浓度TFC对PC12细胞活性的影响
结果所示在0~100μg/mL范围内,TFC对细胞的活性没有明显影响 (P>0.05),当达到1 000μg/mL时,TFC对细胞的活性下降较明显(P<0.05);因此,后面的实验设计不超过100μg/mL。结果如图1所示。
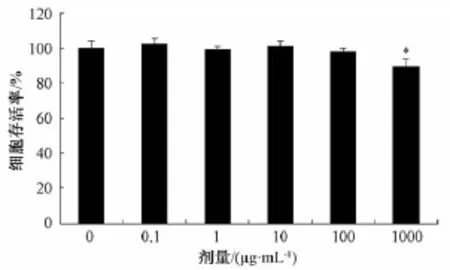
图1 甘木通总黄酮对PC12细胞活性影响 (,n=5)Fig.1 Effects of TFC on cell viability in PC12(,n= 5)
3.2 H2O2对PC12的损伤作用 H2O2对PC12细胞的抑制作用明显,在H2O2达到50μmol/L时,细胞增值率明显下降 (P<0.05),随着浓度的加大,细胞活性降低明显,当超过400μmol/L时,抑制趋缓,表明在该浓度下,接近最大抑制浓度。结合实验结果,参考对比相关文献[5-8],选择H2O2损伤PC12细胞的浓度为200μmol/L,见图2。
3.3 TFC对H2O2引起PC12细胞氧化损伤的作用H2O2明显抑制PC12细胞的活性,在低剂量TFC预保护下,H2O2对细胞的损伤程度减轻,但作用不明显(P>0.05),在中高剂量TFC下,TFC的保护作用明显,细胞损伤程度明显减少 (P<0.05)。阳性对照组对H2O2引起的细胞损伤同样具有保护作用。结果见图3。
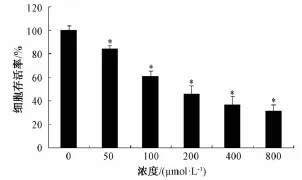
图2 H2O2对损伤PC12细胞活性影响(,n=5)Fig.2 Effects of H2O2on cell viability in PC12(,n=5)

图3 甘木通总黄酮对H2O2损伤PC12细胞活性的影响(,n=5)Fig.3 Effects of TFC on PC12 cells viability injured by H2O2(,n=5)
3.4 TFC对H2O2损伤PC12细胞形态的影响 分别用倒置显微镜和荧光显微镜观察,空白细胞组呈不规则多角形,Hoechst染色显示空白细胞组中的PC12细胞核呈暗蓝色;在H2O2诱导下,细胞轮廓变得模糊,Hoechst结果显示,亮蓝色增多明显,表明细胞碎片增多;阳性对照组与TFC预保护组显示细胞形态较损伤组完好,细胞贴壁生长明显增多,细胞形态部分恢复;Hoechst结果显示细胞碎片较损伤组减少,结果显示TFC能减轻H2O2引起PC12细胞凋亡的损伤作用。结果见图4。
3.5 TFC对SOD活性以及MDA水平的影响 与空白细胞组对比,H2O2损伤组明显减少SOD的活性,MDA水平明显增加。TFC预保护组中,低剂量组与模型组没有明显的区别 (P>0.05),中、高剂量组与模型组对比,SOD活性增加明显,MDA水平降低。结果见表1。
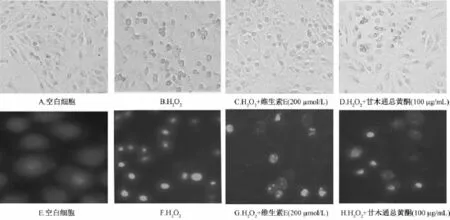
图4 甘木通总黄酮对H2O2诱导PC12细胞损伤形态影响Fig.4 Effects of TFC on H2O2-injured PC12 cellsmorphology
表1 TFC对H2O2损伤PC12细胞SOD活性和M DA水平的影响 (,n=3)Tab.1 E ffects of TFC pretreatment on activity of SOD and level of MDA in H2O2-injured PC12 cells(,n=3)
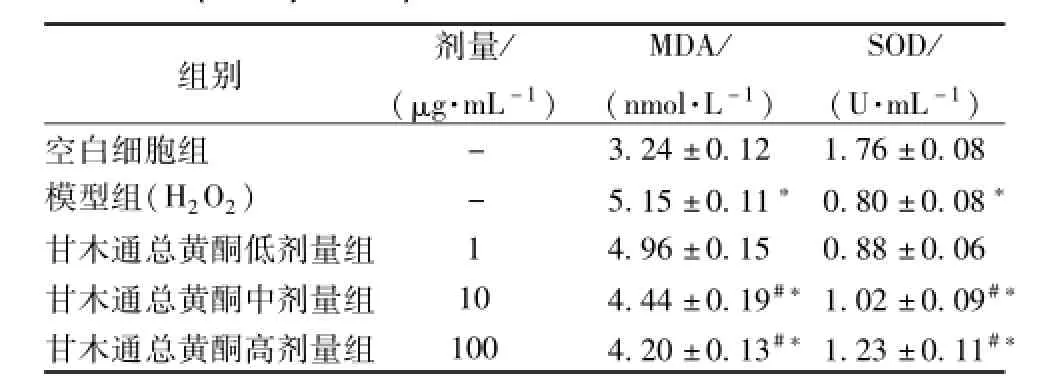
表1 TFC对H2O2损伤PC12细胞SOD活性和M DA水平的影响 (,n=3)Tab.1 E ffects of TFC pretreatment on activity of SOD and level of MDA in H2O2-injured PC12 cells(,n=3)
注:与空白细胞组比较,*P<0.05;与模型组比较,#P<0.05
组别 剂量/(μg·m L-1)MDA/(nmol·L-1)SOD/(U·m L-1)- 3.24±0.12 1.76±0.08模型组(H2O2) - 5.15±0.11*0.80±0.08*甘木通总黄酮低剂量组 1 4.96±0.15 0.88±0.06甘木通总黄酮中剂量组 10 4.44±0.19#*1.02±0.09#*甘木通总黄酮高剂量组 100 4.20±0.13#*1.23±0.11#*空白细胞组
4 讨论
氧化应激(oxidative stress)是指机体在遭受各种有害刺激时,体内或细胞内活性氧(reactive oxygen species,ROS)的产生与抗氧化之间失衡,从而导致ROS在体内蓄积,并引起一系列生物反应的过程[9]。正常脑组织中含高水平的不饱和脂肪酸、儿茶酚胺和高水平的氧化代谢,是最易受氧自由基侵袭的靶器官,加上脑组织清除自由基的能力较差,对活性氧引起的损伤更加敏感[10];因此,氧化应激等非传统风险因素已成为缺血性卒中(ischemic stroke,IS)研究的焦点[11]。MDA是神经元脂质过氧化的产物,SOD是神经元内存在抗氧化系统中重要的生物酶,MDA水平以及SOD活性可以评价神经损伤的程度。Hoechst 33258常用于检测细胞核完整性。正常的细胞核在染料作用下颜色暗淡蓝色;在细胞损伤的情况下,细胞核形态改变甚至皱缩破裂,表现出核质聚集,并呈现典型的椭圆状的颜色透亮凋亡核小体。Hoechst 33258染色可以通过蓝色荧光的强弱以及核小体的大小、形态反映细胞的完整性以及凋亡损伤情况。
实验结果显示,在H2O2诱导PC12细胞12 h,细胞皱缩明显,碎片增多,Hoechst 33258核染显示,细胞损伤严重,透亮的核小体大量出现,MTT结果显示细胞活性降低明显,SOD活性降低,MDA水平升高,表明H2O2诱导PC12细胞损伤的细胞氧化应激模型成功。中、高剂量TFC预保护能明显减少细胞损伤中核小体的出现,减少细胞凋亡的出现并使细胞恢复正常的形态;MTT结果显示,TFC具有明显保护H2O2引起的细胞损伤;SOD以及MDA结果表明TFC能降低H2O2对神经元造成的氧化应激的损害,提示TFC对神经元的保护作用与提高SOD活性,降低MDA水平有关。
[1] Kulik T,Kusano Y,Aronhime S,et al.Regulation of cerebral vasculature in normaland ischemic brain[J].Neuropharmacology,2008,55(3):281-288.
[2] Kaminsky Y G,Kosenko E A.Effects of amyloid-beta peptides on hydrogen peroxide-metabolizing enzymes in rat brain in vivo[J].Free Radic Res,2008,42(6):564-573.
[3] 胡宗礼,黄晓萍,陈珺霞.甘木通抗心肌缺血的有效部位与作用研究[J].中国药学杂志,2011,46(9):668-670.
[4] 聂 阳,黄勇红,李 博,等.表面活性剂-超声协同提
取甘木通总黄酮工艺的研究[J].中成药,2013,35(9):2040-2042.
[5] 刘静波,刘文超,徐梦蕾,等.基于PC12细胞模型分析大豆蛋白水解物对神经元氧化损伤的保护作用[J/OL].现代食品科技,[2015-01-21].http://www.cnki.net/kcms/detail/44.1620.TS.20150121.1521.008.html.
[6] 胡炜彦,于浩飞,张荣平.人参皂苷Rg3对H2O2导致海马神经元损伤的保护作用研究[J].中成药,2014,36(4):670-674.
[7] 王世博,邱景富,白群华,等.黄芪甲苷对H2O2致PC12细胞氧化应激损伤的保护作用[J].中国药理学通报,2011,27(11):1603-1609.
[8] 赵文杰,何 丽,张 茜,等.卷柏总黄酮对H2O2所致PC12细胞损伤的保护作用[J].中国医药指南,2012,10(3):224-225.
[9] Chade A R,Lerman A,Lerman L O.Kidney in early atherosclerosis[J].Hypertension,2005,45(6):1042-1049.
[10] 黄海潮.KIAA0280在缺氧诱导神经元凋亡中的作用研究[D].广州:广东药学院,2008.
[11] 王志成,吕晓红.缺血性脑卒中的氧化应激相关因子研究进展[J].中风与神经疾病杂志,2013,30(1):87-89.
Neuroprotective effects of total flavones from Clematis filamentosa against H2O2-induced injury to PC12 cells
HUANG Hai-chao1, NIE Yang1, ZHANG Xiao-hong1, ZHU Qing-ling1, WUWei1, ZHOU Jie2
(1.Experiment Center of Guangdong Food and Drug Vocational College,Guangzhou 51O52O,China;2.Departmentof Pharmacy,SUN YAT-SENUniversity Cancer Center,Guangzhou 51OO6O,China)
AIM To study neuroprotective effects of total flavones from Clematis filamentosa(TFC)on H2O2-induced injury to rat pheochromocytoma cells(PC12 cells).M ETHODS The viability of PC12 cells injured by H2O2was determined by MTT assay.The cellularmorphology was observed by Hoechst33258 staining to evaluate protective effects of TFC on the injured cells.The SOD viability and MDA levels were detected by biochemical methods.RESULTS Compared with the model group,cell viability and SOD activity of TFC pretreated groups(10μg/mL,100μg/mL)were higher(P<0.05)and the MDA levelwas lower(P<0.05)obviously.
Clematis filamentosa;total flavone;rat pheochromocytoma cells(PC12 cells);SOD;MDA
R285.5
A
1001-1528(2015)12-2585-05
10.3969/j.issn.1001-1528.2015.12.003
2015-05-26
广东省中医药局中医药强省项目 (20141197);广东省医学科学技术研究基金项目 (B2013071);广东食品药品职业学院自然科学项目 (2012YZ007)
黄海潮(1982—),男,硕士,实验师,从事活性物质筛选研究。Tel:(020)28854990,E-mail:huanghac@gdyzy.edu.cn
CONCLUSION TFC shows neuroprotective effects on PC12 cells injured by H2O2.
