参松养心胶囊对糖尿病大鼠心房重构及心律失常的影响
2015-12-08汪莲开陈世健胡建华
张 莉, 汪莲开, 陈世健, 胡建华
(湖北民族学院附属民大医院心内科,湖北恩施445000)
[药 理]
参松养心胶囊对糖尿病大鼠心房重构及心律失常的影响
张 莉, 汪莲开, 陈世健, 胡建华*
(湖北民族学院附属民大医院心内科,湖北恩施445000)
目的 探讨参松养心胶囊 (人参、麦冬、山茱萸、丹参、酸枣仁、桑寄生等)对糖尿病 (DM)大鼠心房重构及心律失常的影响。方法 雄性SD大鼠60只,随机均分为正常对照组、糖尿病组和参松养心胶囊组。腹腔注射链脲佐菌素制备糖尿病模型。参松养心胶囊组给予连续6周参松养心胶囊灌胃治疗,糖尿病组和正常对照组则给予等体积生理盐水灌胃。药物干预后,在整体心脏Langendorff灌流条件下行离体电生理研究,记录和测量高位右心房(HRA)、右心耳(RAA)、低位右心房 (LRA)及右心房游离壁 (RAFW)的单相动作电位 (MAP)、有效不应期(ERP),同时给予Burst快速电刺激诱发房性心律失常;Masson染色评价心房纤维化程度;检测血清中超氧化物歧化酶(SOD)、丙二醛(MDA)和谷胱甘肽过氧化物酶(GSH-Px)水平;ELISA法检测血清肿瘤坏因子-α(TNF-α)及白细胞介素-6(IL-6)水平;Western blot检测右心房L型钙电流蛋白(Cav1.2)表达。结果 与正常对照组相比,糖尿病组心房各记录位点测量百分之90动作电位时程 (APD90%)和ERP均延长,APD90%及ERP离散度、房性心律失常诱发率、Cav1.2表达量、心肌纤维化程度、血清TNF-α、IL-6和MDA水平均增加,而血清SOD和GSH-Px水平降低 (P均<0.01);与糖尿病组相比,参松养心胶囊组各记录位点APD90%和ERP均缩短、APD90%及ERP离散度、房性心律失常诱发率、Cav1.2表达量、心肌纤维化程度、血清TNF-α、IL-6和MDA水平均降低,而血清SOD和GSH-Px水平升高 (P均<0.01)。结论 参松养心胶囊降低糖尿病大鼠房性心律失常诱发率,其机制可能与参松养心胶囊减轻糖尿病大鼠心房电重构及纤维化程度有关。
参松养心胶囊;糖尿病;心律失常;心房重构;氧化应激;炎症
糖尿病 (DM)患者易并发各种心律失常,其中心房颤动 (房颤)尤为多见。既往流行病学研究显示糖尿病不仅是房颤发生的独立危险因素,其还增加房颤患者脑卒中的发生率和死亡率[1-2]。虽然糖尿病导致房颤的机制目前尚不明确,但有研究显示长期血糖升高可引起心房的电重构及结构重构并导致房颤的产生[3-4]。参松养心胶囊是依据络病学理论,由人参、麦冬、山茱萸、丹参、酸枣仁 (炒)、桑寄生、赤芍、土鳖虫、甘松、黄连、南五味子、龙骨研制而成的一种复方制剂。我们前期研究表明参松养心胶囊具有减轻糖尿病大鼠心室电重构和结构重构并抑制室性心律失常的作用[5],但参松养心胶囊对糖尿病引起的心房重构及心律失常的影响目前仍不清楚。因此,本研究拟对这一问题进行探讨,以期为参松养心胶囊用于防治糖尿病引起的房性心律失常治疗提供相关的理论依据。
1 材料与方法
1.1 动物糖尿病模型制备及分组 雄性SD大鼠60只,体质量250~300 g,购自武汉大学医学部实验动物中心 (合格证号 SCXK[鄂]2007-0006)。将动物随机分为正常对照组、糖尿病组和参松养心胶囊组,每组各20只。采用一次性腹腔注射链脲佐菌素(60 mg/kg)法制备糖尿病模型,具体制备方法参照我们既往研究[5]。在链脲佐菌素注射72 h后,采用尾静脉采血检测随机血糖,血糖水平>16.7 mmol/L以上的动物视作糖尿病模型制备成功[5]。在糖尿病造模后的第4天立即开始药物干预,参松养心胶囊组给予参松养心胶囊连续6周灌胃 (1 g/kg),糖尿病组和正常对照组则给予等体积的生理盐水灌胃。
1.2 实验方法
1.2.1 血液生化检查 每组各选取5只动物,给予戊巴比妥钠 (30 mg/kg)麻醉后,采用断头法将大鼠处死,取3.5 mL全血,室温放置1 h后置于离心机中,在4℃下1 000 r/min离心10 min,分离血清后,EP管分装置于-80℃冰箱保存待测。超氧化物歧化酶 (SOD)的检测采用黄嘌呤氧化酶法;丙二醛 (MDA)检测采用硫代巴比妥酸法;谷胱甘肽过氧化物酶 (GSH-Px)检测采用紫外分光光度法;IL-6及TNF-α水平检测采用ELISA试剂盒 (RD公司,美国),操作过程严格按照试剂盒说明书在全自动酶标仪上完成。
1.2.2 Western blot检测L型钙通道蛋白(Cav1.2)表达量 前述动物在完成采血后立即开胸,剪取右心房组织 (50~100 mg),使用匀浆器进行匀浆并提取膜蛋白,采用BCA法对蛋白定量分析后将膜蛋白样本置于-80℃冰箱待用。匀浆及提取膜蛋白的具体步骤及方法参照我们既往文献[6]。采用12%的聚丙烯酰胺凝胶电泳分离膜蛋白,随后将膜蛋白电转至硝酸纤维素膜上,置于含5%脱脂奶粉的TBST缓冲液中室温封闭3 h,随后分别加入抗Cav1.2单克隆抗体I抗 (1∶1 000)和抗GAPDH单克隆抗体Ⅰ抗 (1∶2 000),4℃孵育过夜。第2天,采用TBST缓冲液对膜洗涤3次(每次15 min),室温加入相应的Ⅱ抗 (1∶1 500)孵育1 h,随后再次TBST缓冲液洗膜3次 (每次15 min)。采用增强化学发光法将膜置于暗处反应5 min,后X光片曝光显影和定影,凝胶成像系统拍照。
1.2.3 离体电生理研究 将每组剩余的动物麻醉后开胸,立即取出心脏连接于Langendorff离体灌
流装置 (专利号200820191402.4),经主动脉逆行Tyrode's液灌流(10~12 mL/min),灌流液保持37℃恒温。具体操作步骤及Tyrode's灌流液配方参照文献 [5]。
1.2.3.1 记录单相动作电位(MAP)及测量有效不应期(ERP) ①MAP的记录:将一对铂金刺激电极置于高位右心房 (HRA)心外膜行基础周长为300 ms的S1S1程控刺激 (刺激脉冲宽度为2 ms,强度为舒张期起搏阈值的2倍),分别记录HRA、右心耳(RAA)、低位右心房(LRA)及右心房游离壁(RAFW)四个部位的MAP(见图1)。使用Chart7.0软件对5个连续稳定的MAP波形进行分析,测量90%MAP时程 (MAPD90%)。②ERP的测量:将刺激电极置于HRA行S1S2程序化刺激测量前述4个部位的ERP。在连续发放8个起搏刺激波S1后发放早搏刺激波S2,S1S1的基础周长及起始的S1S2刺激间期均为300 ms,刺激脉冲强度为舒张期起搏阈值的2倍。具体刺激方法及步骤参照我们既往研究[5]。APD/ERP的离散度定义为四个记录部位最长的APD/ERP与最短APD/ERP的差值。
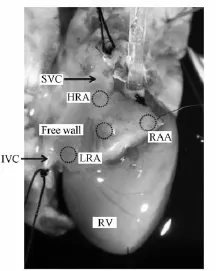
图1 右心房各实验记录位点示意图Fig.1 Photograph of right atrial preparation
1.2.3.2 诱发房性心律失常 将刺激电极置于HRA,给予50 Hz持续2 s的Burst刺激,行房性心律失常诱发,总刺激时间小于2 min。房性心律失常持续时间超过2 s被记为房性心律失常诱发成功。
1.2.4 Masson染色评价心房肌纤维化 在离体电生理实验完成后,每组各取6个心脏剪取右心房心肌组织,经10%甲醛溶液固定8~12 h后,采用乙醇梯度脱水并常规石蜡包埋、切片,随后进行Masson染色。Masson染色使胶原纤维在光镜下呈蓝绿色,而心肌细胞则呈红色。光镜下拍照、电脑存储,采用Image Pro-Plus软件对心肌纤维化进行分析,测量心房肌间质胶原总面积和图像总面积用以计算胶原容积百分比(collagen volume fraction,CVF)。
1.3 统计学处理 使用SPSS 17.0统计软件进行数据分析,正态分布计量资料以均数±标准差()表示,两组间均数比较采用t检验,多组间比较采用方差分析;计数资料以率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 动物一般情况 本研究中所有糖尿病造模动物在链脲佐菌素注射72 h后,血糖水平均高于16.7 mmol/L,全部纳入本次研究。在给予普通饲料和充足饮水喂养6周后,除糖尿病组和参松养心胶囊组各有2只和1只动物因腹泻死亡外,其他动物均存活,最终纳入各组的动物只数为:正常对照组20只,糖尿病组18只及参松养心胶囊组19只。
2.2 血液炎症、氧化应激指标结果 与正常对照组相比,糖尿病组血清TNF-α、IL-6和MDA水平均明显增加,而血清SOD和GSH-Px水平显著降低(P均<0.01);与糖尿病组相比,参松养心胶囊组血清SOD和GSH-Px水平明显升高,而血清TNF-α、IL-6和MDA水平显著降低(P均<0.01)(表1)。这些结果提示参松养心胶囊治疗减轻了糖尿病大鼠的炎症及氧化应激反应。
2.3 L-Ca2+通道的蛋白表达结果 Western blot实验检测Cav1.2蛋白在3组动物间的表达,结果显示,与正常对照组相比,糖尿病组心房肌Cav1.2蛋白表达水平显著升高 (P<0.01);而与糖尿病组相比,参松养心胶囊组Cav1.2蛋白表达水平却明显降低 (P<0.01)(图2)。这一结果提示糖尿病可引起的L-型Ca2+通道表达水平的增加,而参松养心胶囊组治疗减轻了糖尿病对L-型Ca2+通道表达量的影响。
2.4 离体电生理研究结果 各组最终纳入离体电生理研究的动物只数为:正常对照组15只,糖尿病组13只,参松养心胶囊组14只。与正常对照组相比,糖尿病组四个记录位点的APD90%和ERP均延长,APD与ERP的离散度及房性心律失常诱发率 (92.30%比6.67%)均显著增加 (P<0.01);与糖尿病组相比参松养心胶囊组APD90%和ERP均缩短,APD90%、ERP的离散度及房性心律失常诱发率 (50.00%比92.30%)均减小 (P均<0.01)(图3和4)。这些结果表明参松养心胶囊治疗减轻了糖尿病引起的心房电生理特性的改变,并降低了糖尿病大鼠房性心律失常的可诱发性。
表1 3组动物药物干预6周后血液生化指标的比较 (,n=5)Tab.1 Com parison of oxidative stress and inflammation m arkers in three groups(,n=5)

表1 3组动物药物干预6周后血液生化指标的比较 (,n=5)Tab.1 Com parison of oxidative stress and inflammation m arkers in three groups(,n=5)
注:与正常对照组比较,*P<0.01;与糖尿病组比较,#P<0.01
组别 SOD/(U·mL-1) MDA/(nmol·L-1) GSH-Px/(U·m L-1) IL-6/(pg·m L-1) TNF-α/(pg·mL-1)110.78±7.63 3.56±0.82 370.31±12.18 118.78±12.64 152.67±8.96糖尿病组 79.70±6.09* 8.08±1.06* 319.79±12.54* 187.76±10.62* 216.84±13.05*参松养心胶囊组 96.05±5.72# 5.65±0.82# 347.93±8.37# 148.02±10.90# 188.18±8.30正常对照组#
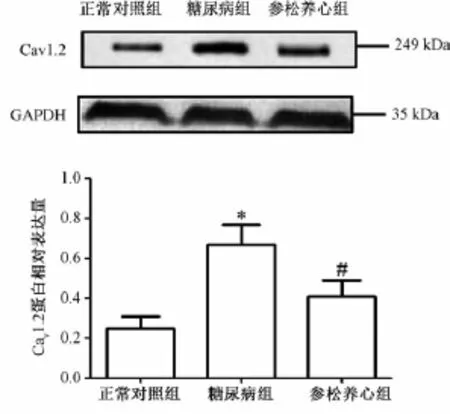
图2 3组动物L-型钙通道 (Cav1.2)蛋白表达水平Fig.2 Expression levels of L-type calcium channel in rats w ith d ifferent treatm ents
2.5 各组动物Masson染色及心肌胶原纤维定量分析结果 Masson染色显示正常对照组心房肌间胶原堆积少,糖尿病组心房肌间胶原纤维堆积明显多,参松养心胶囊组心房肌间胶原堆积量介于两者之间。胶原纤维定量分析结果提示,糖尿病组的CVF显著高于正常对照组 [(15.32±2.35)%比
(3.14±0.89)%,P<0.01],而参松养心胶囊组的CVF却较糖尿病组显著降低[(8.76±1.67)%比 (15.32±2.35)%,P<0.01],见图5。以上结果说明参松养心胶囊治疗能有效的降低糖尿病引起的心房肌纤维化。
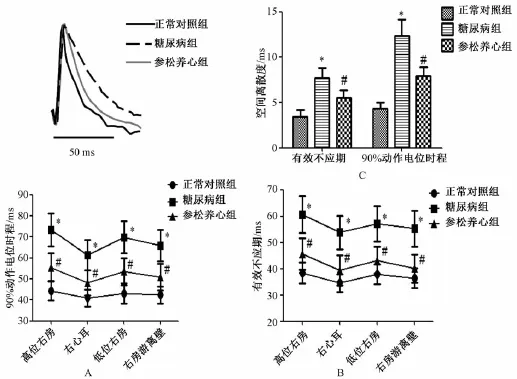
图3 3组动物各记录位点的动作电位时程 (A)和有效不应期 (B)及其空间离散度 (C)Fig.3 Results of APD(A),ERP(B)and spatial dispersions of APD and ERP(C)in rats w ith different treatments
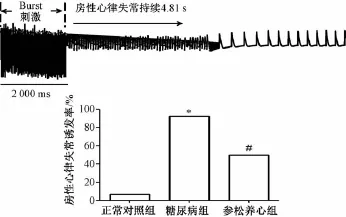
图4 3组动物房性心律失常诱发率Fig.4 Exam p les of atrial arrhythm ia and inducibility of AA in ratswith different treatments
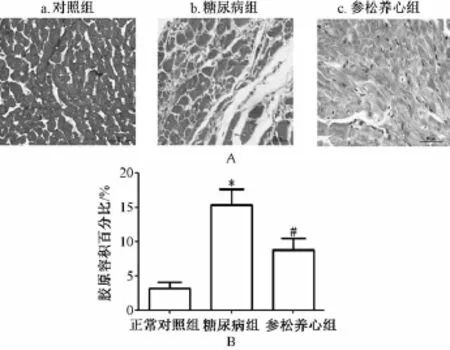
图5 3组动物心房M asson染色 (×400)(A)及心房肌间质胶原容积百分比 (B)Fig.5 Results of myocardial Masson staining(A)and collagen volum e fraction(B)in rats w ith differen t treatments(×400)
3 讨论
临床研究结果显示糖尿病患者发生房颤的机率较非糖尿病患者增加40%~110%,而房颤患者中10%~25%合并有糖尿病[1-2]。这些流行病学研究结果提示糖尿病是房颤发生的独立危险因素。对于糖尿病导致房颤的病理生理机制目前尚不明确,但一些动物实验结果表明持续的血糖升高可引起心房发生电重构和结构重构进而促进糖尿病动物房性心律失常的发生[3-4,7]。此外,一些以糖尿病心房电重构和结构重构为作用靶点的药物被证实具有抗房性心律失常的作用[8-9]。我们前期研究表明持续的参松养心胶囊干预降低了糖尿病大鼠室性心律失常的发生[5],但参松养心胶囊干预对糖尿病引起房性心律失常的影响既往并无相关研究。在本研究中,我们首次报道了持续的参松养心胶囊干预可降低了糖尿病大鼠房性心律失常的诱发率,这一结果提示参松养心胶囊今后或许可用于临床上糖尿病引起房性心律失常的治疗。
既往细胞水平研究显示糖尿病动物心房L-型Ca2+电流 (ICa)电流密度较正常对照组显著增加[4,10],而Huang等人[8]发现STZ诱导的糖尿病大鼠模型在造模完成后的第4周其心房组织ICa的mRNA水平即较正常对照组显著升高。在本研究中,Western blot结果显示ICa的蛋白表达量较正常对照组显著增加,这一结果提示我们糖尿病动物心房ICa电流密度增加可能与ICa的蛋白表达量增加有关。ICa是决定APD长短的重要离子流,其电流密度的增加可引起APD的延长。在本研究中参松养心胶囊干预后减轻了糖尿病引起的APD90%延长,这可能与参松养心胶囊干预降低了ICa的蛋白表达量进而减小ICa有关。此外,有研究显示心房APD延长可促进房颤发生[11],而Watanabe等人[3]证实心房APD延长与糖尿病大鼠房性心律失常的发生密切相关。此外,ICa电流增强还可通过引起细胞内钙超载而促进房颤的发生[10]。因此,参松养心胶囊干预降低糖尿病大鼠房性心律失常 (AA)的诱发率可能与减小心房ICa电流有关。
在本研究中,我们还观察到参松养心胶囊干预降低了糖尿病大鼠APD和ERP的空间离散度。在生理情况下,心肌组织的APD和ERP存在一定的空间差异性,然而APD和ERP空间离散度的显著增加将导致传导阻滞及折返的形成,进而促进房性心律失常的发生[12]。因此,我们认为参松养心胶囊可通过降低糖尿病大鼠心房复极空间离散度进而降低房性心律失常的诱发率。
持续血糖升高会产生大量活性氧 (ROS),包括超氧自由基和过氧化氢等,而ROS的大量聚集会激活氧化应激反应[13]。此外,糖尿病又是一种以伴有多种炎症因子(如TNF-α和IL-6)升高为
特征的自身炎症性疾病[14]。在氧化应激反应及炎症反应的作用下心房肌成纤维细胞将发生增殖和迁移,并最终分化为成肌纤维细胞,成肌纤维细胞又可分泌基质金属蛋白酶,使胶原纤维合成增加,进而引起心房纤维化[9]。在本研究中,参松养心胶囊干预一方面降低了糖尿病大鼠血清氧化损伤标志物MOD水平而升高了抗氧化酶SOD及GSH-Px的血清水平,另一方面降低了糖尿病大鼠血清炎症标志物TNF-α和IL-6的水平。这些结果提示参松养心胶囊对糖尿病大鼠发挥了抗炎抗氧化的作用,从而减轻糖尿病引起的心房纤维化。此外,大量研究结果显示以心房纤维化为特点的心房结构重构,一方面降低了电信号的传导速度,造成局部传导阻滞以促进房颤发生,另一方面还可导致心房组织传导的不均一性促进形成折返环以利于房颤的维持[15]。因此,参松养心胶囊降低了糖尿病大鼠心房纤维化程度可能是其降低糖尿病大鼠房性心律失常发生率的另一个主要原因。
总之,本研究发现参松养心胶囊干预可降低糖尿病大鼠房性心律失常诱发率,其机制可能与参松养心胶囊减轻糖尿病大鼠心房电重构及纤维化程度有关。
[1] KannelW B,Wolf PA,Benjamin E J,etal.Prevalence,incidence prognosis,and predisposing conditions for atrial fibrillation:population based estimates[J].Am JCardiol,1998,82(8A):2-9.
[2] Klem I,Wehinger C,Schneider B,et al.Diabetic atrial fibrillation patients:mortality and risk for stroke or embolism during a 10-year follow-up[J].Diabetes Metab Res Rev,2003,19(4):320-328.
[3] Watanabe M,Yokoshiki H,Mitsuyama H,et al.Conduction and refractory disorders in the diabetic atrium[J].Am JPhysiol Heart Circ Physiol,2012,303(1):H86-H95.
[4] Liu C,Fu H,Li J,etal.Hyperglycemia aggravatesatrial interstitial fibrosis,ionic remodeling and vulnerability to atrial fibrillation in diabetic rabbits[J].Anadolu Kardiyol Derg,2012,12(7):543-550.
[5] 陈世健,胡建华,刘 韬.参松养心胶囊对糖尿病大鼠心室电生理特性及结构功能变化的影响[J].中国病理生理杂志,2014,30(8):1439-1444.
[6] 李华波,陈世健,胡建华,等.通心络对心肌梗死大鼠心室缝隙连接蛋白43重构及室性心律失常的影响[J].中国病理生理杂志,2015,31(2):274-278.
[7] Kato T,Yamashita T,Sekiguchi A,et al.What are arrhythmogenic substrates in diabetic ratatria?[J].JCardiovasc Electrophysiol,2006,17(8):890-894.
[8] Huang W,Wang Y,Cao Y G,etal.Antiarrhythmic effects and ionic mechanisms of allicin on myocardial injury of diabetic rats induced by streptozotocin[J].Naunyn Schmiedebergs Arch Pharmacol,2013,386(8):697-704.
[9] 富华颖,李广平,刘长乐.普罗布考对糖尿病兔心房重构及心房颤动发生的干预作用[J].中华临床医师杂志 (电子版),2012,24(6):7978-7981.
[10] 富华颖,刘长乐,李 健,等.糖尿病兔心房电生理及L型钙电流的变化[J].中国心脏起搏与心电生理杂志,2012,26(3):254-257.
[11] Li N,Timofeyev V,Tuteja D,etal.Ablation ofa Ca2+-activated K channel(SK2 channel)results in action potential prolongation in atrialmyocytes and atrial fibrillation[J].J Physiol,2009,587(Pt5):1087-1100.
[12] Chauhan V S,Downar E,Nanthakumar K,et al.Increased ventricular repolarization heterogeneity in patients with ventricular arrhythmia vulnerability and cardiomyopathy:a human in vivo study[J].Am JPhysiol HeartCirc Physiol,2006,290(1):H79-H86.
[13] Pitocco D,Zaccardi F,Di Stasio E,et al.Oxidative stress,nitric oxide,and diabetes[J].Rev Diabet Stud,2010,7(1):15-25.
[14] 刘长乐,刘 彤,李广平.炎症、氧化应激与糖尿病心房重构[J].天津医药,2013,41(5):506-508.
[15] Cha T J,Ehrlich JR,Zhang L,et al.Dissociation between ionic remodeling and ability to sustain atrial fibrillation during recovery from experimental congestive heart failure[J].Circulation,2004,109(3):412-418.
Effects of Shensong Yangxin Capsules on atrial rem odeling and arrhythm ia in rat w ith diabetesmellitus
ZHANG Li, WANG Lian-kai, CHEN Shi-jian, HU Jian-hua*
(Department of Cardiovascular,Minda Hospital Affiliated to Hubei University for Nationalities,Enshi 445OOO,China)
AIM To explore the effects of Shensong Yangxin Capsules(SSYX)(Ginseng Radix et Rhizoma,0 phiopogonis Radix,Corni Fructus,Salviaemiltiorrhizae Radix et Rhizoma,Ziziphi spinosae Semen,TaxilliHerba,etc.)on atrial remodeling and arrhythmia in rat hearts with diabetesmellitus(DM).METHODS Sixty male rats were equally and randomly divided into three groups:the control(CTL)group,DM group and SSYX group.The DM group and SSYX groupswere injected streptozotocin.And then the SSYX group was administered with SSYX for six weeks,while physiological saline was applied to the DM and the CTL group.After finishing the drug treatment,whole Langendorff-perfused heartmodel was used to conduct the electrophysiological study.The monophasic action potential(MAP)and the atrialeffective refractory period(ERP)were recorded andmeasured in high right atrialwall(HRA),right atrial appendage(RAA),low right atrial wall(LRA)and atrial free wall(RAFW).Atrial arrhythmia was induced by Burst pacing.Myocardial fibrosis of atrium was evaluated by
Shensong Yangxin Capsules(SSYX);diabetes mellitus;arrhythmia;atrial remodeling;oxidative stress;inflammation
R285.5
A
1001-1528(2015)12-2573-06
10.3969/j.issn.1001-1528.2015.12.001
2015-07-13
湖北省恩施州科技局指导项目 (恩州科业 [2013]15-4,15-5号);湖北民族学院附属民大医院项目 (MDYY[2014]10号)
张 莉 (1976—),女,主治医师,研究方向为冠心病及心律失常。Tel:(0718)8301777,E-mail:836196359@qq.com
*通信作者:胡建华 (1964—),男,主任医师,研究方向为冠心病及心律失常。Tel:(0718)8301777,E-mail:13986845698@ 163.com
Masson's trichrome staining.Systemic oxidative stress has been evaluated by measuring plasma MDA,SOD and GSH-Px.Additionally,the plasma levels of TNF-αand IL-6 were alsomeasured by ELISA.The protein expression of L-type calcium channel(Cav1.2)was detected by Western blot.RESULTS Compared with the CTL group,the ERPand 90%action potential duration(APD90%)were prolonged;the spatialdispersion of ERPand APD90%,inducibility of atrial arrhythmia,degree ofmyocardial fibrosis,plasma levels of TNF-α,IL-6 and MDA increased;while the plasma levels of SOD and GSH-Px declined,in the DM group(all P<0.01).In addition,compared with the DM group,the SD of ERP and APD90%,inducibility of atrial arrhythmia,degree ofmyocardial fibrosis,plasma levels of TNF-α,IL-6 and MDA decreased,while the plasma levels of SOD and GSH-Px were elevated,in the SSYX group(all P<0.01).CONCLUSION SSYX treatment can reduce the inducibility to atrial arrhythmia in DM ratwith relation to the attenuation of electrical remodeling and myocardial fibrosis.
