芦苇叶黄酮类提取物体内体外抗氧化性研究
2015-12-07余晓红朱雪梅李凤伟彭英云
余晓红,朱雪梅,李凤伟,薛 锋,彭英云
(盐城工学院化学与生物工程学院,江苏 盐城 224003)
芦苇叶黄酮类提取物体内体外抗氧化性研究
余晓红,朱雪梅*,李凤伟,薛 锋,彭英云
(盐城工学院化学与生物工程学院,江苏 盐城 224003)
研究醇提芦苇叶黄酮类提取物的体内体外抗氧化性。通过测定芦苇叶黄酮类提取物对体外大鼠肝组织匀浆、肝线粒体丙二醛(malondialdehyde,MDA)生成量及大鼠红细胞溶血的影响。结果表明:芦苇叶黄酮类提取物在0.5~10 mg/mL范围内能抑制大鼠肝组织匀浆及肝线粒体MDA的生成,抑制大鼠红细胞溶血,具有量效关系,表明芦苇叶黄酮类提取物具有体外抗氧化效果。随着剂量的增加,芦苇叶黄酮类提取物可提高S180荷瘤小鼠血清中谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和超氧化物歧化酶(superoxide dismutase,SOD)活性,降低MDA含量,从而提高其体内抗氧化活性,当剂量达到300 mg/(kg·d)时,芦苇叶黄酮类提取物与10 mL/(kg·d)的氟尿嘧啶均可促进荷瘤小鼠体内抗氧化能力的提高,且二者间没有显著性差异。
芦苇叶;黄酮;抗氧化;体内体外
芦苇(Phragmites communis Trin.)为禾本科芦苇属植物,具有生长能力强、分布面积广等特点,在世界范围内起着极重要的生态作用,因而有“第二森林”之称[1]。芦苇的经济价值主要是用做编织、造纸和建材,其根和叶均可入药[2]。有研究表明,芦苇保健产品具有降低血糖、去除脂肪、调节血压、软化血管等作用[3-4]。而芦苇叶含有黄酮类化合物,使其具有较好的保鲜和抗氧化作用[5]。郭庆彬等[6]研究了芦苇叶黄酮的提取方法,戴军等[7]发现芦苇叶中含有8 种黄酮化合物;余晓红[8]和李瑞光[5]等分别从抗油脂氧化和对羟自由基(·OH)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(2,2’-azino bis-(3-ethylbenzthiazoline-6-sulphonate),ABTS+·)清除能力方面研究了芦苇叶的体外 抗氧化活性,并证实芦苇叶有较好的体外抗氧化能力,但有关芦苇叶的体内抗氧化活性鲜见报道。
本实验以芦 苇叶为原料,研究其乙醇提取所得黄酮类提取物在体外实验中对大鼠肝组织匀浆、肝线粒体丙二醛(malondialdehyde,MDA)生成量及大鼠红细胞溶血的影响,以及在体内实验中对S180荷瘤小鼠血清谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)活性及MDA含量的影响,对芦苇叶黄酮类提取物的体内体外抗氧化活性进行研究,以期为芦苇黄酮药物及功能性食品的开发提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
雌性清洁级ICR小鼠,扬州大学比较医学中心提供,许可证号:SCXK(苏)2007-0001;体质量18~22 g;饲料:颗粒饲料,由江苏省协同医药生物工程有限责任公司提供;饲养条件:空调房间,温度18~24 ℃,相对湿度70%。S180细胞,江苏省肿瘤药物研究所提供。
芦苇叶黄酮类提取物为自制。
阳性药物氟尿嘧啶注射液(5-fl uorouracil,5-FU),批号:1111262;规格:10 mL,0.25 g,购自江苏恒瑞医药有限公司。
牛血清白蛋白(生化试剂) 上海蓝季科技发展有限公司;MDA试剂盒、SOD试剂盒、GSH-Px试剂盒南京建成生物科技有限公司。
1.2 仪器与设备
HYG-A全温摇瓶柜 太仓市实验设备厂;PYXDHS-50X65-BS-II隔水式电热恒温培养箱 上海跃进医疗器械厂;Model 550多孔自动酶标仪 美国Bio-Rad公司。
1.3 方法
1.3.1 芦苇叶黄酮类提取物的制备
芦苇叶黄酮类提取物采用如下工艺制备得到:采用75%乙醇提取芦苇叶黄酮,控制料液比为1∶25(m/V),微波功率750 W条件下提取8 min,得到芦苇叶黄酮类物质粗提液;粗提液经AB-8大孔吸附树脂和聚酰胺树脂分离纯化后,采用75%乙醇液洗脱,洗脱液冷冻干燥后,备用;经高效液相色谱法分析确定芦苇叶黄酮类提取物中含有芦丁、野黄芩苷、橙皮苷、木犀草素、槲皮素、橙皮素、异甘草素和黄芩素等物质。
1.3.2 芦苇叶黄酮类提取物体外抗氧化实验
1.3.2.1 芦苇叶黄酮类提取物对大鼠肝组织匀浆体外生成MDA的影响
参照文献[9]的方法,并进行适当修改。取新鲜的大鼠肝组织,采用冷生理盐水洗净血渍、吸干水分后称质量,于匀浆器中与冷生理盐水以1∶9(V/V)制成匀浆液,10 000 r/min离心10 min,取上清液即为10%肝组织匀浆液,备用。
芦苇叶黄酮类提取物(样品)对大鼠肝匀浆MDA生成量的影响:取10%肝组织匀浆液0.4 m L与0.2 mL芦苇叶黄酮类提取物混匀,于37 ℃温育l h后,冰浴冷却,按MDA测定试剂盒说明书方法测定OD532nm,计算MDA含量/(nmol/mg pro)。以牛血清白蛋白为标准蛋白,考马斯亮蓝法测定肝组织匀浆蛋白质含量。对照组则以等体积的生理盐水代替样品溶液,其他操作相同。
样品对诱导体系大鼠肝组织匀浆MDA生成量的影响:分别加 0.2 mL 1 mmol/L FeSO4和H2O2于不同试管中,再分别加入0. 2 mL 10%肝组织匀浆液及相应样品溶液于各管中,混匀后于37 ℃温育l h,其余步骤同前所述。
1.3.2.2 芦苇叶黄酮类提取物对大鼠肝线粒体脂质过氧化的影响
参照文献[10-11]的方法,并进行适当修改。取新鲜的大鼠肝组织,采用冷生理盐水洗净血渍、吸干水分后,于匀浆器中以1∶9(V/V)与5 mmol/L pH 7.4的等渗磷酸盐缓冲液(phosphate buffered saline,PBS)混合制成10%匀浆液,经10 000 r/min冷冻离心10 min后,取上清液,再以10 000 r/min离心10 min,收集沉淀并用等渗PBS洗涤2 次,分散于等渗PBS中制备成蛋白质含量为0.5 mg/mL的线粒体悬浮液,备用。
大鼠肝线粒体脂质过氧化MDA生成量的测定:样品组:将线粒体悬浮液1.0 mL、样品液0.4 mL、0.5 mmol/L FeSO4溶液0.4 mL及0.5 mmol/L VC溶液0.4 mL混匀,于37 ℃温育l h,取出0.1 mL,按MDA试剂盒说明书方法测定OD532nm,计算MDA含量;对照组:以等体积PBS代替样品溶液,其他操作相同。
1.3.2.3 芦苇叶黄酮类提取物对大鼠红细胞(red blood cell,RBC)氧化溶血的影响
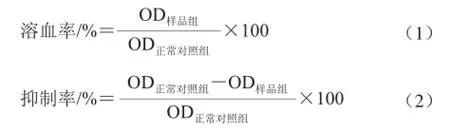
芦苇叶黄酮类提取物对大鼠RBC自氧化溶血的影响:将大鼠断头取血,加入Alsever抗凝剂后,1 000~2 000 r/min离心10 min制备红细胞,以冷生理盐水洗涤3 次,再以生理盐水制备成0.5%大鼠红细胞悬浮液,备用。参照文献[12]的方法稍作修改,取5 mL新配的大鼠红细胞悬浮液与0.2 mL一定质量浓度的样品溶液混合,37 ℃温育24 h后,1 000~2 000 r/min离心10 min,测定上清液OD540nm值。正常对照组以等体积生理盐水代替样品溶液,其余步骤相同。根据公式(1)、(2)以光密度值分别计算溶血率和抑制率。
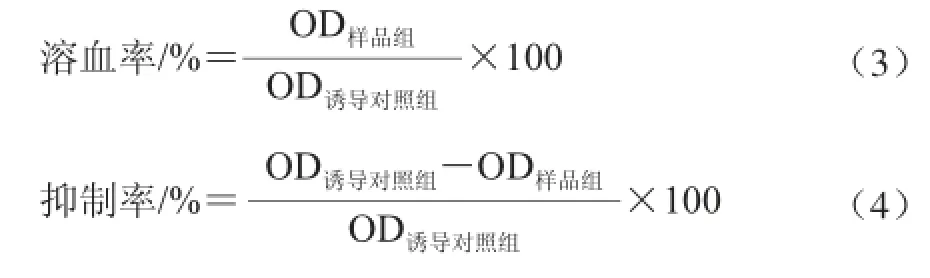
芦苇叶黄酮类提取物对H2O2诱导大鼠RBC氧化溶血的影响:参考文献[13]的方法稍作修改。大鼠红细胞悬浮液的制备同上。样品组:取1 mL红细胞悬浮液,加入0.2 mL样品溶液混匀后,再加入100 mmol/L H2O2溶液0.1 mL混匀,37 ℃温育1 h后,以生理盐水稀释6 倍,10 000 r/min离心10 min,取上清液测定OD415nm值,以生理盐水调零。正常对照组:以等体积生理盐水代替样品溶液和H2O2溶液,其余步骤相同。诱导对照组:以等体积生理盐水代替样品,其余步骤相同。按照公式(3)、(4)分别计算溶血率和抑制率。
1.3.3 芦苇叶黄酮类提取物体内抗氧化实验
1.3.3.1 S180肿瘤小鼠模型建立
按照移植性肿瘤研究法[14]为ICR小鼠接种实体型瘤,接种后24 h称体质量,随机分为6 组,给药组每组8 只。
1.3.3.2 动物分组及处理
取ICR小鼠和S180肿瘤小鼠,分为正常对照组、模型对照组、阳性对照组、样品组(芦苇叶黄酮类提取物),每组8 只。正常对照组、模型对照组:均采用灌胃给药生理盐水,0.4 mL/(20 g·d);阳性对照组:静脉注射给药5-FU,隔天给药1 次,共给药5 次,给药体积均为20 mL/kg;样品组:分别灌胃给药100、200、300 mg/(kg·d),第1次给药于接种S180肿瘤24 h后,每天给药1 次,共给药10 次;于接种后第11天眼眶取血,备用。
1.3.3.3 体内抗氧化活性检测
小鼠血液于2 000 r/min离心15 min得血清,按试剂盒说明书方法测定血清中SOD、GSH-Px活力和MDA含量。
1.4 数据统计与分析
实验设3 次重复,结果取平均值。数据用SPSS 12.0软件分析。
2 结果与分析
2.1 芦苇叶黄酮类提取物的体外抗氧化效果
2.1.1 芦苇叶黄酮类提取物对大鼠肝组织匀浆体外生成MDA的影响
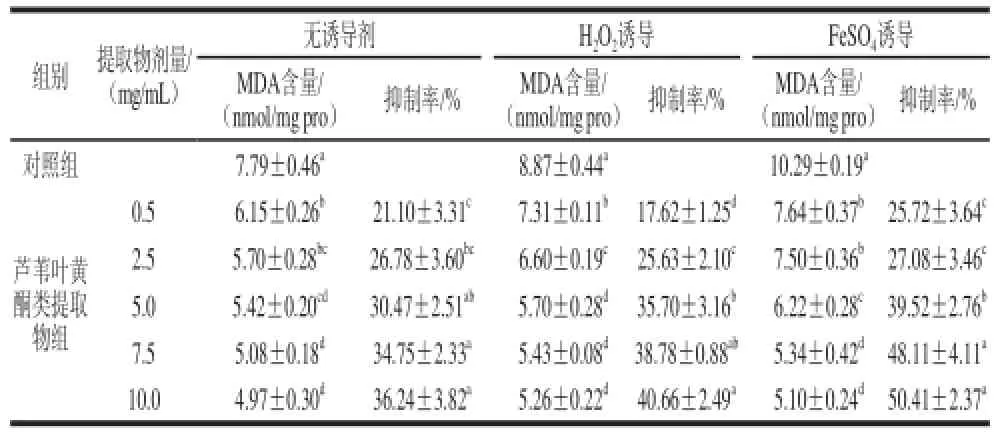
表1 芦苇叶黄酮类提取物对大鼠肝组织匀浆MDA生成的影响Table 1 Effect of PCF extract on MDA generation in rat liver homogenate
如表1所示,在这3 种体系中,与对照组相比,芦苇叶黄酮类提取物剂量在0.5~10.0 mg/mL范围内,对大鼠组织肝匀浆中MDA的生成量均具有显著的抑制作用,且呈现剂量-效应关系;当芦苇叶黄酮类提取物剂量达到5.0 mg/mL时,无诱导剂体系中抑制率达到30.47%,H2O2诱导体系中达35.70%,FeSO4诱导体系中达39.52%,抑制率均显著高于相同体系的0.5 mg/mL剂量组。总体对比而言,芦苇叶黄酮类提取物对诱导氧化体系中大鼠肝组织匀浆的MDA生成量抑制率高于无诱导剂体系。
2.1.2 芦苇叶黄酮类提取物对大鼠肝线粒体脂质过氧化的影响
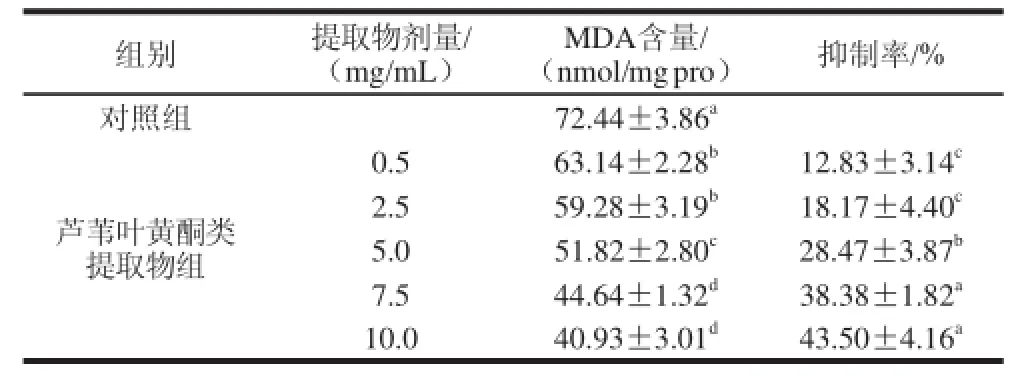
表2 芦苇叶黄酮类提取物对大鼠肝线粒体MDA生成量的影响Table 2 Effect of PCF extract on MDA generation in rat liver mitoehondria
芦苇叶黄酮类提取物对大鼠肝线粒体MDA生成量的影响见表2。结果表明,与对照组相比,芦苇叶黄酮类提取物作用后,可使大鼠肝线粒体MDA的生成量显著下降,有效抑制了MDA的生成,并呈剂量-效应关系;当芦苇叶黄酮类提取物剂量达到5.0 mg/mL时,抑制率达到28.47 %,较0.5 mg/mL剂量组的抑制率显著提高。
2.1.3 芦苇叶黄酮类提取物对大鼠红细胞氧化溶血的影响
2.1.3.1 芦苇叶黄酮类提取物对大鼠红细胞自氧化溶血的影响
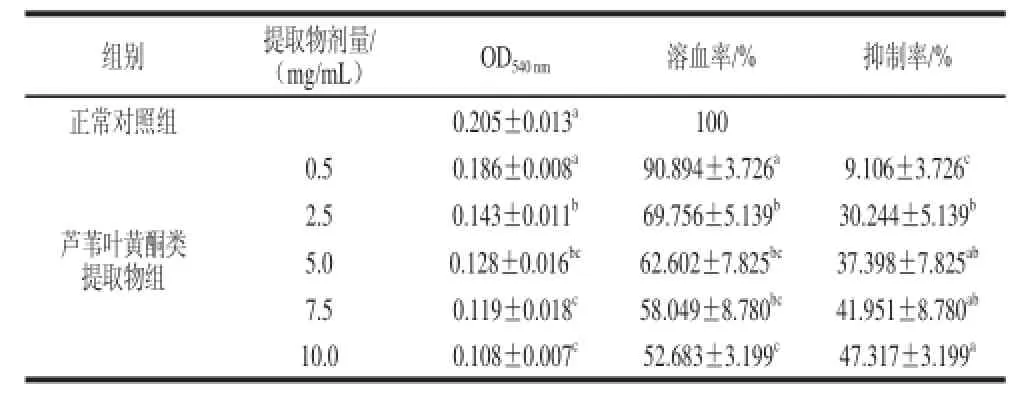
表3 芦苇叶黄酮类提取物对大鼠红细胞自氧化溶血的影响Table 3 Effect of PCF extract on the hemolysis of rat RBCsTable 3
在大鼠红细胞体外温育过程中,添加不同剂量的芦苇叶黄酮类提取物,考察其对红细胞溶血的影响。由表3可 知,当剂量高于2.5 mg/mL时,芦苇叶黄酮类提取物各剂量组的光密度值与正常对照组间差异显著,表明其对红细胞体外自氧化溶血反应均具有抑制作用,且呈现剂量依赖关系,但随着剂量的进一步增加,抑制率提高并不显著;当剂量达到10.0 mg/mL时,芦苇叶黄酮类提取物对大鼠红细胞的溶血抑制率达到47.317%。
2.1.3.2 芦苇叶黄酮类提取物对H2O2诱导大鼠红细胞氧化溶血的影响
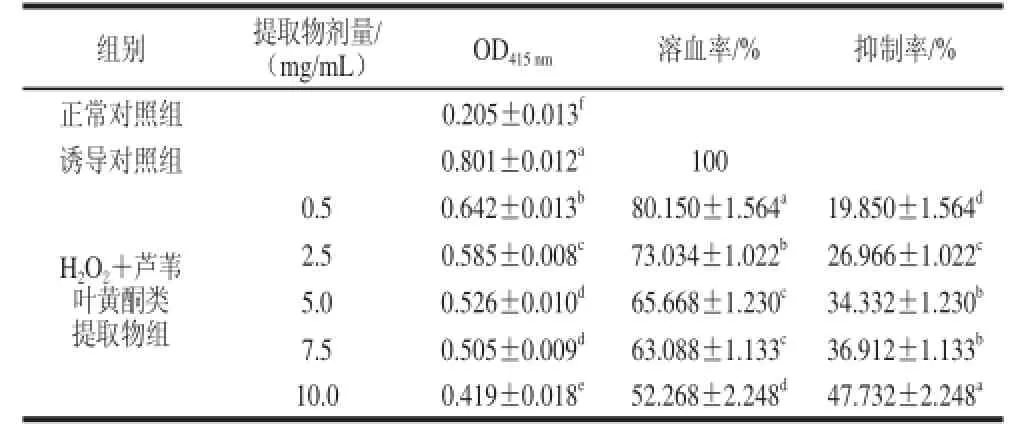
表4 芦苇叶黄酮类提取物对H2O2诱导大鼠红细胞氧化溶血的影响Table 4 Effect of PCF extract on the hemolysis induced byH2O2of rat RBCs
芦苇叶黄酮类提取物对H2O2诱导大鼠红细胞氧化溶血的影响如表4所示。芦苇叶黄酮类提取物各剂量组光密度值与正常对照组和诱导对照组间均具有显著差异,且均随着芦苇叶黄酮类提取物剂量的增加,氧化溶血现象逐步得到抑制,表现为溶血率逐渐下降,抑制率逐步上升。当芦苇叶黄酮类提取物剂量达到0.5 mg/mL时,与诱导对照组相比即表现出显著性差异,表现为一定的剂量-效应关系;芦苇叶黄酮类提取物剂量为10 mg/mL时,溶血抑制率达到47.732%,显著高于其他各剂量组。
2.2 芦苇叶黄酮类提取物对S180荷瘤小鼠体内抗氧化活性的影响

表5 芦苇叶黄酮类提取物对S180小鼠血清SOD、GSH-Px活力和MDA含量的影响Table 5 Effect of PCF extract on SOD and GSH-Px activities and MDA content in serum of S180-bearing mice
由表5可知,S180荷瘤小鼠血清的MDA生成量均随着芦苇叶黄酮类提取物剂量的增加而逐渐下降。芦苇叶黄酮类提取物组的MDA生成量与正常对照组、模型对照组相比均具有显著差异;芦苇叶黄酮类提取物剂量达到300 mg/(kg·d)时,S180荷瘤小鼠血清中的MDA生成量显著低于5-FU阳性对照组,为3.65 nmol/mL。
随着芦苇叶黄酮类提取物剂量的增加,各剂量组小鼠血清的SOD活力随之上升,在芦苇叶黄酮类提取物剂量达到300 mg/(kg·d)时,与模型对照组的SOD活力具有显著差异,芦苇叶黄酮类提取物剂量达到200 mg/(kg·d)时,SOD活力与5-FU阳性对照组即无显著差异。
对小鼠血清中GSH-Px活性的研究表明,芦苇叶黄酮类提取物各剂量组之间的GSH-Px活力差异显著,并呈剂量-效应关系,但与正常对照组相比仍具有显著差异;芦苇叶黄酮类提取物各剂量组的GSH-Px活力与模型对照组相比都具有显著差异,表明芦苇叶黄酮类提取物可以提高S180荷瘤小鼠体内的GSH-Px活性;芦苇叶黄酮类提取物在剂量达到300 mg/(kg·d)时,S180荷瘤小鼠的GSH-Px活力达到511.42 U/mL,而5-FU阳性对照组为517.61 U/mL,两组间的差异不显著,表明芦苇叶黄酮类提取物具有较好的体内抗氧化效果。
3 讨 论
在一定剂量范围内,芦苇叶黄酮类提取物能抑制大鼠肝组织匀浆及肝线粒体MDA的生成,可以抑制大鼠红细胞氧化溶血,并具有量效关系,表现出一定的体外抗氧化活性。随着剂量的增加,芦苇叶黄酮类提取物可降低S180荷瘤小鼠血清中MDA的含量,提高SOD和 GSH-Px活性,从而提高荷瘤小鼠体内抗氧化活性;而在促进荷瘤小鼠体内抗氧化能力方面,300 mg/(kg·d)的芦苇叶黄酮类提取物与10 mL/(kg·d)的5-FU没有显著差异。
李瑞光等[5]对芦苇叶总黄酮清除超氧阴离子自由基(O2-·)、·OH、DPPH自由基及ABTS+·的作用研究表明芦苇叶总黄酮具有很高的自由基清除活性,具有一定的体外抗氧化活性,但纯化物较其粗提物清除O2-·、·OH、DPPH自由基及ABTS+·的能力有所下降。余晓红等[8]用碘量法研究了芦苇提取物对花生油的抗氧化作用,结果表明,芦苇提取物具有较明显的抗氧化作用,且抗氧化性随着芦苇提取物添加剂量的增大而提高。本实验对芦苇叶黄酮类提取物抑制大鼠肝组织匀浆、肝线粒体MDA的生成及抑制大鼠红细胞氧化溶血作用进行了研究,结果表明其具有很好的体外抗氧化活性;对S180荷瘤小鼠血清MDA含量、SOD和GSH-Px活性影响的研究表明,芦苇叶黄酮类提取物同样具有一定的体内抗氧化活性。大量研究表明,红细胞(RBC)膜容易受到自由基的攻击而引发脂质过氧化反应,导致红细胞膜的脆性提高, 甚至会改变细胞的完整性而导致溶血[15]。RBC在体外温育条件下会发生自氧化反应,易产生MDA,MDA是脂质过氧化反应的终产物,不仅常用来评判脂质过氧化反应的强弱,还能间接反映细胞损伤的程度[15]。本实验的结果表明芦苇叶总黄酮类提取物对肝组织匀浆、肝线粒体及红细胞膜的氧化损伤有保护作用,揭示芦苇叶黄酮类提取物可用于防止生物膜的氧化损伤,且其对MDA的含量的降低、SOD和GSH-Px活性的提高作用可能是保护生物膜的机制之一。本研究为丰富芦苇叶黄酮类提取物的生理活性提供了理论依据,可为开发芦苇黄酮药物和功能性食品奠定基础。
参考文献:
[1] 郭庆彬, 刘邻渭, 刘盼红, 等. 芦苇叶中黄酮类化合物提取工艺的研究[J]. 食品研究与开发, 2008, 28(12): 59-62.
[2] 鲁娟, 刘增洪, 司永兵, 等. 芦苇的特性, 开发利用及其防除方法[J].杂草科学, 2007(3): 7-8.
[3] 吴冬青, 任雪峰, 徐新建, 等. 芦苇不同部位醇提物抗氧化性对比分析[J]. 食品工业科技, 2012, 33(10): 174-176.
[4] 李时珍. 本草纲目(校点本上册)[M]. 北京: 人民卫生出版社, 1982: 1001-1003.
[5] 李瑞光, 刘邻渭, 郑海燕, 等. 芦苇黄酮提取液体外抗氧化特性研究[J].西北农业学报, 2009, 18(4): 310-314.
[6] 郭庆彬. 芦苇叶中黄酮的提取、纯化及抗氧化性研究[D]. 杨凌: 西北农林科技大学, 2008.
[7] 戴军, 王洪新. HPLC分析芦苇叶中天然抗氧化成分黄酮类化合物[J].无锡轻工业学院学报, 1994, 13(1): 34-37.
[8] 余晓红, 许伟, 邵荣, 等. 富含黄酮的芦苇提取物的抑菌性和抗氧化性研究[J]. 食品科学, 2009, 30(23): 185-188.
[9] 黄晓兰, 闫俊, 吴晓旻, 等. 枸杞多糖对H2O2诱导的小鼠生殖细胞损伤的影响[J]. 食品科学, 2004, 25(12): 116-118.
[10] SRIGIRIDHAR K, NAIR K M, SUBRAMANIAN R, et al. Oral repletion of iron induces free radical mediated alterations in the gastrointestinal tract of rat[J]. Molecular and Cellular Biochemistry, 2001, 219(1/2): 91-98.
[11] 游育红, 林志彬. 灵芝多糖肽的抗氧化作用[J]. 药学学报, 2003, 38(2): 85-88.
[12] 李志孝, 黄成钢, 蔡育军, 等. 天门冬多糖的化学结构及体外抗氧化活性[J]. 药学学报, 2000, 35(5): 358-362.
[13] STEVENS J F, MIRANDA C L, WOLTHERS K R, et al. Identifi cation and in vitro biological activities of hop proanthocyanidins: inhibition of nNOS activity and scavenging of reactive nitrogen species[J]. Journal of Agricultural and Food Chemistry, 2002, 50(12): 3435-3443.
[14] 刘昕, 王振军, 王晶宇. 铁筷子多糖对荷瘤机体细胞因子产生的影响及其抑瘤作用的电镜观察[J]. 中药药理与临床, 2004, 19(6): 13-15.
[15] CHENG Ni, REN Naiyan, GAO Hui, et al. Antioxidant and hepatoprotective effects of Schisandra chinensis pollen extract on CCl4-induced acute liver damage in mice[J]. Food and Chemical Toxicology, 2013, 55: 234-240.
Antioxidant Properties of Flavonoids Extracted from Leaves of Phragmites communis Trin. in vivo and in vitro
YU Xiaohong, ZHU Xuemei*, LI Fengwei, XUE Feng, PENG Yingyun
(School of Chemical and Biological Engineering, Yancheng Institute of Technology, Yancheng 224003, China)
The in vivo and in vitro antioxidant properties of flavonoids extracted with ethanol from the dry leaves of Phragmites communis Trin. (PCF) were studied by measuring the effects on hemolysis of rat red blood cells (RBCs) and MDA generation in liver homogenate and mitochondria in vitro. Results indicated that PCF in the concentration range of 0.5–10 mg/mL could inhibit the hemolysis of rat RBCs and the generation of MDA in rat liver homogenate and mitochondria in a dose-dependent manner, suggesting obvious antioxidant activity in vitro. Increased concentrations of PCF could enhance the activities of GSH-Px and SOD and reduce MDA levels in the serum of S180 tumor-bearing mice so as to have elevated antioxidant activity. PCF at the dose of 300 mg/(kg·d) had antioxidant activity comparable to that of 5-FU at 10 mL/(kg·d) for tumor-bearing mice in vivo.
Phragmites communis Trin. leaves; fl avonoids; antioxidant activity; i n vivo and in vitro
Q819
A
1002-6630(2015)01-0209-05
10.7506/spkx1002-6630-201501040
2014-07-06
江苏省科技厅省产学研前瞻性联合研究项目(BY2013057-03);江苏省教育厅江苏省高校科研成果产业化推进项目(JHB2012-52);江苏省社会发展科技支撑基金资助项目(BE2011728)
余晓红(1976—),女,副教授,博士,研究方向为食品微生物、天然产物分离及应用。E-mail:yxh1127@163.com
*通信作者:朱雪梅(1965—),女,副教授,硕士,研究方向为应用化学、天然产物分离及应用。E-mail:zxm-yc@163.com
