凡纳滨对虾过敏原精氨酸激酶的质谱鉴定及其免疫交叉反应研究
2015-12-07孙一帆黄建芳向军俭王彩霞陈成枫
孙一帆,黄建芳,向军俭,王彩霞,陈成枫
(暨南大学 广东省分子免疫与抗体工程重点实验室,广东 广州 510632)
凡纳滨对虾过敏原精氨酸激酶的质谱鉴定及其免疫交叉反应研究
孙一帆,黄建芳,向军俭*,王彩霞,陈成枫
(暨南大学 广东省分子免疫与抗体工程重点实验室,广东 广州 510632)
目的:鉴定凡纳滨对虾分子质量40 kD过敏原,并分析其在有壳水产食物中的免疫交叉反应。方法:运用基质辅助激光解析串联飞行时间质谱仪(matrix assisted laser desorption ionization/time of fl ight mass spectrometry,MALDI-TOF/TOF-MS)鉴定凡纳滨对虾40 kD过敏原组分;使用软件BLAST、Clustal X2、MEGA 5.0分析该蛋白氨基酸序列的种间同源性;制备抗凡纳滨对虾过敏原精氨酸激酶的多克隆抗体,并与17 种常见有壳水生动物粗提液进行Western blotting,以分析该过敏原的免疫交叉反应。结果:凡纳滨对虾40 kD过敏原为精氨酸激酶(arginine kinase,AK);其氨基酸序列同源性分析显示AK在虾类(96%~100%)、蟹类(91%~93%)、贝类(49%~52%)、蟑螂(83%)中具有很高的同源性;Western blotting结果显示抗AK多抗与17 种不同虾类、蟹类、贝类的AK均能发生反应。结论:精氨酸激酶在甲壳类动物、软体动物、甚至昆虫中具有高度保守性,且能引起强免疫交叉反应,是有壳水生动物中的一种泛过敏原。
凡纳滨对虾;过敏原;精氨酸激酶;质谱;序列同源性;免疫交叉反应
过敏症是一个长期威胁人们生命与健康的重要问题。2001年,在联合国粮食及农业组织/世界卫生组织公布的八大类主要过敏食物中,虾蟹等甲壳类食物是其中重要一类[1]。在一些沿海国家例如中国,因食用有壳水产食物而导致过敏的消费者在逐年增多[2]。
有壳水生动物主要包括以虾、蟹为代表的甲壳类动物和以贝类为主的软体动物,其中虾是最广泛报道的水产过敏食物。近年来,国内外的许多学者对甲壳类过敏原进行了大量研究,尤其是针对虾中的主要过敏原——36 kD原肌球蛋白(tropomysin,TM)的研究最为透彻,现已证明原肌球蛋白是虾中致敏性最强的过敏原[3]。此外,被国际免疫学会联合会认定的甲壳类食物过敏原还有21 kD的肌 质钙结合蛋白(sarcoplasmic calciumbinding protein,SCP)[4]、40 kD的精氨酸激酶(argininekinase,AK)[5],以及肌球蛋白轻链(myosin light chain,MLC)[6]。2011年,血蓝蛋白(hemocyanin,Hc)被鉴定为甲壳类食物中的一种新型过敏原[7]。已知虾的36 kD原肌球蛋白在有壳水生动物及蟑螂、尘螨等昆虫间都存在强交叉反应,所以当虾过敏患者食用虾以外有壳水产食物后,常会因原肌球蛋白的交叉反应性而引发过敏症状[8-9]。同原肌球蛋白相似,已发现AK在虾以外的物种如锯缘青蟹和章鱼中也存在交叉反应[5,10],这就意味着精氨酸激酶可能是另一种种间高度保守的交叉过敏原。
在前期的研究工作中,通过对虾蟹过敏患者血清样本分析,鉴定出凡纳滨对虾(Litopenaeus vannamei)中的40 kD蛋白组分是一种重要的过敏原[11],并对其进行分离纯化。本研究对该过敏原进行质谱鉴定,并通过使用生物信息学同源性分析和制备特异性鼠多克隆抗体,研究该过敏原在17 种常见有壳水产食物中的交叉反应,以期探明该过敏原的分布和种属间亲缘关系,为预防和控制虾蟹等有壳水产食物引发过敏症提供参考信息,为过敏原交叉反应的研究和广谱脱敏疫苗的研制奠定基础。
1 材料与方法
1.1 动物、材料与试剂
昆明小鼠购自南方医院动物中心。
17 种鲜活的虾、蟹、贝类:凡纳滨对虾(Litopenaeus vannamei)、刀额新对虾(Metapenaeus ensis)、斑节对虾(Penaeus monodon)、中国明对虾(Fenneropenaeus chinensis)、日本对虾(Penaeus japonicus)、罗氏沼虾(Macrobrachium rosenbergii)、口虾菇(Oratosquilla oratoria)、克氏原螯虾(Procambarus clarkii)、三疣梭子蟹(Portunus trituberculatus)、锯缘青蟹(Scylla serrata)、锈斑鲟(Charybdis feriata)、中华绒螯蟹(Eriocheir sinensis)、文蛤(Meretrix meretrix)、花蛤(Ruditapes philippinarum)、方斑东风螺(Babyloniaareolata)、杂色鲍(Abalone)、竹蛏(Solen strictus)均购自广州黄沙水产市场;精氨酸激酶由凡纳滨对虾粗提液中提取纯化所得。
胰酶 美国Promega公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗小鼠IgG二抗 美国KPL公司;蛋白质Marker 加拿大Fermentas公司;PVDF膜 美国Millipore公司;ECL试剂盒 美国Pierce公司。
1.2 仪器与设备
Ultraflex MALDI-TOF/TOF质谱仪 美国Bruker Daltonics公司;Multiskan MK3酶标仪 美国Thermo Fisher公司;MiniProtein II垂直电泳仪、电转仪 美国Bio-Rad公司。
1.3 方法
1.3.1 质谱鉴定与分析
将纯化的凡纳滨虾40 kD过敏原进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gelelectrophoresis,SDS-PAGE),将目的蛋白条带切碎进行胶内蛋白酶切,酶切后的混合肽用Ultraflex基质辅助激光解析串联飞行时间质谱仪(matrix assisted laser desorption ionization/time of flight mass spectrometry,MALDI-TOF/TOF-MS)鉴定分析,质谱测定条件设定为:N2激光源,波长337 nm,加速电压25 kV,采用正离子和自动获取数据的模式,肽质量指纹图谱(peptide mass fingerprinting,PMF)质量扫描范围为800~4 500,取强度最大的峰进行串级质谱分析,图谱用Bruker专用的Peptide Calibration Standard进行外标校正。使用Mascot(http://www.matrixscience.com)中的串级质谱数据搜索功能(MS/MS Ions Search)与数据库中相应肽段的质量数及其串级质谱图谱在NCBInr数据库中进行相关性比较检索鉴定,搜索参数:切割酶Trypsin,允许最大未酶切位点(missed cleavage)数为1,固定修饰carbamidomethyl,可变修饰oxidation,质谱的误差10-4,二级质谱误差0.6 D。
1.3.2 序列同源性分析
以质谱鉴定结果所得凡纳滨对虾40 kD过敏原的氨基酸序列为查询序列,对GenBank中的非冗余蛋白质数据库进行BLASTp分析,使用Clustal X2和MEGA 5.0程序进行多序列比对并构建系统进化树。
1.3.3 过敏原特异性鼠多克隆抗体的制备与鉴定
纯化的凡纳滨对虾40 kD过敏原1.5 mg/mL,与等体积弗氏完全佐剂充分混匀形成油包水乳化物,腹股沟、背部皮下多点及腹腔免疫昆明小鼠(0.2 mL/只);此后每两周用弗氏不完全佐剂以同样剂量和方式加强免疫小鼠,重复3 次;末次免疫的10 d后,小鼠摘眼球采血,血液于37 ℃放置1 h,4 ℃放置4 h以上,然后4 ℃、1 500 r/min离心10 min,分离得到血清用来间接酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)测抗体效价。
1.3.4 不同有壳水产动物蛋白粗提液的制备
参照《变态反应学实验技术》[12]中的方法,分别制备17 种有壳水产动物蛋白粗提液:取新鲜的虾、蟹、贝,虾去头去壳,蟹、贝去壳取肉,组织捣碎机分别捣碎;50%预冷丙酮脱脂3 次,后于2 倍体积的0.1 mol/L磷酸盐缓冲液(pH 7.4)中搅拌2 h;4 ℃静置过夜;4 ℃、12 000 r/min离心20 min,取上清液测定蛋白质浓度,SDS-PAGE鉴定蛋白组分,-20 ℃分装保存。
1.3.5 Western blotting分析AK的种间免疫交叉反应
蛋白粗提液经SDS-PAGE分离组分,再转移至PVDF膜上;5%脱脂奶粉37 ℃封闭2 h,PBST洗涤3 次;20 000 倍稀释的AK鼠多抗37 ℃孵育2 h,PBST洗涤3 次;1∶10 000稀释的HRP标记羊抗鼠lgG二抗孵育37 ℃ 1 h,洗涤5 次;膜上滴加ECL化学发光试剂,X胶片曝光,经显影定影后扫描保存结果。
2 结果与分析
2.1 质谱鉴定分析结果

图1 凡纳滨对虾40 kD过敏原蛋白的肽质量指纹图谱Fig.1 PMF of 40 kD-allergen from Litopenaeus vannamei
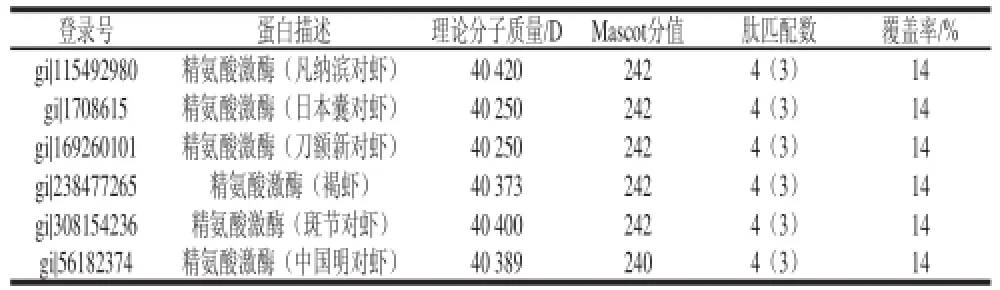
表1 Mascot检索结果Table 1 Summary report of Mascot search results
2.2 序列同源性分析
由质谱鉴定结果得到凡纳滨对虾精氨酸激酶的氨基酸序列(ABY57915.1),通过BLAST和Clustal X2软件在数种具有代表性的有壳水生动物AK序列信息中进行多序列比对,所选物种均为常接触物种(虾、蟹、贝、蟑螂等)。通过MEGA 5.0中Neighbor-Joining(N-J)方法构建系统进化关系(图2)。结果显示,凡纳滨对虾的AK与其他甲壳类动物的AK氨基酸序列同源性很高,尤其在对虾科内最高,其AK的氨基酸序列基本相同,一致性达96%~100%;由进化树还可看出,同属甲壳纲的蟹类(包括小龙虾)与对虾科亲缘关系极近,处同一分支,蟹类AK与凡纳滨对虾AK一致性为91%~93%;贝类与虾类、蟹类虽处于不同进化树分支,但一致性仍有49%~52%;此外,昆虫纲蟑螂的AK与凡纳滨对虾AK亲缘关系居于虾蟹与贝类之间,一致性高达83%,这预示着昆虫的AK可能和甲壳类动物AK间存在强交叉反应;然而有趣的是,虽同为虾类,沼虾科的罗氏沼虾AK与对虾科的凡纳滨对虾AK氨基酸序列一致性只有45%,亲缘关系略远,原因可能是两者进化来源差异较大。以上数据均表明,精氨酸激酶在虾类、蟹类、贝类、甚至蟑螂中都具有较高的同源性。
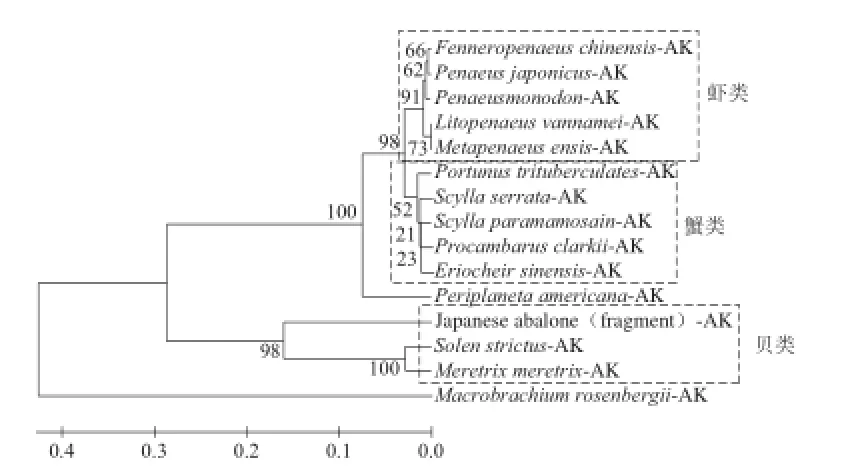
图2 有壳水生动物精氨酸激酶系统进化树Fig.2 Phylogenetic tree of AKs from shellfi shes
2.3 鼠多克隆抗体的制备与鉴定
用纯化的凡纳滨对虾40 kD过敏原精氨酸激酶免疫昆明小鼠制备特异性鼠多克隆抗体,凡纳滨对虾AK包被质量浓度为100 ng/孔,间接ELISA检测抗体效价。如图3所示,两只小鼠产生的抗体的效价分别约为130 000和100 000,混合两份多抗血清进行交叉反应研究。

图3 抗AK鼠多克隆抗体效价Fig.3 Titer of AK-specifi c polyclonal antibodies
2.4 AK在有壳水生动物中的免疫学交叉反应分析
共制备了17 种有壳水生动物的蛋白粗提液,进行SDS-PAGE,结果如图4A所示,17 种水产食物在40 kD附近均有蛋白条带。虾类、蟹类、贝类的蛋白组成虽有明显差异,但虾、蟹在40 kD处均有较粗条带出现;贝类中对应于AK位置的条带在40 kD略上方,可能是其AK分子质量大小与虾、蟹略有不同。由电泳结果还可看出,AK在这17 种有壳水生动物的蛋白粗提液中均有较高的蛋白含量,是水产食物中的一种重要蛋白组成成分。
将抗AK多克隆抗体与这17 种有壳水生动物蛋白粗提液进行Western blotting,结果显示(图4B),多抗与17 种虾、蟹、贝在40 kD左右处均有反应条带,且其反应程度结果吻合于信息学同源性比对结果。其中,与凡纳滨对虾同属对虾科的5 种(1~5)对虾粗提液反应最强,其AK同源性96%~100%;多抗与小龙虾(7)和4 种蟹类(8~11)的反应也较强,同源性比对结果显示该5 种水产食物与凡纳滨对虾的AK同源性达91%~93%;而多抗与罗氏沼虾(6)、口虾蛄(17)及5 种贝类(12~16)的反应则相对较弱,但仍有可见条带,该7 种水产食物与凡纳滨对虾的AK同源性仅有50%左右。综合上述结果可知,在有壳水生动物尤其是在甲壳类动物中,精氨酸激酶之间存在较强的免疫交叉反应,反应强弱存在差异且与其氨基酸序列同源性相关。故精氨酸激酶是有壳水产动物尤其是甲壳类动物中的一种泛过敏原。

图4 17种有壳水生动物蛋白粗提液的SDS-PAGE及其与AK多抗的Western blotting结果Fig.4 SDS-PAGE of extracts from 17 shellfi sh species and Western blotting of these extracts probed with AK-specifi c polyclonal antibody
3 讨 论
本研究通过质谱鉴定分析证明凡纳滨对虾分子质量为40 kD的过敏原是精氨酸激酶(AK),经氨基酸序列比对分析,表明其在虾、蟹、贝等有壳水生动物及蟑螂中高度保守,免疫印迹实验结果进一步验证了AK在虾、蟹、贝等17 种有壳水生动物中存在强免疫交叉反应,即AK的种间同源性较高,是一种有壳水产食物的交叉过敏原。
精氨酸激酶是甲壳类动物的重要过敏原,亦是调节无脊椎动物能量代谢的一种重要酶,其功能类似于脊椎动物的肌酸激酶[13]。2003年,Yu Chiajung等[5]首次在斑节对虾中鉴定出精氨酸激酶(Pen m 2)是一种新的甲壳类动物过敏原,且与克氏原螯虾(Procambarus clarkii)、锯缘青蟹(Scylla serrata)存在交叉反应;2011年,有学者发现甲壳类动物中的精氨酸激酶具有高达70%左右的致敏率,是仅次于原肌球蛋白的重要过敏原[7],随后Ayuso等[14]还利用重叠肽合成技术获取了精氨酸激酶上的8 个免疫球蛋白E线性表位肽段。近几年,国内的一些学者在精氨酸激酶的重组表达、过敏原性鉴定及其免疫球蛋白E结合表位的结构分析等方面的研究中也做出了重要贡献[15-17]。然而,在该过敏原的交叉反应问题上,研究数据却比较匮乏。
本研究从凡纳滨对虾中分离纯化出能与虾蟹过敏患者血清反应的40 kD蛋白组分,通过蛋白组学质谱鉴定方法,证明该过敏原为精氨酸激酶,这与国外报道相符[5]。为进一步探究精氨酸激酶在有壳水产食物中的分布状况及是否存在交叉反应,本实验选取了虾类、蟹类、贝类共计17 种日常饮食中的水产食物,并制备其粗提液,运用Western blotting和生物信息学同源性分析方法,证实了精氨酸激酶在甲壳类动物和软体动物中具有较高同源性,是有壳水生动物的一种泛过敏原,为过敏症的预防控制,探寻甲壳类食物过敏原检测靶位点,以及广谱脱敏疫苗的研发提供了重要信息。
[1] Food and Agriculture Organization of the United Nations/World Health Organization. Evaluation of allergenicity of genetically modifi ed foods[R]. Report of a joint FAO/WHO expert consultation of allergenicity of foods derived from biotechnology. Italy: Food and Agriculture Organization of the United Nations, 2001.
[2] 刘光明, 曹敏杰, 蔡秋凤, 等. 水产品过敏原的研究现状和展望[J].中国食品学报, 2012, 12(5): 1-9.
[3] SHANTI K N, MARTIN B M, NAGPAL S, et al. Identification of tropomyosin as the major shrimp allergen and characterization of its IgE-binding epitopes[J]. The Journal of Immunology, 1993, 151(10): 5354-5363.
[4] AYUSO R, GRISHINA G, IBÁÑEZ M D, et al. Sarcoplasmic calcium-binding protein is an EF-hand-type protein identifi ed as a new shrimp allergen[J]. Journal of Allergy and Clinical Immunology, 2009, 12 4(1): 114-120.
[5] YU Chiajung, LIN Yufen, CHIANG Borluen, et al. Proteomics and immunological analysis of a novel shrimp allergen, Pen m 2[J]. The Journal of Immunology, 2003, 170(1): 445-453.
[6] AYUSO R, GRISHINA G, BARDINA L, et al. Myosin light chain is a novel shrimp allergen, Lit v 3[J]. Journal of Allergy and Clinical Immunology, 2008, 122(4): 795-802.
[7] PIBOONPOCANUN S, JIRAPONGSANANURUK O, TIPAYANON T, et al. Identification of hemocyanin as a novel non-cross-reactive allergen from the giant freshwater shrimp Macrobrachium rosenbergii[J]. Molecular Nutrition & Food Research, 2011, 55(10): 1492-1498.
[8] LEUNG P S C, CHOW W K, DUFFEY S, et al. IgE reactivity against a cross-reactive allergen in crustacea and mollusca: evidence for tropomyosin as the common allergen[J]. Journal of Allergy and Clinical Immunology, 1996, 98(5): 954-961.
[9] MUSMAND J J, DAUL C B, LEHRER S B. Crustacea allergy[J]. Clinical & Experimental Allergy, 1993, 23(9): 722-732.
[10] SHEN Haiwang, CAO Minjie, CAI Qiufeng, et al. Purification, cloning, and immunological characterization of arginine kinase, a novel allergen of Octopus fangsiao[J]. Journal of Agricultural and Food Chemistry, 2012, 60(9): 2190-2199.
[11] 黄建芳, 林婷婷, 向军俭, 等. 河虾主要过敏组分的分离, 纯化, 鉴定及其致敏性分析[J]. 细胞与分子免疫学杂志, 2010(5): 444-446.
[12] 乔秉善. 变态反应学实验技术[M]. 2版. 北京: 中国协和医科大学出版社, 2002: 6-36.
[13] SHEN Yuan, CAO Minjie, CAI Qiufeng, et al. Purifi cation, cloning, expression and immunological analysis of Scylla serrata arginine kinase, the crab allergen[J]. Journal of the Science of Food and Agriculture, 2011, 91(7): 1326-1335.
[14] AYUSO R, SÁNCHEZ-GARCIA S, PASCAL M, et al. Is epitope recognition of shrimp allergens useful to predict clinical reactivity?[J]. Clinical & Experimental Allergy, 2012, 42(2): 293-304.
[15] 阮韦伟, 沈苑, 曹敏杰, 等. 锯缘青蟹精氨酸激酶基因的克隆与表达[J].集美大学学报: 自然科学版, 2011, 16(5): 346-351.
[16] 沈海旺, 陈亨莉, 曹敏杰, 等. 甲壳类动物4种过敏原的序列分析, 抗原表位预测及三维结构建模[J]. 免疫学杂志, 2012, 28(7): 613-619.
[17] MAO Haiyan, CAO Minjie, MALEKI S J, et al. Structural characterization and IgE epitope analysis of arginine kinase from Scylla paramamosain[J]. Molecular Immunology, 2013, 56(4): 463-470.
Proteomics and Immunological Analysis of Arginine Kinase, an Important Shrimp Allergen from Litopenaeus vannamei
SUN Yifan, HUANG Jianfang, XIANG Junjian*, WANG Caixia, CHEN Chengfeng
(Guangdong Province Key Laboratory of Molecular Immunology and Antibody Engineering, Jinan University, Guangzhou 510632, China)
This study aimed to identify the 40-kD allergen of Litopenaeus vannamei and to analyze its immune crossreactivity among shellfi sh species. Several proteomics and immunological experiments were performed. By using matrixassisted laser desorption/ionization time-of-flight mass spectrometry (MALDI-TOF/TOF-MS), the 40 kD allergen from Litopenaeus vannamei was identifi ed as arginine kinase (AK). Its amino acid sequence was compared with that of known proteins by BLAST, Clustal X2 and MEGA 5. The results revealed that AK had high homology among shrimp (96%-100%), crab (91%-93%), cockroach (83%) and mollusca (49%-52%).The purifi ed AK was injected subcutaneously into mice to produce specifi c polyclonal antibodies for analyzing its immune cross-reactivity by Western blotting. It was shown that the proteins with relative molecular mass (Mr) of about 40 kD corresponding to AKs from 17 species of shellfi sh could be recognized by the AK-specifi c polyclonal sera. The results of both proteomics and immunological analysis have shown that AK is a pan-allergen among crustacean and mollusca.
Litopenaeus vannamei; allergen; arginine kinase; mass spectrometry; sequence homology; immune cross-reactivity
R392.8
A
1002-6630(2015)01-0170-04
10.7506/spkx1002-6630-201501032
2014-03-15
广东省重点实验室建设项目(2011A060901017)
孙一帆(1988—),男,硕士研究生,研究方向为重大疾病诊断试剂盒研发及食物过敏原。E-mail:sunyifantian@163.com
*通信作者:向军俭(1952—),男,教授,硕士,研究方向为抗体药物及食品安全。E-mail:txjj@jnu.edu.cn
