铁脂质体/水分配系数测定及影响因素考察
2015-12-07李妮娜耿丽娜元琳琳常彦忠张建军
李妮娜 耿丽娜,* 王 琳 元琳琳 常彦忠 张建军
(1河北师范大学化学与材料科学学院, 石家庄 050024; 2河北师范大学分析测试中心, 石家庄 050024)
铁脂质体/水分配系数测定及影响因素考察
李妮娜1耿丽娜1,*王 琳1元琳琳1常彦忠2张建军2
(1河北师范大学化学与材料科学学院, 石家庄 050024;2河北师范大学分析测试中心, 石家庄 050024)
采用薄膜旋转蒸发-超声法分别制备了柠檬酸铁脂质体(FAC-Lip)和血红素铁脂质体(Heme-Lip). 通过测定铁脂质体的体外释放, 发现两种铁脂质体均具有缓释性, 并且Heme-Lip的缓释性比FAC-Lip的好; 采用平衡透析法测定了脂质体/水分配系数(P), 并考察影响分配系数的因素, 初步探讨了FAC和Heme与脂质体膜结合的吉布斯自由能(ΔG), 结果发现随着胆固醇含量和药脂比例的增加, P先增大后减小, 当P最大时, 药物与磷脂膜的氢键及静电作用力最大; 在透析平衡时, 计算得到了FAC-Lip和Heme-Lip中药物与脂质体膜层之间的吉布斯自由能分别为–12.7和–18.2 kJmol–1.
柠檬酸铁; 血红素铁; 脂质体/水分配系数; 平衡透析; 吉布斯自由能
1 引 言
在脂质体制剂的研究中, 经常使用油/水(正辛醇-水)分配系数来预测药物的包封率以及载药量.1但这种方法侧重于研究药物的非特异性的亲脂性作用力的影响, 主要反映的是疏水作用力, 而忽略生物膜的生物学特性. 脂质体/水体系不存在相分离, 比油水体系更能模拟生物膜的结构, 脂质体/水分配系数在预测药物吸收方面比油/水分配系数更具优势,2它除了能反映疏水相互作用外, 还包括氢键、离子间静电作用、范德华力等, 体现了药物与生物膜的综合作用,3,4能更好地反映膜层与药物之间的作用力, 因此, 近年来, 国内外的一些学者更倾向于采用脂质体/水分配系数(P)来表征药物在生物膜中的分配.5,6Heijden和Jonker7采用脂质体/水分配系数判断有机物在生物体的聚集, 预测生物毒性. Ikonen8和Esteves9等采用脂质体/水分配系数预测药物在人体的吸收. 研究表明, 脂质体/水分配系数可以更好地指导载药脂质体的制备工艺, 预测药物的体内吸收.
铁是人体必需的微量元素之一, 在机体活动和生物代谢中起着非常重要的作用. 目前, 铁缺乏症是全球性营养缺乏疾病, 全世界约有11多亿人患缺铁性贫血, 世界卫生组织已将缺铁性贫血列为全球四大营养性疾病之一.10,11铁缺乏通常是由于摄入含铁食物不足、对食物中铁的利用度低或铁消耗过多造成的,12,13因此口服补铁剂或强化食物中铁含量是预防铁缺乏最好的可持续发展的方法.14目前, 常用的补铁剂主要是小分子有机酸铁盐, 如葡萄糖酸亚铁、柠檬酸铁、血红素铁、乙二胺四乙酸铁钠等, 一般通过口服方式进行补铁, 但存在口感差、副作用大、吸收率低、有毒性等缺点,15同时柠檬酸铁和血红素铁对光和热敏感、不稳定.
脂质体(liposome)是近年来出现的一种新型药物载体, 具有类细胞的双分子层结构, 无毒、无免疫原, 可作为亲水性、疏水性或是两性物质的载体,16用于药物、质粒、多肽、蛋白、病毒、细菌等17多种物质的载运, 还具有靶向性、低毒性、生物可降解性、增溶难溶物和长效缓释性等优点.18
本文使用脂质体制剂解决补铁剂的上述问题.通过研究柠檬酸铁(FAC)和血红素铁(Heme)在脂质体/水的分配情况, 分析药物与脂质体膜的相互作用及吉布斯自由能, 该研究有助于指导合成载药脂质体, 预测药物在体内的吸收, 并为药物在生物体的药代动力学研究提供参考.
2 实验部分
2.1 材料与主要设备
水溶性柠檬酸铁(纯度USP(美国药典级)), 美国Sigma公司; 水溶性血红素铁(纯度98%), 浙江海宁和田龙生物科技公司; 大豆卵磷脂(PC, 纯度 > 75%), 北京源华美磷脂科技有限公司; 胆固醇(chol,纯度 > 95%), 上海源叶生物科技有限中心; 其他试剂均为分析纯, 生物科技发展有限公司. U-3010紫外-可见分光光度计, 日本日立公司; CPS2超声波粉碎机, 宁波新芝超声有限公司; 85-2恒温磁力搅拌器, 常州澳华仪器有限公司; TGL-18-B高速离心机,湖南星科科学仪器有限公司; 微量移液器, 德国Eppendorf公司; JEM100SX透射电子显微镜(TEM),日本日立公司; ZetaSizer Nano ZS, 英国马尔文公司.
2.2 FAC(Heme)的工作曲线
配制一系列不同浓度的FAC(Heme)标准溶液,使用紫外分光光度计测定其在260 nm(393 nm)处的吸光度, 绘制浓度与吸光度的工作曲线.
2.3 铁脂质体的制备
采用薄膜旋转蒸发-超声法制备柠檬酸铁脂质体(FAC-Lip)和血红素铁脂质体(Heme-Lip). 按大豆卵磷脂 : 胆固醇质量比为(0.1–1) : (1–20)称取膜材,将其溶于适量的无水乙醇中, 置于旋转蒸发仪上真空旋转成膜. 取柠檬酸铁(血红素铁)的磷酸盐缓冲溶液(PBS)10 mL, 倒入上述成膜的圆底烧瓶中, 旋转, 直至成为均匀的混悬液. 超声处理, 将处理后的混悬液置于透析袋中纯化, 避光透析4–5 h. 将所得产物置于4 °C冰箱中, 保存备用.
按文献10中的方法, 测定包裹在脂质体中FAC和Heme的质量浓度, 按公式(1)计算铁脂质体的包封率.
2.4 铁脂质体体外释放研究
取FAC-Lip和Heme-Lip各2 mL, 分别与相同体积的胃液混合(pH = 1.3, 含有胃蛋白酶的PBS), 将混合液注入透析袋, 并放入装有100 mL释放介质(PBS, pH = 7.4)的烧杯中, 杯口用锡箔纸密封, 置于恒温培养振荡器内, 在37 °C, 60 rmin–1, 一定的时间间隔时, 取透析液1 mL, 同时补充相同体积的新鲜释放介质, 测定铁脂质体在胃液中的释放情况.以释放介质为空白对照, 使用紫外-可见分光光度计分别测定透析液中FAC和Heme的含量, 按公式(2)计算累积释放量.19

2.5 铁脂质体/水分配系数的测定
将文献20,21中的方法进行改进, 使用平衡透析法测定FAC-Lip(Heme-Lip)中FAC(Heme)的脂质体/水分配系数.
取适量的FAC-Lip(Heme-Lip)注入透析袋中, 将装有脂质体的透析袋置于装有释放介质的烧杯中,将其放在恒温磁力搅拌器上, 在室温下透析, 使其达到平衡. 按公式(3)计算FAC(Heme)的脂质体/水分配系数.22

其中, P为药物的脂质体/水分配系数, V1为 FACLip(Heme-Lip)的体积(L), C1为 FAC(Heme)的包封质量浓度(gL–1), C2为透析液中FAC(Heme)的质量浓度(gL–1), VL为脂质体磷脂双分子层的体积(L),此值按照文献23中的方法进行计算.
2.6 胆固醇的含量对FAC-Lip和Heme-Lip脂质体/水分配系数的影响
分别选用卵磷脂与胆固醇的质量比为8 : 1、10 : 1、12 : 1来制备铁脂质体, 考察胆固醇含量对 FACLip(Heme-Lip)脂质体/水分配系数的影响.
2.7 药脂比对FAC-Lip和Heme-Lip脂质体/水分配系数的影响
固定其他条件不变, 选择药脂比(FAC与卵磷脂的质量比)分别为1 : 6、1 : 6.5、1 : 7制备FAC-Lip,考察药脂比对 FAC-Lip脂质体/水分配系数的影响;选择药脂比(Heme与卵磷脂的质量比)分别为1 : 8、1 : 10、1 : 12制备Heme-Lip, 考察药脂比对Heme-Lip脂质体/水分配系数的影响.
2.8 FAC和Heme与脂质体膜层之间吉布斯自由能的测定
25 °C时, 检测透析平衡时脂质体中药物浓度和透析液中的药物浓度, 按公式(4)、(5)计算药物与脂质体磷脂双分子层之间吉布斯自由能(ΔG):
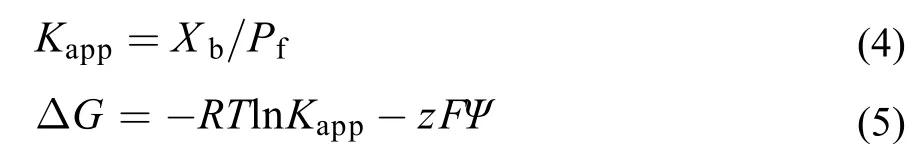
其中, Kapp是表观常数, Xb是平衡时脂质体中药物浓度(mgmL–1), Pf是平衡时透析液中的药物浓度(mgmL–1); z是药物所带的电荷(C), F是法拉第常数(Cmol–1), Ψ是脂质体zeta电位(mV).
3 结果与讨论
3.1 FAC(Heme)的工作曲线和铁脂质体的包封率
用紫外分光光度计在260和393 nm处测定不同浓度的柠檬酸铁和血红素铁溶液的吸光度(平行3次实验), 绘制溶度与吸光度的标准曲线(图1). 从图1可以看到柠檬酸铁和血红素铁的工作曲线, 线性关系良好. 根据公式(1)可得, FAC-Lip和Heme-Lip的包封率分别为61.55% ± 1.62%和56.57% ± 5.85%.
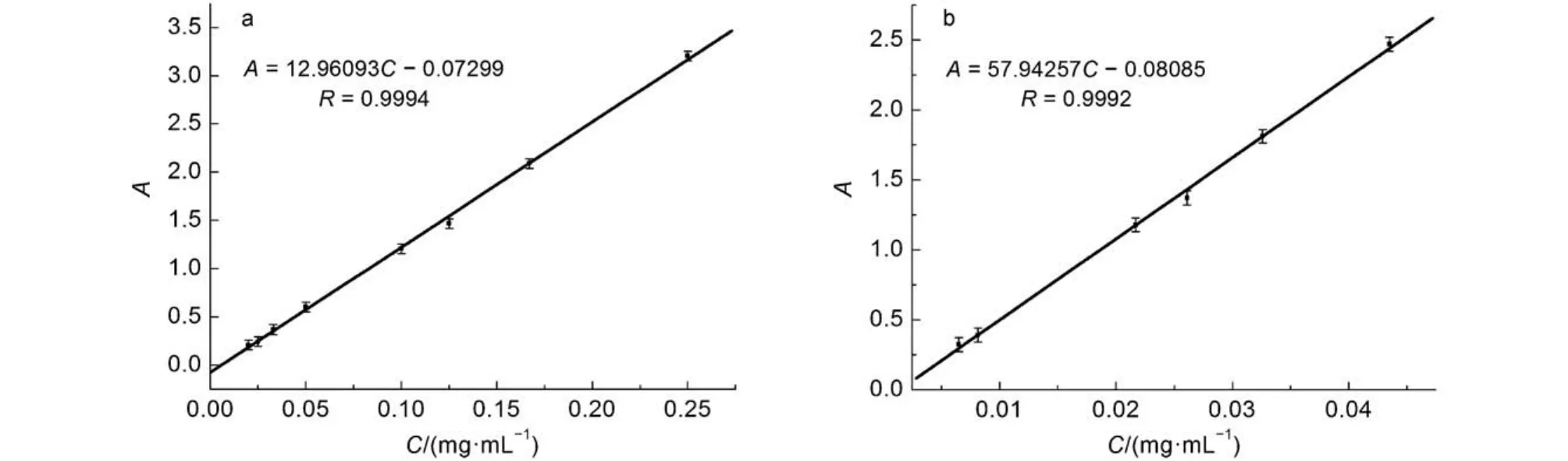
图1 柠檬酸铁(FAC) (a)和血红素铁(b)的吸光度(A)标准曲线Fig.1 Standard absorbance (A) curves of ferric citrate (FAC) (a) and Heme (b)
3.2 铁脂质体的体外释放
图2为FAC-Lip和Heme-Lip在人工模拟胃液中的释放曲线(平行3次实验), 从图中可以发现, FAC和Heme缓慢地从脂质体中释放出来, 没有突释现象. 在35 h时, FAC-Lip的累积释放量为97.43%, Heme-Lip的累积释放量为3.36%, Heme-Lip的缓释性比FAC-Lip的好. 一般胃的排空时间为2–4 h, 说明这两种铁脂质体在胃中均释放较少, 能顺利进入吸收系统.
3.3 FAC和Heme在脂质体/水相中的平衡时间
经过测定不同时间铁脂质体的平衡透析, 发现在4 h时, FAC和Heme在脂质体/水相中达到平衡(平行3次实验) (图3). 从图3可以看出, 在开始的一段时间内, 药物浓度波动较大, 随时间延长, 浓度持续降低, 在4 h时, 药物浓度波动减小, 基本保持恒定. 因此认为时间长于4 h, 药物在脂质体/水相中达到平衡.
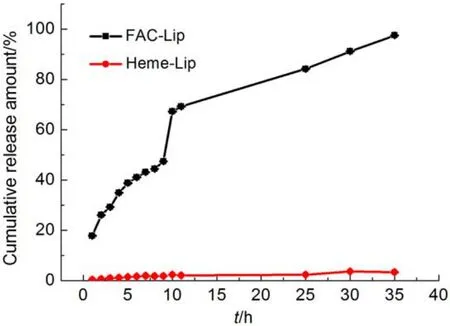
图2 柠檬酸铁脂质体(FAC-Lip)和血红素铁脂质体(Heme-Lip)的体外释放曲线Fig.2 In vitro release curves of ferric citrate liposome (FAC-Lip) and heme liposome (Heme-Lip)
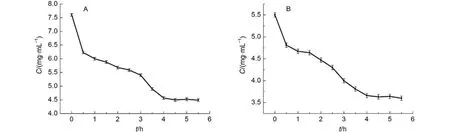
图3 药物在脂质体/水相中平衡分配时间Fig.3 Equilibrium partition time of drug in the phases of liposome and water
3.4 胆固醇含量对FAC-Lip和Heme-Lip的脂质体/水分配系数的影响
图4为不同磷脂与胆固醇之比时, FAC-Lip和Heme-Lip的脂质体/水分配系数(平行3次实验), 由图中可以发现, 随着胆固醇量的增加, P值先增大后减小, 出现这种现象是由于胆固醇作为生物膜的基本组成成分, 可以增加脂质体膜的流动性、完整性以及减少药物的渗漏, 但是随着磷脂膜中胆固醇量的增加, 会使磷脂膜刚性增加, 使其排列更加紧密,3,24使得药物很难进入脂质体磷脂双分子层中, 所以脂质体/水分配系数减小. 从图上看到, 当卵磷脂与胆固醇的质量比在10 : 1时, FAC-Lip和Heme-Lip的脂质体/水分配系数最大, 这表明, 此时药物与磷脂膜之间的静电、氢键作用力也最大.
3.5 药脂比对FAC-Lip和Heme-Lip脂质体/水分配系数的影响
不同的药脂质量比对FAC-Lip和Heme-Lip的脂质体/水分配系数(平行3次实验)的影响见图5. 从图中可以发现随着药脂比例的增加, P值先增大后减小, 这是因为在其他条件不变的情况下, 随着药物的增加, 可以分配进入脂质体双分子层的药物也随之增加; 当药物量达到一定时, 脂质膜层的包封量达到最大, 药物不能继续分配进入脂质体膜层中.当FAC-Lip和Heme-Lip的药脂质量比分别为1 : 6.5和1 : 10时, FAC-Lip和Heme-Lip的P值最大, 这说明,此时药物与磷脂膜的静电、氢键作用力最大.
3.6 FAC和Heme与脂质体膜层之间吉布斯自由能的计算
图3表明, 在4 h时, FAC和Heme在脂质体/水相中达到平衡, 此时, 两种铁脂质体的相关参数值Xb、Pf、T、Ψ见表1, 将这些数据, 代入公式(4)、(5)中,计算可得, FAC-Lip和Heme-Lip中药物与脂质体膜层之间的吉布斯自由能(ΔG)分别为–12.7和–18.2kJmol–1. Russell25和董文举26等的研究指出, 药物与脂质体膜之间的吉布斯自由能大小能够反映药物与膜层结合的难易程度, ΔG越负, 说明药物与脂质体膜层越容易结合. 这说明在我们的实验条件下,这两种铁脂质体很容易合成, 并且Heme更容易被包裹在脂质体中, 这可能是由于Heme中具有卟啉环结构, 上面的COO–基团与磷脂分子的亲水头部更好地结合, 同时这也与之前实验结果(Heme-Lip的缓释性比FAC-Lip的好)相一致.
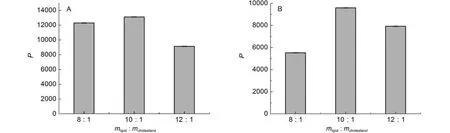
图4 胆固醇含量对FAC-Lip和Heme-Lip脂质体/水分配系数的影响Fig.4 Effect of cholesterol content on the liposome/water partition coefficients of FAC-Lip and Heme-Lip
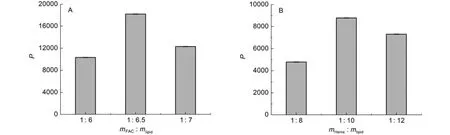
图5 药脂质量比对FAC-Lip和Heme-Lip脂质体/水分配系数的影响Fig.5 Effect of drug to lipid mass ratio on the liposome/water partition coefficients of FAC-Lip and Heme-Lip

表1 透析平衡时铁脂质体的相关参数Table1 Parameters of iron liposomes at dialysis equilibrium
4 结 论
药物在生物膜中的分配是一个非常复杂的过程, 与药物本身结构、理化性质及生物膜的性质均密切相关. 本实验以FAC和Heme为模型药物, 考察铁脂质体体外释放情况, 发现两种铁脂质体均具有缓释性, 并且Heme-Lip的缓释性比FAC-Lip的好; 研究了胆固醇含量和药脂比对FAC和Heme在生物膜中分配的影响, 发现随着胆固醇含量和药脂比例的增加, 脂质体/水分配系数均是先增大后减小, 当磷脂与胆固醇质量之比为10 : 1, 药脂比(质量比)分别为1 : 6.5和1 : 10时, FAC-Lip和Heme-Lip的脂质体/水分配系数最大, 此时药物与磷脂膜的静电、氢键作用力也最大.
FAC-Lip和Heme-Lip中药物与脂质体膜层之间的吉布斯自由能分别为–12.7和–18.2 kJmol–1, 说明Heme更容易被包裹在脂质体中, 这与Heme-Lip的缓释性更好相一致. 本实验将为载药脂质体的制备及药物在生物体的药代动力学研究提供参考.
(1)Wei, G.; Xu, H.; Ma, Y.; Li, S. M.; Zheng, J. M. Acta Pharm. Sin. 2001, 36 (9), 707.
(2)Barzanti, C.; Evans, R.; Fouquet, J.; Gouzin, L.; Howarth, N. M.; Kean, G.; Levet, E.; Wang, D.; Wayemberg, E.; Yeboah, A. A.; Kraft, A. Tetrahedron Lett. 2007, 48, 3337. doi: 10.1016/j.tetlet. 2007.03.085
(3)Suo, X. B.; Li, M. L.; Wang, Y. Q.; Qiu, J. S. Chin Pharm. J. 2009, 44 (23), 1796. [索绪斌, 李慕玲, 王玉强, 裘建社. 中国药学杂志, 2009, 44 (23), 1796.]
(4)Liu, K. F.; Li, X. F.; Zhang, Y. X.; Wang, F.; Wang, Y.; Deng, Y. H. Journal of Shenyang Pharmaceutical University 2010, 27(11), 853. [刘克非, 李晓峰, 张雅昕, 王 范, 王 岩, 邓意辉.沈阳药科大学学报, 2010, 27 (11), 853.]
(5)Wang, Y. L.; Li, J.; Wang, R. X. Acta Phys. -Chim. Sin. 2010, 26 (7), 1742. [王艳玲, 李 婕, 王任小. 物理化学学报, 2010, 26 (7), 1742.] doi: 10.3866/PKU.WHXB20100702
(6)Ingram, T.; Storm, S.; Kloss, L.; Mehling, T.; Jakobtorweihen, S.; Smirnova, I. Langmuir 2013, 29, 3527. doi: 10.1021/la305035b
(7)Heijden, S. A.V. D.; Jonker, M. T. O. Environ. Sci. Technol. 2009, 43, 8854. doi: 10.1021/es902278x
(8)Ikonen, M.; Murtomaki, L.; Kontturi, K. J. Electroanal. Chem. 2007, 602, 189. doi: 10.1016/j.jelechem.2006.12.014
(9)Esteves, F.; Moutinho, C.; Matos, C. J. Liposome Res. 2013, 23 (2), 83. doi: 10.3109/08982104.2012.742539
(10)Li, Y.; Geng, L. N.; Ge, L.; Yu, P.; Duan, X. L.; Chen, J.; Chang, Y. Z. Int. J. Pharm. 2013, 454, 82. doi: 10.1016/j.ijpharm. 2013.06.078
(11)Sharp, P. A. Int. J. Vitam. Nutr. Res. 2010, 80 (4–5), 231.
(12)Xia, Y.; Huang, K. D.; Zhang, X. Z.; Ma, H. J. Guide of China Medicine 2013, 11 (17), 615. [夏 芸, 黄坤丹, 张新征, 马海杰.中国医药指南, 2013, 11 (17), 615.]
(13)Chitra, G.; Prince, C.; Sumit, A. Food Hydrocolloids 2015, 43, 622. doi: 10.1016/j.foodhyd.2014.07.021
(14)Tripathi, B.; Platel, K. Food Chemistry 2011, 126 (2), 537. doi: 10.1016/j.foodchem.2010.11.039
(15)Yan, Z.; Luo, H. J. Foreign Medical Sciences (Section Hygiene) 2006, 33 (2), 90.
(16)Craparo, E. F.; Bondì, M. L.; Pitarresi, G.; Cavallaro, G. CNS Neurosci. Ther. 2011, 17 (6), 670. doi: 10.1111/j.1755-5949. 2010.00199.x
(17)Ma, B.; Zhang, S.; Jiang, H.; Zhao, B.; Lv, H. J. Control. Release 2007, 123 (3), 184. doi: 10.1016/j.jconrel.2007.08.022
(18)Lu, Q.; Lu, P. M.; Piao, J. H.; Xu, X. L.; Chen, J.; Zhu, L.; Jiang, J. G. LWT - Food Science and Technology 2014, 57, 686. doi: 10.1016/j.lwt.2014.01.044
(19)Lee, J. S.; Kim, H. W.; Chung, D.; Lee, H. G. Food Hydrocolloids 2009, 23 (8), 2226. doi: 10.1016/j.foodhyd. 2009.05.005
(20)Pauletti, G. M.; Wunderli-Allenspach, H. Eur. J. Pharm. Sci. 1994, 1 (5), 273. doi: 10.1016/0928-0987(94)90022-1
(21)Zhong, H. J.; Deng, Y. J.; Wang, L. J.; Du, S.; Wang, X. M.; Chen, Y. Journal of Shenyang Pharmaceutical University 2005, 22 (2), 110. [钟海军, 邓英杰, 王丽君, 杜 松, 王秀敏, 陈 妍.沈阳药科大学学报, 2005, 22 (2), 110.]
(22)Krämer, S. D.; Wunderli-Allenspach, H. Pharm. Res. 1996, 13 (12), 1851. doi: 10.1023/A:1016089209798
(23)Huang, C.; Mason, J. T. Proc. Natl. Acad. Sci. U. S. A. 1978, 75 (1), 308. doi: 10.1073/pnas.75.1.308
(24)Wang, Z. X.; Deng, Y. J.; Zhang, X. P. Acta Pharm. Sin. 2006, 41 (4), 318. [王志轩, 邓英杰, 张晓鹏. 药学学报, 2006, 41 (4), 318.]
(25)Russell, C. J.; Thorgeirsson, T. E.; Shin, Y. K. Biochemistry 1996, 35, 9526. doi: 10.1021/bi960614+
(26)Dong, W. J.; Feng, J. J.; Wang, J. J. Acta Phys. -Chim. Sin. 2003, 19 (3), 230. [董文举, 冯九菊, 王键吉. 物理化学学报, 2003, 19 (3), 230.] doi: 10.3866/PKU.WHXB20030309
Determination of Iron Liposome/Water Partition Coefficients and Identification of Influencing Factors
LI Ni-Na1GENG Li-Na1,*WANG Lin1YUAN Lin-Lin1CHANG Yan-Zhong2ZHANG Jian-Jun2
(1College of Chemistry and Material Science, Hebei Normal University, Shijiazhuang 050024, P. R. China;2Testing and Analysis Center, Hebei Normal University Shijiazhuang 050024, P. R. China)
Ferric citrate liposomes (FAC-Lip) and heme liposomes (Heme-Lip) were successfully prepared by a rotary-evaporated film-ultrasonication method. The release of iron liposomes were studied in vitro, and results showed that both iron liposomes had sustained-released properties, with Heme-Lip showing superior sustained-released over FAC-Lip. The liposome/water partition coefficients (P) were determined by equilibrium dialysis and the influences on P were evaluated, as well as the binding Gibbs free energy between FAC (Heme) and liposome. The results show that P initially increased and then decreased with increasing cholesterol content and the ratio of lipid to drug. The hydrogen and electrostatic interactions were largest when P was at its maximum. At the dialysis equilibrium, the binding Gibbs free energies (ΔG) of FAC-Lip and Heme-Lip were –12.7 and –18.2 kJmol–1, respectively.
Ferric citrate; Heme; Liposome/water partition coefficient; Equilibrium dialysis; Gibbs free energy
O642.1
10.3866/PKU.WHXB201509141
Received: May 15, 2015; Revised: September 9, 2015; Published on Web: September 14, 2015.
*Corresponding author. Email: genglina0102@126.com; Tel: +86-311-80787400.
The project was supported by the National Natural Science Foundation of China (31201305) and Natural Science Foundation of Hebei Province-Shijiazhuang Pharmaceutical Group (CSPC) Foundation, China (C2012205082).
国家自然科学基金(31201305)及河北省自然科学基金-石药集团医药联合研究基金(C2012205082)资助项目
©Editorial office of Acta Physico-Chimica Sinica
