镉污染条件下香樟和油樟对镉的吸收能力和耐性差异
2015-12-06陈良华徐睿杨万勤张健胡相伟张明锦高顺
陈良华,徐睿,杨万勤,张健,胡相伟,张明锦,高顺
四川农业大学生态林业研究所林业生态工程重点实验室,四川 成都 611130
镉污染条件下香樟和油樟对镉的吸收能力和耐性差异
陈良华,徐睿,杨万勤,张健,胡相伟,张明锦,高顺*
四川农业大学生态林业研究所林业生态工程重点实验室,四川 成都 611130
利用速生乡土木本植物修复 Cd污染土壤日益受到重视。利用香樟(Cinnamomum camphora)和油樟(C. longepaniculatum)作为实验材料,研究镉(Cd)污染(对照(CK)0.12 mg·kg-1;处理1(T1)2.5 mg·kg-1;处理2(T2)5 mg·kg-1)对2种树种形态生长、Cd积累与分配和生理生化特征的效应,旨在比较2种树种的重金属耐受性及修复能力差异。T1和T2均没有显著影响香樟的生物量积累,但T2条件下油樟叶片和根部的生物量显著下降,仅为CK的86%和65%;T1和T2均显著增加了2种树种细根及叶片的Cd含量,油樟在T1时总积累量达最大(与香樟相当,均为0.37 mg),T2条件下油樟的生物量和耐性指数显著降低,仅为CK的85%和76%,香樟的Cd总积累量(0.48 mg)高于油樟(0.36 mg),因此认为T2条件下香樟具有更强的修复能力;油樟叶片在T1和T2时均受到氧化胁迫,但香樟叶片却并没有受到活性氧分子的显著伤害;香樟在2个污染处理时超氧化物歧化酶(SOD)(T1和T2分别为CK的1.3和1.2倍)和过氧化物酶(POD)(T1和T2分别为CK的6.3和4.0倍)的活性均显著上升,但油樟的这些抗氧化酶活性却没有显著变化。这些结果说明,香樟幼苗比油樟幼苗具有更强的Cd耐受能力和脱毒能力;从土壤修复角度讲,低水平污染土壤条件下2种树种的修复能力差异不大,但香樟更适合修复污染程度更高的土壤。
镉污染;植物修复;乡土树种;樟科
随着工农业和城市化的发展,含镉(Cd)污染物经污水灌溉、大气沉降、农用物资施用、固体废弃物排放等途径进入各类生态系统,造成环境 Cd污染(黄益宗和朱永官,2004)。据报道,我国Cd污染土壤面积约1.3万hm2(茹淑华等,2006),近年来的“Cd米”事件让人们认识到Cd污染已经成为当前最为严重的环境问题之一。Cd污染常常以点源污染(point-source pollution)和面源污染(diffused pollution)的形式同时发生(郭观林和周启星,2005)。与点源污染区相比(如采矿区和冶炼区),面源性质的Cd污染虽然污染程度低,但具有极强的普遍性和隐蔽性,很容易进入食物链,对食品安全和人类健康的潜在威胁很大,因此,低Cd污染土壤的治理和修复显得尤为迫切。另一方面,植物修复(Phytoremediation)技术具有经济、高效且美化环境等优点,在修复重金属污染土壤的应用中倍受关注(Meers等,2009)。目前,用于点源污染修复的植物材料主要是超富集草本植物,如 Thlaspi caerulesences和Solanum nigrum(Bernard等,2004;魏树和等,2005)。这类植物因其极强的重金属耐性而能够在植被难以恢复的点源污染区生长繁衍,但由于经济价值低且易被畜禽取食而进入食物链,因而很难推广和应用于大面积的低Cd污染区,因此,筛选能有效修复低水平Cd污染土壤的其他植物显得尤为重要。与大多草本超富集植物相比,速生木本植物具有生长迅速、生物量大、根系发达、生长周期长的优点(Lunáčková等,2003),能积累较大量的重金属,同时可能耐受各类低Cd污染土壤,更为重要的是,其具有较高的使用和经济价值而便于应用和推广,这类植物的修复潜力值得深入研究。
与一般木本植物相比,珍贵乡土木本植物历经自然选择和区域演替进化,具有极强的抗逆性和适应性,同时具有更高的经济价值,因此,可以预见的是,生长较快的珍贵乡土木本植物既具有一般速生木本植物的修复潜能,又具有良好的市场前景,其开发利用的潜力值得重视。樟科(Lauraceae)植物作为我国珍贵乡土树种的重要代表,许多樟科树种不但生长迅速,而且是珍贵用材树种和观赏树种,有些是重要的香料植物,这些树种大多为阔叶喜光树种,喜温暖湿润气候,主根发达,须、侧根少,深根性。我国樟科树种主要分布在长江以南及西南地区,随着工农业及城镇化的发展,Cd污染已经成为这一区域典型的环境污染,例如,四川省邛崃土壤Cd含量是20年前的2倍(李冰等,2009),湖南省株洲某冶炼厂附近农田表层土中Cd的质量分数达到2.12 mg·kg-1(杨勇等,2010)。但是,目前存在的科学问题是,这些树种是否能良好的适应日益严重的Cd污染土壤,以及哪些树种具有较好的Cd污染土壤修复能力,这都是值得研究的科学问题。因此,本研究采用樟科樟属(Cinnamomum Trew)的香樟(C. camphora)和油樟(C. longepaniculatum)作为研究对象,研究这两种植物对于低Cd污染土壤的适应性和修复能力差异,从生物量积累、重金属积累与分配、抗氧化酶系统等方面比较两种植物的物种差异,以期为筛选具有良好Cd污染修复能力的树种,为Cd污染区的植物修复提供参考。
1 材料与方法
1.1 盆栽处理
于2013年5月初选择健康的香樟和油樟幼苗,借鉴截干、孕育新芽的传统造林方式培育幼苗,剪去主根,将剩余苗木根系浸泡于 ABT生根粉溶液中(质量分数为50 mg·kg-1),浸泡时间为6 h。将浸泡后的苗木预栽培在含有混合培养基质(m(冲积土)∶m(细沙)=3∶1)的苗床中。待苗木新芽长出约5 cm后,移栽长势一致的幼苗用于实验处理,实验分为3个处理,设置对照(0.12 mg·kg-1,CK)、2.5 mg·kg-1(T1)和5 mg·kg-1(T2)(以土壤干质量计)含Cd量等3个梯度,该污染梯度根据中国GB 15618—1995《土壤环境质量标准》设定,即土壤含Cd量≥1 mg·kg-1属于污染土壤,同时也参照一些Cd矿周边的农田土壤背景值。该污染梯度是将Cd(NO3)2溶液(2.36 mg·kg-1)施入土壤后充分混匀平衡1个月后用于盆栽实验。每盆移栽1株幼苗,所用花盆为圆台型花盆(口径为30 cm,深25 cm),每盆装10 kg冲积土(含水量为23%,最大田间持水量是52%),土壤背景值如表1所示。于2013年6月初开始实验处理,每一处理9次重复,实验处理是在半受控(只遮蔽雨水)的大棚中生长,每次日常浇水均避免多余的水渗漏出培养盆,从而避免Cd的流失。

表1 供试土壤基本理化性质Table 1 Basic physical and chemical properties of testing soil
1.2 苗木收获
实验处理期为3个月,于2013年9月初,每一种苗木每一处理均随机选择3株苗木,将选定苗木分为细根、粗根、老茎、新茎、叶等5部分,细根为小于1 mm的根,其余归为粗根,老茎为截干时已经长成的老茎,新茎为重新萌发后形成的茎。老茎、新茎和叶片均采用自来水冲洗干净后利用去离子水进行润洗,而细根和粗根在冲洗后用 20 mmol·L-1Na-EDTA浸泡20 min进行润洗,将所有清洁后的各种植物器官放入烘箱中,于105 ℃杀青30 min之后调整到70 ℃烘干至衡质量。生物总量为这5部分器官干质量的总和。
1.3 实验测定方法
在各器官生物量测定结束后,将各部分器官分别磨碎过筛(100目),细粉用于Cd含量测定。植物样品的Cd含量测定是用HNO3-HClO4-HF三酸消解后,采用原子吸收分光光度计法(岛津 AA-7000火焰原子吸收光谱仪)测定。Cd积累量为各器官Cd含量与干物质积累量的乘积。
实验处理结束后,每个处理随机选择3株苗木的第 4片叶(由上到下)用于超氧化物歧化酶(SOD)、过氧化物酶(POD)、丙二醛(MDA)、过氧化氢(H2O2)等生理指标的测定。利用四氮唑蓝(NBT)光化还原法测定SOD活性,愈创木酚法测定过氧化物酶(POD)活性,双组分分光光度法测定MDA含量,利用H2O2与和钛离子形成有色的[TiO(H2O2)]2+配合离子(特异吸收峰在410 nm)的原理对H2O2含量进行测定(Chen等2014,2011)。各指标的测定均重复3次。
1.4 数据处理和统计分析
本研究采用了转移系数(Translocation factor,TF)和耐性指数(Tolerance index, TI)来衡量Cd的迁移能力以及两种植物的重金属耐受能力。
(1)转移系数=地上部重金属平均含量/地下部重金属平均含量;
(2)耐性指数=重金属处理根干质量/对照根干质量。
采用SPSS16.0统计软件对各物种3个处理的数据进行单因素方差分析(one-way ANOVA),并用Duncan法进行处理间差异显著性检验(α=0.05)。利用二元方差分析(two-way univariate analysis)检验器官、Cd以及它们的交互作用对生物量积累、Cd含量和Cd积累量的显著性效应,以及分析物种、Cd及其交互作用对SOD、POD、MDA、H2O2、TF、TI的显著性效应。叶片Cd含量以及各生理生化指标相关性则采用Pearson相关分析进行检验。
2 结果与分析
2.1 Cd污染对生物量的影响
如图1(a)所示,T1和T2并没有显著影响香樟各器官的生物量积累,也并没有显著影响香樟生物量在各器官中的分配,二元方差分析结果表明,器官作为因子对各器官生物量积累的影响显著,但Cd的影响不显著。然而,对油樟而言(图1(b)),除老茎以外,叶片、新茎、粗根和细根均随着Cd处理水平的增加而下降,在T2条件下,这些器官的生物量积累均显著下降,二元方差分析也表明,器官和Cd都显著影响了油樟的生物量积累。对油樟总生物量而言,T1并没有显著影响总生物量,但在T2时显著降低,下降幅度为对照的15.2%。
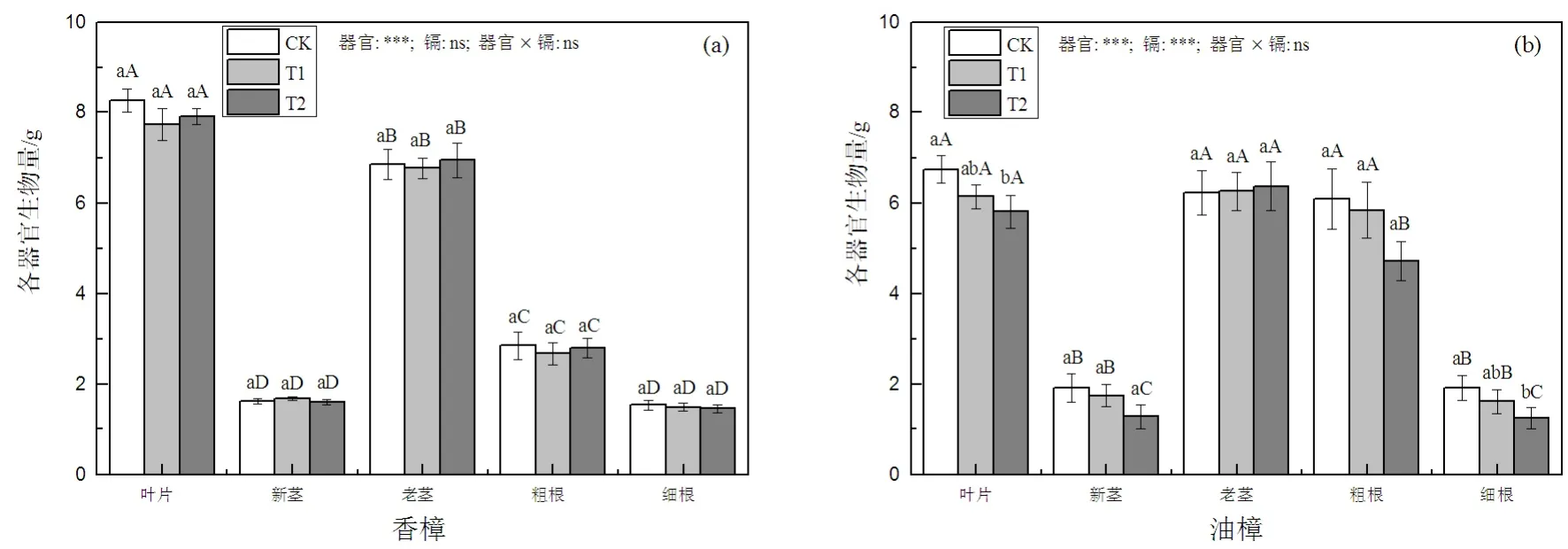
图1 Cd污染对香樟(a)和油樟(b)各器官生物量的影响Fig. 1 The effect of Cd pollution on biomass accumulation of different organs in C. camphora (a) and C. longepaniculatum (b)
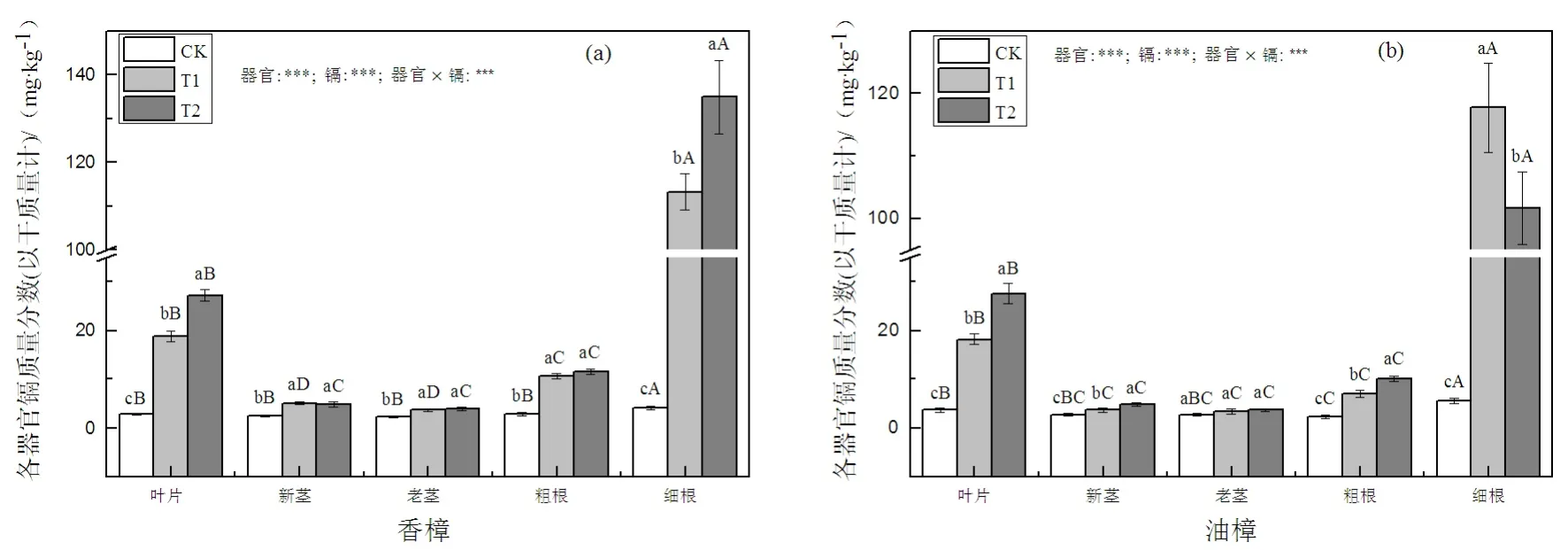
图2 Cd污染对香樟(a)和油樟(b)各器官Cd质量分数的影响Fig. 2 The effect of Cd pollution on Cd concentration of different organs in C. camphora (a) and C. longepaniculatum (b)
2.2 Cd污染对植物体内Cd含量的影响
如图2(a)所示,T1和T2均显著增加了香樟各器官中的Cd含量,细根和叶片的增加程度比其它器官更为显著,并且这两个器官中的Cd含量随着Cd处理水平的增加均进一步显著增加,而新茎、老茎以及粗根中Cd的含量并未随着Cd处理水平的增加而增加。对于Cd在香樟各器官中的分配而言,对照条件下细根中的Cd含量均显著大于粗根以及地上部分各器官,细根中Cd的含量是叶片中的1.5倍,在Cd污染条件下这种差异更为明显,T1条件下,细根中Cd的含量是叶片中的6倍。对于油樟而言(图2(b)),除老茎外,Cd污染显著增加了叶片、新茎、粗根以及细根中的Cd含量,叶片、新茎、粗根中的Cd含量随着Cd处理水平的增加进一步增加。和香樟相似,细根和叶片中Cd的含量增加是最为明显的,然而,油樟细根中的Cd含量在T1条件下达最大值,此时细根中Cd的含量是叶片中的6.5倍,而对照条件下,细根中的Cd含量是叶片中的1.5倍。二元方差分析表明,两种植物Cd的含量均显著受到器官、Cd及其交互处理的显著影响。
2.3 Cd污染对植物体内Cd积累量的影响
如图3(a)所示,因香樟的各器官生物量积累并未因Cd处理而发生显著变化,所以各器官Cd积累量和Cd含量变化相似,T1和T2均显著增加了香樟各器官中的Cd积累量,在T1时香樟叶片、新茎、老茎、粗根和细根的Cd积累量分别为CK的6.5、2.2、1.7、3.5和26.3倍,在T2时分别为CK的9.6、2.0、1.8、4.0和30.9倍,由此可见叶片和细根的增加幅度最大,并且这2个器官的Cd积累量随着Cd处理水平的增加进一步增加。虽然各种条件下细根中Cd的含量大于叶片中的Cd含量,但因香樟叶片生物量大于其细根生物量,所以,T2条件下叶片Cd的积累量超过了细根中Cd的积累量。对于油樟而言,Cd处理仅显著增加了叶片、粗根和细根中的Cd积累量,T1时油樟叶片、粗根和细根中的 Cd积累量分别为CK的4.6、2.9、17.8倍,T2时分别为CK的6.6、3.4、11.9倍,但因器官之间生物量的差异,在T1条件下细根的Cd积累量显著高于叶片(图3(b)),T2条件下叶片的Cd积累量与细根无显著差异。二元方差分析表明,两种植物Cd积累量均受到器官、Cd及其交互处理的显著影响。
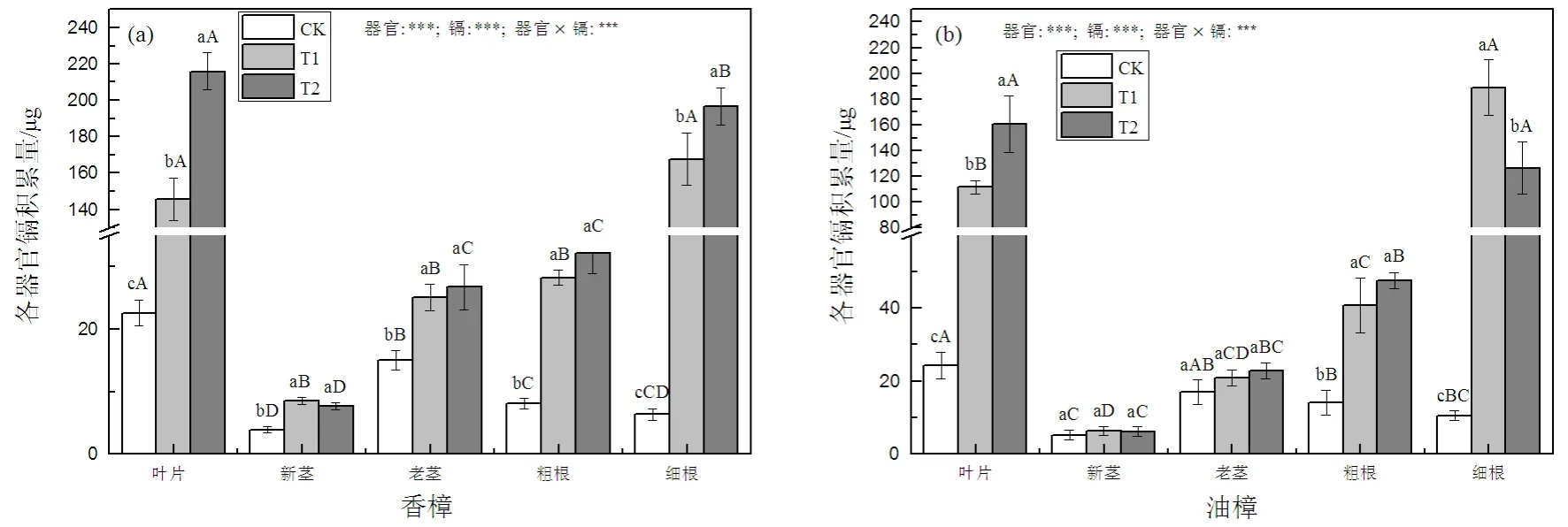
图3 Cd污染对香樟(a)和油樟(b)各器官Cd积累量的影响Fig. 3 The effect of Cd pollution on Cd accumulation in different organs in C. camphora (a) and C. longepaniculatum (b)
2.4 Cd污染对植物叶片活性氧的影响
由表2可见,T1没有引起两种树种叶片H2O2含量的显著上升,但T2却显著增加了两种植物叶片中的H2O2含量,与CK相比,香樟和油樟的H2O2含量分别增加了70%和180%。然而,对于MDA而言,2个梯度的Cd污染处理并没有显著影响香樟MDA的含量,但却显著增加了油樟叶片MDA的含量,T1和T2分别比CK增加了30%和50%。二元方差分析表明,物种、Cd均显著影响了H2O2的含量;物种、Cd及其交互作用显著影响了叶片MDA的含量。
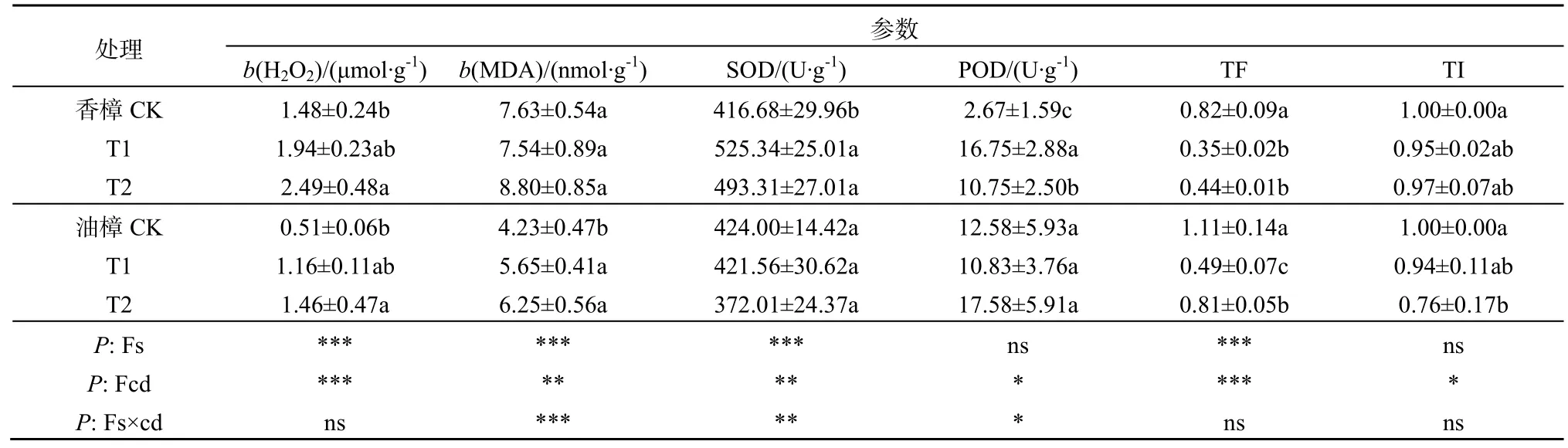
表2 Cd污染条件下2种树种生理指标及耐受指标的差异Table 2 Differences in physiological and tolerant parameters between two woody species when exposed to Cd pollution
2.5 Cd污染对植物叶片抗氧化酶的影响
由表2所示,2个梯度的Cd污染显著增加了香樟的SOD和POD活性,但却没有引起油樟SOD和POD活性发生显著变化;T1条件下香樟叶片的SOD和POD活性达最大值,分别为525和17 U·g-1FW。二元方差分析表明,物种、Cd及其交互作用显著影响了 SOD的活性,但物种作为独立因子并未显著影响POD的活性。
2.6 香樟和油樟Cd转移能力及耐受能力的差异
由表2可见,与CK相比,2种树种在Cd污染条件下Cd的TF均降低,值得注意的是,T2污染条件下油樟的TF显著高于T1。对于TI而言,两个Cd污染处理一定程度下降低了香樟的TI,但未达显著水平;但T2显著降低了油樟的TI。另外,二元方差分析表明,TF和TI均受到了Cd污染的显著影响。
2.7 相关性分析
由表3可见,2种物种Cd的含量仅与H2O2的含量呈极显著的相关关系,但与MDA、SOD、POD并没有显著的相关关系,但H2O2与MDA、SOD、POD均有极显著的相关关系,此外,MDA与H2O2、SOD、POD均有显著的相关关系。
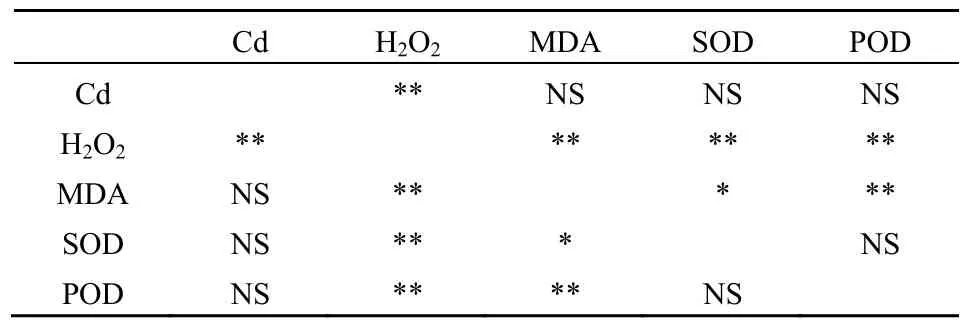
表3 各参数Pearson相关性检验Table 3 Pearson correlation detection for relationships between the variables
3 讨论
速生木本植物用于Cd修复的优势在于其蒸腾速率高、生长迅速、生物量大、根系发达,即使各个器官只能积累较低含量的Cd,但因其具有较大的生物量积累,也能使植物积累较大总量的Cd,以达到修复重金属污染土壤的良好效果(Wu等,2010)。香樟和油樟属于樟科树种中生长较为迅速的代表,经过一个生长季节的处理,T1条件下的Cd污染并没有引起2种树种生物量的显著下降,也没有表现出明显的中毒症状,说明这两种植物幼苗能够适应这一程度的Cd污染;然而,T2却引起了油樟细根和叶片生物量的显著降低,进而引起生物总量的下降,而香樟各器官的生物量并没有显著的变化,由些可见,这一程度的Cd污染对油樟的负面影响比香樟大,油樟对于这一程度的土壤Cd污染表现出了敏感性。另一方面,对于重金属的分配而言,许多文献表明,Cd作为植物非必须元素,普通植物在受污染条件下将会把大多数有毒Cd离子积累在植物的根部(Jarvis等,1976;Das等,1997),同时也有文献表明,植物如果能将更多的重金属分配到一些不活跃的器官或组织,比如根、细胞壁、角质层等,将减轻有毒重金属离子对植物的伤害(Pietrini等,2010;Chen等,2014)。本研究中,随着污染程度的增加,从各器官Cd含量及积累量变化来看,两种植物将有毒Cd离子优先分配到根系(尤其是细根)中,这可能是两种植物耐受 Cd污染的关键,T2条件下香樟仍然保持将Cd离子优先向根系分配,这可能是香樟具有较强Cd耐受能力的重要生理基础。TF的变化更能直观反映Cd离子的积累和分配策略,Cd污染条件下Cd离子向两个树种地上部的转移显著下降,说明两树种都存在限制有毒Cd离子向地上部分转移的能力,以减轻Cd离子的毒害作用;然而,在T2条件下油樟的TF显著高于香樟,说明香樟限制有毒Cd离子的能力更强,更有利于减轻Cd离子的毒害作用和对植物生长造成的负面影响;Cd离子的分配和积累策略差异是两树种Cd耐受能力差异的重要机理。
以前的学者把Cd超富集植物的标准定为:地上部分Cd质量分数超过100 mg·kg-1,且TF大于1(刘周莉等,2013),本研究中的两种植物显然达不到这一标准,因此植物的生物总量对于该植物的重金属修复显得更为重要。T1条件下的Cd污染并没有显著影响两树种各器官的生物量积累,两树种的总Cd积累量、TF和TI差异也不大,两种树种在这一污染水平的修复能力差异是不大的。但T2引起油樟(尤其是叶片和根系)生物量的下降,油樟的 TI也显著下降,说明这一污染水平已经抑制了油樟的生长,此时油樟的Cd总积累量也低于香樟,因此在这一污染水平香樟具有更强的修复能力。T2条件下,油樟根系中的Cd含量及积累量较T1条件下的Cd污染有显著的下降,从机理上看,伴随细根生物量的显著下降,根系表面积随之下降,而且细根的生物活性及功能可能受到了破坏,影响了根系对矿质离子及重金属Cd离子的交换吸附和在根系内部的扩散(Cutler和Rains,1974),Cd离子的毒害作用引起油樟生理代谢的紊乱,也必将会显著影响它的Cd修复能力。
活性氧自由基(Reactive oxygen species, ROS)是植物体光合、呼吸、固氮等代谢过程不可避免的产物,在植物体内由抗氧化酶类(如 SOD、POD等)和一类抗氧化剂(如抗坏血酸和谷胱甘肽)协同调节其产生和清除,使得 ROS处于无害的极低水平(汤春芳等,2004)。然而,Cd胁迫会通过间接激活NADPH氧化酶、扰乱电子传递链以及钝化抗氧化酶等方式导致ROS产生和清除失衡(Chen等,2011),引起这类氧化性极强的分子过量积累,从而对细胞内生物大分子产生氧化伤害作用,比如细胞膜、蛋白质以及核酸。在本研究中,随着 Cd处理水平的增加,H2O2的含量也随之增加,T2引起了两种树种H2O2的显著增加。MDA作为膜脂过氧化的产物,其含量并没有与 H2O2的变化完全一致,香樟MDA并没有显著增加,说明这一含量的H2O2并没有显著的伤害香樟叶片的细胞膜,香樟表现出比油樟更强的抗氧化胁迫能力。然而,两个梯度的Cd处理均显著引起了油樟MDA的上升,T1并没有引起油樟 H2O2含量的增加,这说明油樟细胞膜的损伤还有可能被其它一些ROS伤害而引起,比如超氧阴离子或者羟自由基。SOD和POD分别作为清除超氧阴离子和 H2O2的重要酶类,在两个物种的叶片内的响应却截然不同,香樟的 SOD、POD在受到Cd污染条件时都发生了显著的上升,但油樟的这两种酶均没有发生显著的变化,油樟叶片内抗氧化酶类缺乏有效响应可能直接导致了其ROS的显著增加。也有许多文献(吴月燕等,2009;姜成等,2013)表明,抗性强的品种在受到环境Cd污染时,抗氧化酶类表现出了更强的响应,以减轻植物遭受的氧化胁迫,而敏感性品种的抗氧化酶活性往往较低,酶的表达受到抑制或者酶的辅因子被取代而钝化,均会导致其活性在受到环境Cd污染时受到抑制。由此可见,香樟具有比油樟更强的抗氧化酶表达体系,从而表现出更强的抗氧化胁迫能力以适应本研究中两水平的Cd污染。
此外,本研究对一些指标的相关分析研究表明,细胞内的Cd含量并没有与细胞膜的伤害指标(即MDA)存在显著的相关关系,这说明细胞内的Cd并没有对细胞膜产生直接的伤害作用。但是,Cd含量与细胞内的 H2O2存在极显著的正相关关系,这说明细胞的Cd的增加引起了两个物种H2O2的显著增加,而H2O2与MDA、SOD以及POD都存在显著的相关关系,这说明 H2O2可能发挥着重要的信号分子作用。与本研究一致的是,前人的许多研究表明,H2O2等活性氧分子可能作为重要的信号分子,调控着细胞内相关抗逆基因的表达并启动植物抗毒素合成基因的转录(杜秀敏等,2001)。
4 结论
在 T1条件下,香樟和油樟各器官生物量均未发生显著变化,T2水平的污染仍未显著影响香樟生物量,而油樟显著下降,由此可见,油樟对于较高水平的Cd污染更为敏感,只能通过生长调节以适应土壤Cd污染的加剧。另一方面,根系(尤其是细根)是两种植物重金属Cd积累最重要的器官,随着Cd污染的加剧,香樟将Cd离子稳定分配到根系,TF远低于对照,表现出了植物固定的特征;但T2条件下油樟中 Cd向地上部分转移比例增加(TF=0.81),显著抑制了油樟的生长,导致其Cd积累总量小于香樟,香樟更适合这一水平的Cd污染;两种植物的活性氧特征也表明Cd污染条件下油樟叶片的细胞膜受到了更为严重的伤害,这与其抗氧化酶体系没有有效的响应密切相关。因此,从修复层面来讲,T1污染水平条件下,香樟和油樟的修复能力差异不大,但香樟更适合T2污染水平的土壤修复;从耐受能力来看,香樟具有比油樟显著高的重金属耐受能力,尤其是对较高水平的土壤Cd污染。
BERNARD C, ROOSENS N, CZERNIC P, et al. 2004. A novel CPx-ATPase from the cadmium hyperaccumulator Thlaspi caerulescens[J]. FEBS Letters, 569: 140-148.
CHEN L, GAO S, ZHU P, et al. 2014. Comparative study of metal resistance and accumulation of lead and zinc in two poplars[J]. Physiologia Plantarum, 151: 390-405.
CHEN L, HAN Y, JIANG H, et al. 2011. Nitrogen nutrient status induces sexual differences in responses to cadmium in Populus yunnanensis[J]. Journal of Experimental Botany, 62: 5037-5050.
CUTLER JM, RAINS DW. 1974. Characterization of cadmium uptake by plant tissue[J]. Plant Physiology, 54: 67-71.
DAS P, SAMANTARAY S, ROUT G. 1997. Studies on cadmium toxicity in plants: a review[J]. Environmental Pollution, 98: 29-36.
JARVIS S, JONES L, HOPPER M. 1976. Cadmium uptake from solution by plants and its transport from roots to shoots[J]. Plant and soil, 44: 179-191.
LUNÁČKOVÁ L, MASAROVIČOVÁ E, KRÁL'OVÁ K, et al. 2003. Response of fast growing woody plants from family Salicaceae to cadmium treatment[J]. Bulletin of Environmental Contamination and Toxicology, 70: 576-585.
MEERS E, QADIR M, DE CARITAT P, et al. 2009. EDTA-assisted Pb phytoextraction[J]. Chemosphere, 74: 1279-1291.
PIETRINI F, ZACCHINI M, IORI V, et al. 2010. Spatial distribution of cadmium in leaves and its impact on photosynthesis: examples of different strategies in willow and poplar clones[J]. Plant Biology, 12: 355-363.
WU F, YANG W, ZHANG J, et al. 2010. Cadmium accumulation and growth responses of a poplar (Populus deltoids×Populus nigra) in cadmium contaminated purple soil and alluvial soil[J]. Journal of Hazardous Materials, 177: 268-273.
杜秀敏, 殷文璇, 赵彦修, 等. 2001. 植物中活性氧的产生及清除机制[J].生物工程学报, 17(2): 121-125.
郭观林, 周启星. 2005. 镉在黑土和棕壤中吸附行为比较研究[J]. 应用生态学报, 16(12): 2403-2408.
黄益宗, 朱永官. 2004. 森林生态系统镉污染研究进展[J]. 生态学报, 24(1): 101-108.
姜成, 申晓慧, 周清波, 等. 2013. Pb-Cd 复合胁迫对3种草本花卉抗氧化酶系统的影响[J]. 中国农学通报, 29(28): 134-137.
李冰, 王昌全, 谭婷, 等. 2009. 成都平原土壤重金属区域分布特征及其污染评价[J]. 核农学报, 23(2): 308-315.
刘周莉, 何兴元, 陈玮. 2013. 忍冬 —— 一种新发现的镉超富集植物[J]. 生态环境学报, 22(4): 666-670.
茹淑华, 苏德纯, 王激清. 2006. 土壤镉污染特征及污染土壤的植物修复技术机理[J]. 中国生态农业学报, 14(4): 29-33.
汤春芳, 刘云国, 曾光明, 等. 2004. 镉胁迫对萝卜幼苗活性氧产生、脂质过氧化和抗氧化酶活性的影响[J]. 植物生理与分子生物学学报, 30(4): 469-474.
魏树和, 周启星, 王新. 2005. 超积累植物龙葵及其对镉的富集特征[J].环境科学, 26(3): 167-171.
吴月燕, 陈赛, 张燕忠, 等. 2009. 重金属胁迫对5个常绿阔叶树种生理生化特性的影响[J]. 核农学报, 23(5): 843-852.
杨勇, 江荣风, 李花粉, 等. 2010. 土壤容重改变对锌/镉超累积植物遏兰菜根系特征及吸镉的影响[J]. 环境科学, 31(12): 3043-3049.
Interspecific Differences between Cinnamomum camphora and C. longepaniculatum in Cd Absorption and Tolerance under Two Levels of Cd Pollution
CHEN Lianghua, XU Rui, YANG Wanqin, ZHANG Jian, HU Xiangwei, ZHANG Mingjin, GAO Shun
Key Laboratory of Ecological Forestry Engineering, Institute of Ecology & Forestry, Sichuan Agricultural University, Sichuan Chengdu 611130, China
More and more attention is being paid to the methods of using fast-growing woody plants for cleaning soil polluted by heavy metals. In our study, Cinnamomum camphora and C. longepaniculatum as model species were used to detect three levels of cadmium (Cd) (CK, 0.12 mg·kg-1soil; T1, 2.5 mg·kg-1soil; T2, 5 mg·kg-1soil) on morphological growth, metal accumulation and distribution, and physiological and biochemical traits. Our aim was to compare the differences in metal tolerance and remediation capacity between the species. The results showed that (1) both T1 and T2 did not significantly affect biomass of C. camphora, but T2 significantly decreased the mass of leaves and fine roots in C. longepaniculatum, which decreased to 86 and 65% of CK, respectively. (2) Cd pollution induced an increase in Cd concentration of both fine roots and leaves in both species. The maximum of total Cd accumulation (0.37 g) reached at T1 in C. longepaniculatum. Similar accumulation amount was detected under T1 in C. camphora. In contrast, biomass and tolerance index (TI) in C. longepaniculatum decreased to 85 and 76% of CK under T2, respectively. Total of Cd accumulation in C. camphora (0.48 mg) was higher than that in C. longepaniculatum (0.36 mg), which indicated that C. camphora has a higher capacity in Cd remediation than C. longepaniculatum under T2. (3) leaves of C. longepaniculatum suffered an oxidative stress under both T1 and T2, while such stress did not occur in C. camphora. (4) the activities of both SOD and POD significantly increased in C. camphora under both levels of Cd pollution, although activities of such anti-oxidative enzymes did not significantly change in leaves of C. longepaniculatum. The SOD in C. camphora increased to 1.3 and 1.2 times of CK, respectively, and POD increased to 6.3 and 4.0 times of CK, respectively. Therefore, our results indicated that there is a higher capacity in Cd tolerance and detoxification against heavy metals in C. camphora seedlings, when compared to C. longepaniculatum seedlings. In refer to soil remediation, there was no significant difference in remediation capacity between two species under low level of Cd pollution, whereas C. camphora has a higher capacity in Cd remediation under higher extent of Cd pollution.
cadmium pollution; phytoremediation; native tree species; lauraceae
10.16258/j.cnki.1674-5906.2015.02.021
X173
A
1674-5906(2015)02-0316-07
陈良华,徐睿,杨万勤,张健,胡相伟,张明锦,高顺. 镉污染条件下香樟和油樟对镉的吸收能力和耐性差异[J].生态环境学报, 2015, 24(2): 316-322.
CHEN Lianghua, XU Rui, YANG Wanqin, ZHANG Jian, HU Xiangwei, ZHANG Mingjin, GAO Shun. Interspecific Differences between Cinnamomum camphora and C. longepaniculatum in Cd Absorption and Tolerance under Two Levels of Cd Pollution [J]. Ecology and Environmental Sciences, 2015, 24(2): 316-322.
四川省科技厅应用基础项目(2013JY0083);国家“十二五”科技支撑计划课题(2011BAC09B05);国家自然科学基金项目(31300513);中国博士后科学基金项目(2012M521707);四川省教育厅基础研究项目(13ZB0280)
陈良华(1982年生),男,博士,主要从事木本植物抗逆生理研究。E-mail: chenlh@sicau.edu.cn *通讯作者:高顺(1977年生),男,博士,副研究员,硕士生导师,主要从事植物生理学和环境生态学研究。E-mail: sicauchenlh@126.com
2014-11-17
