大鼠线粒体膜蛋白Nix基因过表达与shRNA慢病毒载体的构建与鉴定*
2015-12-06张君莉黄永秀王建东
张君莉,黄永秀,张 红,王 丹,刘 腾,李 亚△,王建东△
1.成都医学院 生物医学系(成都 610500);2.成都医学院 检验医学院(成都 610500);3.成都医学院第一附属医院 检验科(成都 610500)
线粒体是细胞能量供应的重要细胞器,能通过三羧酸循环和氧化磷酸化进行能量转换[1]。线粒体健康与否决定了细胞的生存和死亡[2-4]。大量证据显示,许多疾病都有一个共同的特征:功能障碍的线粒体大量堆积,包括心脏疾病[5]、阿尔兹海默症[6]、帕金森疾病[7]、肿瘤[8]和糖尿病等[9]。Nix是近年来发现定位于线粒体外膜的一类功能蛋白,在调节细胞自噬和线粒体自噬的过程中发挥着重要作用[10-11]。本研究旨在构建Nix基因过表达与shRNA慢病毒载体,为进一步深入探索Nix参与细胞自噬的分子机制奠定更好的基础。
1 材料与方法
1.1 材料
PC12细胞购自中国科学院典型培养物保藏委员会细胞库。pcDNA3.1(+)-N2-FLAG-Nix质粒由四川大学华西第二医院姜长安教授惠赠。DMEM完全培养基购自HyClone公司。胎牛血清购自以色列BioInd公司。BCA蛋白定量试剂盒购自碧云天生物科技研究所。抗体anti-Nix购自Cell Signaling Technology 公 司。anti-β-actin 购 自Novus Biologicals公司。辣根过氧化物酶(HRP)标记的羊抗兔或鼠二抗购自CST公司。羊抗兔Alexa Fluor 488购自碧云天公司。PVDF膜和ECL化学发光试剂购自Millipore公司。嘌呤酶素(puromycin)购自北京索莱宝科技有限公司。Nix过表达、Nix shRNA慢病毒和对照慢病毒由上海汉恒生物科技有限公司提供。
1.2 方法
1.2.1 Nix慢病毒表达载体的构建 根据GenBank提供的大鼠Nix基因全长信息,设计PCR扩增引物,以pcDNA3.1(+)-N2-FLAG-Nix质粒为模板进行PCR扩增。Nix基因序列信息:AT GTCTCACTTAGTCGAGCCGCCGCCGCCCCTGC ACAACAACAACAACAACTGCGAGGAAG G G G AGCAGTCCCTGCCGCCGCCCGCTGGCCTCAAC AGTTCCTGGGTGGAGCTACCCATGAAC A GCA GCAATGGCAACGGTAATGGAAATGGGAAGA ATGGGGGCCTGGAGCACGTTCCTTCCTCGT C TTCCATCCACAATGGAGACATGGAGAA G AT CCTTCTGGATGCGCAGCATGAGTCG G G A C A GAGCAGCTCAAGAGGCAGTTCTCACT G T G A CAGCCCTTCACCACAAGAAGACGGGC A A A T AATGTTTGATGTTGAGATGCACACCA G C AG GGACCACAGCTCTCAGTCAGAAGAAGA A G T TGTAGATGGAGAAAAAGAAGTTGAG G C T T TGAAGAAAAGTGCAGACTGGGTATCAGACT GGTCCAGTAGACCCGAAAACATCCCACCCAA AGAGTTCCATTTCAGACACCCTAAG C G T G C AGCCTCTCTAAGCATGAGGAAGAGTGGA G C CATGAAGAAAGGGGGCATTTTCTCTGCA G A GTTCCTGAAGGTCTTCATCCCATCTCTCT T C CTCTCTCACGTGTTGGCTTTGGGGCTGGGCA TCTATATCGGAAAACGACTGAGCAC A C C TT CTGCCAGCACCTACTGA。将处理好的目的片段连接到经BamHⅠ、EcoRⅠ双酶切的慢病毒pHBLV-CMVIE-IRES-Puro载体中,转化感受态细胞DH5α,Nix平板筛选阳性重组子并进行测序鉴定。靶序列设计与合成均由上海汉恒生物科技有限公司完成。
1.2.2 Nix shRNA慢病毒表达载体的构建 分别根据Genbank中大鼠Nix基因序列,设计与合成3对shRNA靶序列。其中,正义链5′端引入BamHⅠ酶切位点,反义链5′端引入EcoRⅠ酶切位点。Nix siRNA1序列:正义链5′-GATCCGGAAGAG TGGAGCCATGAAGATTCAAGAGATCTTCAT GGCTCCACTCTTCCTTTTTC-3′,反义链 5′-AA TTGAAAAAAGGAAGAGTGGAGCCATGAAG ATCTCTTGAATCTTCATGGCTCCACTCTTCCG-3′;Nix shRNA2 序 列:正 义 链 5′-GATCCGCACCAGCAGATTATAATCTTGTCAATTCAA GAGATTGACAAGATTATAATCTGCTGGTGTTTTTTC-3′,反 义 链5′-AATTGAAAAAACACCAGCAGATTATAATCTTGTCAATCTCTTGAATTGACAAGATTATAATCTGCTGGTGCG-3′;Nix shRNA3序列:正义链5′-GATCCGCACTCTG AGGGAATCTGTGTCTTATTTCAAGAGAATA AGACACAGATTCCCTCAGAGTGTTTTTTC-3′,反 义 链5′-AATTGAAAAAACACTCTGAGGGA ATCTGTGTCTTATTCTCTTGAAATAAGACA CAGATTCCCTCAGAGTGCG-3′(下划线处为干扰序列)。将合成的DNA单链退火形成双链,连接到经BamHⅠ、EcoRⅠ双酶切的慢病毒pHBLVU6-Scramble-Puro载体中,转化感受态细胞 DH5α,Nix shRNA平板筛选阳性重组子并进行测序鉴定。靶序列设计与合成均由上海汉恒生物科技有限公司完成。
1.2.3 Nix和Nix shRNA慢病毒的包装与滴度测定 取对数生长期的293T细胞,接种于75cm2细胞培养瓶中,接种量8×106个/孔,于37℃、5%CO2条件下培养,待细胞密度达80%~90%时,按照汉恒生物LipofiterTM转染试剂说明书操作,将含有重组子的慢病毒载体与病毒包装辅助质粒共感染293T细胞。转染48和72h后分别两次收集病毒上清,以0.45μm滤器过滤后,于40mL超速离心管中,4℃、离心120min(离心半径20cm,转速7 000r/min),500μL新鲜培养液重悬病毒沉淀,置于-80℃保存。分别取部分慢病毒浓缩液,采用梯度稀释法测定,并按照滴度(TU/mL)=细胞数百分比×MOI(1)×病毒稀释倍数×103,计算病毒滴度。慢病毒的包装与滴度测定均由上海汉恒生物科技有限公司完成。
1.2.4 慢病毒感染PC12细胞和稳定感染PC12细胞株的筛选 取对数生长期的PC12细胞,接种于24孔板中,接种量5×104个/孔,于37℃、5%CO2培养24h,待细胞密度达80%~90%时,以病毒液与培养液体积比1∶9的比例,加入对照慢病毒、Nix和Nix shRNA慢病毒进行感染,24h后更换新鲜培养液,48h后加入2.5μg/mL的puromycin筛选阳性细胞。持续筛选两周后,获得各组慢病毒稳定感染PC12细胞株。
1.2.5 细胞荧光技术检测Nix荧光数量 取对数生长期的对照慢病毒、Nix和Nix shRNA慢病毒稳定感染的PC12细胞,接种于多聚赖氨酸包被圆玻片的24孔板中,接种量为5×104个/孔,37℃、5%CO2细胞培养箱培养24h后,吸去培养基,PBS洗涤3次,冰甲醇-20℃,固定15min,PBS洗涤3次,加入封闭液室温封闭1h,吸出封闭液,加入一抗(Nix 1∶200)后,4℃过夜。吸出一抗,PBS洗涤3次,加入二抗(羊抗兔Alexa Fluor 488 1∶500)37℃孵育1h,吸出二抗,PBS洗涤3次,封片,利用荧光显微镜观察照相。
1.2.6 Western blot检测各组慢病毒稳定感染PC12细胞中Nix蛋白的表达 分别收集对照慢病毒、Nix和Nix shRNA慢病毒稳定感染的PC12细胞,加入ripa裂解液冰上裂解30min,于4℃、离心15min(离心半径20cm,转速1 2000r/min),收集裂解上清液,BCA法测定蛋白浓度。SDS-PAGE电泳,每组上样60μg/泳道,PVDF膜湿转60~80 min,一抗(Nix 1∶800、β-actin 1∶5 000)4℃孵育过夜,TBST洗膜3次,二抗(HRP标记的羊抗兔或鼠二抗1∶5 000)37℃孵育1h,TBST洗膜3次,凝胶成像法检测相关蛋白的表达情况。
2 结果
2.1 慢病毒载体的测序鉴定
测序结果显示,Nix过表达载体测序结果与设计的Nix靶序列完全一致。3条Nix shRNA慢病毒载体序列与设计的3对shRNA靶序列完全一致(图1),表明成功构建针对Nix基因的重组慢病毒载体。
2.2 病毒滴度测定
计算得到各组慢病毒滴度均达到2×108PFU/mL,滴度较高,可以用于下一步实验要求。
2.3 细胞荧光技术检测各组慢病毒稳定感染PC12细胞中Nix荧光水平
荧光显微镜观察各组慢病毒稳定感染的PC12细胞,显示Nix稳定感染PC12细胞与对照细胞相比,Nix荧光水平明显增强,Nix shRNA1稳定感染PC12细胞与对照细胞相比,荧光水平明显减弱(图2)。
2.4 Western blot检测各组慢病毒稳定感染PC12细胞中Nix蛋白的表达情况
对各组慢病毒稳定感染PC12细胞中Nix蛋白的表达情况分别进行Western blot检测,可以看到Nix基因过表达感染PC12细胞中Nix蛋白表达显著升高(图3)。shRNA1、shRNA2和shRNA3慢病毒感染的PC12细胞中Nix蛋白表达明显降低,其中shRNA1感染PC12细胞中Nix蛋白降低最显著(图4)。

图1 慢病毒载体的测序结果

图2 荧光显微镜观察各组慢病毒稳定感染PC12细胞中Nix荧光水平(×200)
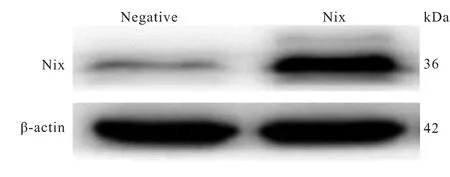
图3 Western blot检测Nix基因过表达慢病毒稳定感染PC12细胞中Nix蛋白的表达情况
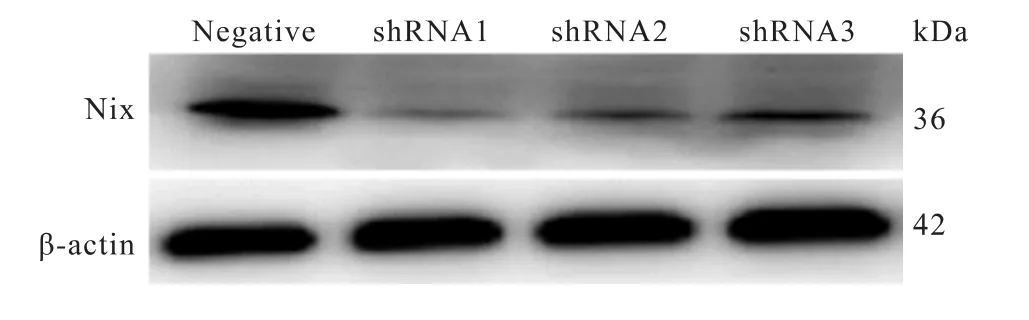
图4 Western blot检测Nix shRNA各组慢病毒稳定感染PC12细胞中Nix蛋白的表达情况
3 讨论
线粒体自噬是细胞生物学研究的热点,线粒体自噬功能障碍与多种疾病的发生有着密切联系,比如神经退行性疾病、血液病、心血管疾病、代谢性疾病和肿瘤等[12]。深入研究线粒体自噬调控的分子机制将有利于更深入了解疾病的发病机制,为疾病的预防和治疗提供新的靶点。
Nix是近年来发现的隶属BCL-2家族中的BH3-only促凋亡家族成员,定位于线粒体,虽然具有BCL-2家族特征性的BH3域和羧基末端跨膜结构域(TM),也能与BCL-2形成二聚体,但Nix促凋亡活动明显不同于其他BCL-2家族成员[13]。研究[13]发现,Nix可以通过一种微弱或推迟的方式引起细胞死亡,并能诱导自噬,调节线粒体的清除。这些不同活动都涉及一个统一的主题,即线粒体。线粒体是Nix诱导自噬的重要中介,Nix通过不同机制使线粒体功能障碍,促进死亡因子释放,最终细胞在发展过程中或压力应激下通过Nix针对性清除线粒体。越来越多的证据显示,Nix参与了人类疾病的发展[14-15]。在缺血性损伤和心脏疾病中,Nix表达水平降低,Nix缺失可保护由Gaq介导的压力负荷型心脏病[16]。Nix在癌症中的作用更为复杂[10],在癌症发展的不同时期,它既能促进细胞死亡又能促进细胞存活。在神经退行性疾病[17]如帕金森病、亨廷顿病和阿尔茨海默症中,Nix表达水平明显升高。Nix表达的失调很大程度上影响了疾病的进展。在未来的研究中,我们将进一步阐明依赖Nix的细胞死亡机制,并确定其在疾病中的作用。
本研究采用酶切连接的方法,成功构建了有关Nix基因过表达和shRNA慢病毒表达载体,并获得Nix过表达与干扰细胞模型,为进一步研究Nix介导细胞自噬及线粒体自噬的分子机制奠定了基础。
[1]Novak I.Mitophagy:a complex mechanism of mitochondrial removal[J].Antioxidants Redox Signaling,2012,17(5):794-802.
[2]Galluzz L,Kepp O,Trojel-Hansen C,et al.Mitochondrial control of cellular life,stress,and death[J].Circ Res,2012,111(9):1198-1207.
[3]Li LY,Luo X,Wang X.Endonuclease G is an apoptotic DNase when released from mitochondria[J].Nature,2001,412(6842):95-99.
[4]Wallace DC.Mitochondrial diseases in man and mouse[J].Science,1999,283(5407):1482-1488.
[5]Gerald GW.Mechanisms of non-apoptotic programmed cell death in diabetes and heart failure[J].Cell Cycle,2010,9(17):3442-3448.
[6]Palikaras K,Tavernarakis N.Mitophagy in neurodegeneration and aging[J].Front Genet,2012,3:297.
[7]DiMauro S,Schon EA.Mitochondrial disorders in the nervous system [J].Annu Rev Neurosci,2008,31:91-123.
[8]Chan DC.Mitochondria:dynamic organelles in disease,aging,and development[J].Cell,2006,125(7):1241-1252.
[9]Taylor R,Goldman SJ.Mitophagy and disease:new avenues for pharmacological intervention[J].Curr Pharm Des,2011,17(20):2056-2073.
[10]Sowter HM,Ratcliffe PJ,Watson P,et al.HIF-1-dependent regulation of hypoxic induction of the cell death factors BNIP3and NIX in human tumors[J].Cancer Res,2001,61(18):6669-6673.
[11]Bursch W,Karwan A,Mayer M,et al.Cell death and autophagy:cytokines,drugs,and nutritional factors [J].Toxicology,2008,254(3):147-157.
[12]Kitamura N,Nakamura Y,Miyamoto Y,et al.Mieap,ap53-Inducible protein,controls mitochondrial quality by repairing or eliminating unhealthy mitochondria[J].PLoS One,2011,6(1):e16060.
[13]Zhang J,Ney PA.Mechanisms and biology of B-cell leukemia/lymphoma 2/adenovirus E1Binteracting protein 3and Niplike protein x [J].Antioxidants Redox Signaling,2011,14(10):1959-1965.
[14]Redmann M,Dodson M,Boyer-Guittaut M,et al.Mitophagy mechanisms and role in human diseases[J].Int J Biochem Cell Biol,2014,53:127-133.
[15]Nakamura Y,Kitamura N,Shinogi D,et al.BNIP3and NIX mediate mieap-induced accumulation of lysosomal proteins within mitochondria[J].PLoS One,2012,7(1):30767.
[16]Diwan A,Wansapura J,Syed FM,et al.Nix-mediated apoptosis links myocardial fibrosis,cardiac remodeling,and hypertrophy decompensation[J].Circulation,2008,117(3):396-404.
[17]Wilhelm M,Xu ZH,Kukekov NV,et al.Proapoptotic nix activates the JNK pathway by interacting with POSH and mediates death in a Parkinson disease model [J].J Biol Chem,2007,282(2):1288-1295.
