不同抽吸模式下烟气冷凝物对人口腔细胞体外生长增殖的影响
2015-12-06范子彦李中皓刘珊珊张洪非边照阳唐纲岭
范子彦,翟 妞,李中皓,杨 飞,刘珊珊,张洪非,边照阳,唐纲岭*
1.国家烟草质量监督检验中心,郑州高新技术产业开发区枫杨街2号 450001
2.国家烟草基因研究中心,郑州高新技术产业开发区枫杨街2号 450001
不同抽吸模式下烟气冷凝物对人口腔细胞体外生长增殖的影响
范子彦1,翟 妞2,李中皓1,杨 飞1,刘珊珊1,张洪非1,边照阳1,唐纲岭*1
1.国家烟草质量监督检验中心,郑州高新技术产业开发区枫杨街2号 450001
2.国家烟草基因研究中心,郑州高新技术产业开发区枫杨街2号 450001
为考察卷烟烟气暴露对人口腔细胞体外生长增殖的影响,以肯塔基参比卷烟3R4F为试验卷烟,人口腔表皮样癌细胞为实验模型,分别在ISO和加拿大深度抽吸(HCI)模式下制备烟气冷凝物并对细胞进行染毒暴露,评估了两种抽吸模式下烟气暴露对人口腔细胞代谢活性及核酸复制活性的影响,并结合主流烟气总粒相物(TPM)中主要有害成分的释放水平进行了分析。结果表明:①烟气冷凝物暴露对人口腔细胞体外增殖有抑制作用,对人口腔细胞代谢活性以及核酸的复制活性有一定的毒性作用。②HCI抽吸模式下3R4F卷烟单位TPM和单位烟碱中有害成分的释放量低于ISO模式,HCI抽吸模式下制备的烟气冷凝物含水率高于ISO模式,这两种因素是导致3R4F卷烟HCI模式下烟气冷凝物细胞毒性弱于ISO模式的主要原因。
人口腔细胞;烟气冷凝物;细胞增殖毒性;抽吸模式;3R4F
流行病学研究表明口腔疾病的发生与吸烟有一定的相关性,发病过程涉及基因损伤、蛋白异常表达、氧化应激、炎症反应等多个生物效应的参与,但具体的致病机制尚未阐明[1-3]。为了阐明致病机制,基于烟气冷凝物的体外毒理学实验方法已被建立并广泛应用于卷烟烟气介导的口腔毒理学研究。目前的烟气冷凝物的制备主要是在国际标准 ISO 4387:2000[4]中所规定的吸烟机参数条件下进行。随着全球控烟运动的不断高涨,特别是在《烟草控制框架公约》[5]正式生效以来,以世界卫生组织为代表的控烟机构对ISO抽吸模式提出了质疑,认为ISO抽吸模式下卷烟烟气释放量不能真实反映人体实际摄取量,并推荐了加拿大深度抽吸(HCI)模式[6]。据文献报道,在这两种卷烟抽吸模式下,卷烟主流烟气中的焦油、烟碱、烟草特有亚硝胺等的释放量存在差异[7-9],这在一定程度上表明不同抽吸模式下制备的烟气冷凝物对口腔细胞的毒性存在潜在差异。另一方面,开展常规的烟气毒理学测试研究是使用动物细胞模型,比如中国仓鼠卵巢细胞CHO等,获得的实验结果能否外推至人体还存在一定的争议[10-12]。因此,在ISO和HCI抽吸模式下分别制备卷烟主流烟气冷凝物,采用不同暴露浓度(质量浓度)对人体口腔细胞进行体外染毒暴露,评估不同抽吸模式对人口腔细胞体外生长增殖的毒性作用,旨在为吸烟与口腔疾病的关系研究提供参考。
1 材料与方法
1.1 材料、试剂和仪器
肯塔基参比卷烟3R4F(美国肯塔基大学);人口腔表皮样癌KB细胞(中国科学院上海生科院细胞资源中心)。α-MEM培养基、灭菌PBS(美国Gibco公司);胎牛血清(北京四季青公司);胰酶、二甲基亚砜(生物纯,DMSO,美国Amresco公司);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(噻唑蓝,MTT)染色试剂(美国Introvigen公司);5-溴脱氧尿嘧啶核苷(5-Bromo-2-deoxyuridine,BrdU)掺入实验试剂盒(美国Roche公司)。
CP2245电子分析天平(感量:0.000 1 g,德国Satorious公司);Thermo Scientific Series 8000型CO2细胞培养箱、Forma 900超低温冰箱、超净工作台(美国Thermo公司);细胞培养瓶、96微孔板(美国Corning Costar公司);DMI 4000B倒置荧光显微镜(德国Leica公司);Spextra Max M5酶标仪(美国Molecular Devices公司);RM20H转盘型吸烟机(德国Borgwaldt KC公司);空气浴摇床(上海智城公司);Milli-Q超纯水纯化系统(美国Millipore公司)。
1.2 方法
1.2.1 实验方案的设计
将卷烟样品于(22±1)℃和相对湿度(60±3)%条件下平衡48 h。用RM20H转盘型吸烟机在ISO和HCI两种抽吸模式下分别抽吸卷烟并制备烟气冷凝物。设计不同的烟气冷凝物浓度对口腔细胞进行24 h染毒实验,用MTT和BrdU核酸掺入试验分别对细胞中线粒体的代谢活性和核酸复制活性进行考察,评估烟气冷凝物对人口腔细胞体外生长增殖的影响,实验方案如图1所示。
1.2.2 不同抽吸模式下烟气冷凝物的制备
按照 GB/T 5606.1—2004[13]抽取卷烟样品,并用RM20H转盘型吸烟机在ISO和HCI两种抽吸条件下分别抽吸,用92 mm剑桥滤片收集烟气总粒相物TPM,根据TPM的质量加入相应体积的DMSO,制得最终浓度为10 mg/mL的TPM储备液[14]。
1.2.3 细胞培养及处理
将人口腔表皮样癌KB细胞置于含10%胎牛血清的a-MEM完全培养基中,在37℃、5%CO2条件下培养。当细胞汇合率为70%~80%时,用胰酶消解,培养基重悬制成单细胞悬液,调节细胞浓度至4×104个/mL,按每孔100µL接种到96孔板,过夜培养。当传代细胞至对数生长期时,弃去培养基,加入100µL不同浓度梯度的烟气冷凝物对细胞进行染毒,同时根据不同浓度梯度烟气冷凝物中DMSO的体积分数设计空白对照组。
1.2.4 MTT试验
称取0.5 g MTT,溶于100 mL 50 mmol/L的磷酸盐缓冲液(PBS,pH 7.4)中,用0.22µm水相滤膜过滤除去溶液中的细菌,制成5 mg/mL MTT溶液。细胞染毒24 h后,每孔加入20µL MTT溶液,在37℃、5%CO2条件下继续培养4 h,弃去培养基。每孔加入150µL DMSO,振荡10 min,使结晶充分溶解,在490 nm波长下测量每孔吸光值。1.2.5 BrdU掺入试验
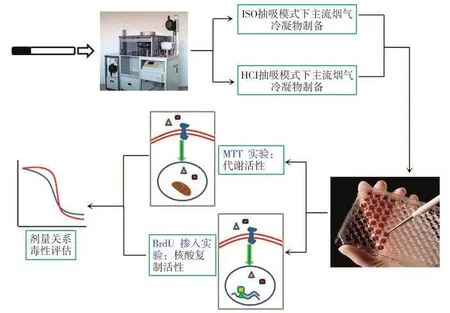
图1 实验方案
细胞染毒24 h后,每孔添加BrdU标记溶液10 µL,在37 ℃、5%CO2条件下继续培养2 h,弃去培养基。用甲醇/醋酸固定细胞10 min,再用甲酰胺处理细胞,使细胞内的核酸变性。用200µL PBS清洗细胞3次,每孔加入100µL辣根过氧化物酶标记的BrdU抗体。用PBS清洗细胞后,每孔加入100µL底物,在370 nm波长下测量每孔的吸光值。
2 结果与分析
2.1 不同抽吸模式下烟气冷凝物对人口腔细胞的增殖活性的影响
2.1.1 对细胞代谢活性的影响
烟气毒理学评估中常用的细胞有中国仓鼠卵巢细胞(CHO细胞),小鼠肺泡巨噬细胞(AM细胞)等[15],由于将动物细胞研究结果外推至人体存在一定的争议,因而人支气管上皮细胞(BEP2D细胞)被引入烟气毒理学测试[16]。但人支气管上皮细胞是肺部细胞,在功能上与口腔细胞存在一定的差异。因此,在本研究中,以人口腔表皮样癌KB细胞为模型细胞[17],分别用ISO和HCI抽吸模式下制备的烟气冷凝物对人口腔细胞进行染毒,并使用MTT观察烟气冷凝物对细胞代谢活性的影响。MTT是一种荧光染料,它在活细胞线粒体中琥珀酸脱氢酶的作用下,还原成水不溶的蓝紫色结晶甲瓒(Formazan),并沉积在细胞中,它能够准确反映细胞中线粒体的代谢活性。MTT试验结果(图2)显示,细胞用ISO和HCI模式下制备的烟气冷凝物分别染毒后,甲瓒的荧光强度随着烟气冷凝物浓度的升高而逐渐降低,表明口腔细胞内线粒体的代谢活性受到了抑制,不能将MTT染料还原成甲瓒。对比图2中人口腔细胞的代谢活性抑制曲线还可以发现,ISO模式下细胞的代谢活性降低速率大于HCI模式。采用t检验对图2中ISO和HCI模式下各暴露浓度点进行统计学分析,结果表明,空白实验以及40和300 mg/L烟气冷凝物暴露浓度下,两种抽吸模式下的MTT试验结果没有显著性差异,其他暴露浓度下均存在显著性差异。以80和160 mg/L为例,p值分别为0.002和0.03,其他系列浓度下的p值也均小于0.05。可见,在单位TPM浓度下,ISO模式的口腔细胞代谢毒性要大于HCI模式。

图2 烟气冷凝物对口腔细胞代谢活性的影响(n=3)
2.1.2 对核酸复制活性的影响
传统的遗传毒性评估主要是采用细菌回复突变试验、小鼠微核试验、人细胞程序外DNA合成试验等,前两种方法中分别使用细菌和动物细胞模型进行评估,人细胞程序外DNA合成试验则直接反映外源物刺激对人细胞核酸复制的影响[18]。因此,为了直接评估烟气冷凝物对人口腔细胞核酸复制的影响,同时为后续的口腔细胞转录组实验寻找合适的暴露浓度[19],采用BrdU核酸掺入试验考察了烟气冷凝物的口腔细胞遗传毒性。BrdU是DNA前体胸腺嘧啶核苷类似物,通过竞争掺入S期细胞单链DNA核苷酸序列替代胸腺嘧啶和检测细胞内核酸的BrdU掺入情况,可以直接评估细胞内的核酸复制活性,也能间接反映烟气冷凝物对人口腔细胞的遗传毒性。从图3中可以看出,与MTT试验结果类似,ISO抽吸模式下制备的烟气冷凝物对人口腔细胞核酸复制活性的抑制作用要大于HCI模式,表明ISO模式下的烟气冷凝物对人口腔细胞有较高的潜在遗传毒性。对图3中各暴露浓度点进行统计学分析,结果表明,在空白实验和最大暴露浓度下,两种抽吸模式烟气冷凝物的BrdU试验结果没有显著性差异,其他暴露浓度下均存在显著性差异。以80和160 mg/L为例,p值分别是0.004和0.02,其他系列浓度下的p值也均小于0.05。
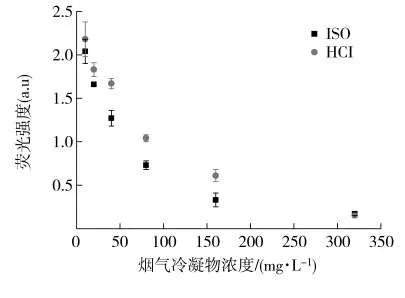
图3 烟气冷凝物对口腔细胞核酸复制活性的影响(n=3)
2.1.3DMSO对MTT和BrdU试验的影响
在烟气冷凝物制备过程中,以DMSO为TPM的萃取溶剂。为了评估DMSO在整个实验过程中的毒理效应贡献,根据烟气冷凝物的用量,计算出细胞染毒时DMSO的量,并对细胞进行单独的DMSO暴露。结果(图4)显示,当DMSO的体积分数低于2%时,不会对人口腔细胞产生强毒性作用。可见,MTT和BrdU试验中细胞毒性主要是由烟气冷凝物暴露所致。
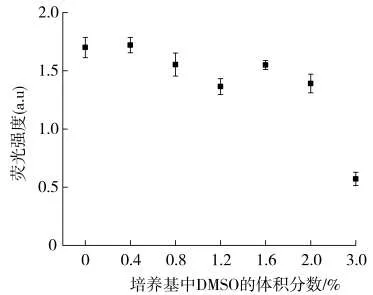
图4 DMSO暴露对口腔细胞毒性的影响(n=3)
2.2 不同抽吸模式下烟气中有害成分释放量的差异分析
烟气冷凝物的细胞毒性主要由烟气中的有害成分导致,据文献[8,20-21]报道,不同抽吸模式下,烟气中有害成分的释放量存在差异,这些差异可能是对口腔细胞的毒性造成差异的原因。因此,对肯塔基参比卷烟3R4F烟气中主要有害成分的释放量进行了定量分析,得到了单位TPM和单位烟碱有害成分释放量(表1)。将表1中几种有害成分的单位TPM和烟碱释放量进行归一化处理,得到两种抽吸模式下3R4F烟气中粒相物主要有害成分的释放量比值(图5)。由图5可知,几种有害成分的HCI/ISO比值均小于1,说明尽管HCI模式下每支卷烟烟气粒相物中主要有害成分的释放量大于ISO模式,但是单位TPM或单位烟碱有害成分释放量则相反,从而导致MTT和BrdU试验中HCI模式下烟气冷凝物的细胞毒性弱于ISO模式。
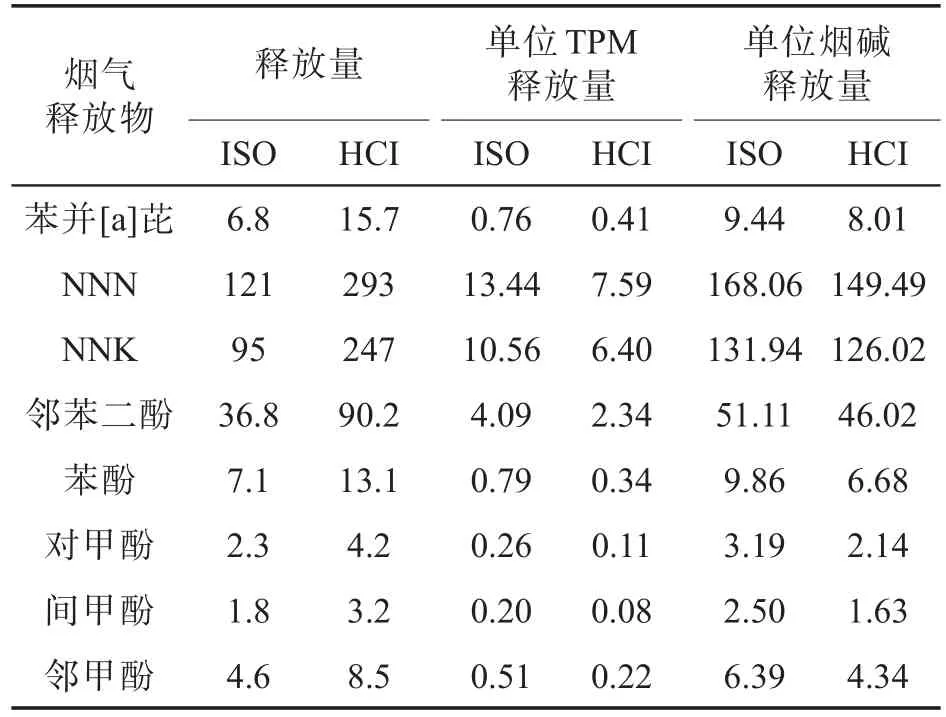
表1 3R4F烟气粒相物中主要有害成分释放量①
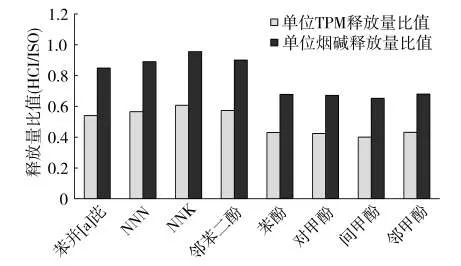
图5 两种抽吸模式下3R4F烟气中粒相物主要有害成分的释放量比值(HCI/ISO)
2.3 不同抽吸模式下烟气含水率差异分析
采用CORESTA推荐的方法检测了两种抽吸模式下3R4F卷烟主流烟气水分,其中ISO模式下烟气水分为134µg/mg TPM,而HCI模式下的烟气水分为425µg/mg TPM,表明在HCI抽吸模式下,烟气含水率大幅升高,稀释了烟气中的有害成分。另一方面,烟气中单位烟碱有害成分释放量扣除了水分的影响。图5表明,在HCI模式下,单位烟碱有害成分释放量较ISO模式下也有所降低,这可能是因为HCI模式下卷烟得到了充分燃烧所致。可见,对于肯塔基参比卷烟3R4F,HCI模式下烟气冷凝物的细胞毒性低于ISO模式是由水分释放量增加以及单位TPM、单位烟碱有害成分释放量降低共同导致。
3 结论与讨论
以3R4F为试验卷烟,分别在ISO和HCI抽吸模式下制备烟气冷凝物,以人口腔表皮样癌细胞为实验模型,使用烟气冷凝物对细胞进行染毒暴露,评估了不同抽吸模式下烟气冷凝物对人口腔细胞体外生长增殖的毒性作用。烟气冷凝物暴露对人口腔细胞体外生长增殖具有抑制作用,对人口腔细胞的线粒体的代谢活性以及核酸的复制活性具有一定的毒性作用。烟气冷凝物对细胞代谢活性和核酸复制活性的影响可能会导致细胞内疾病相关基因的差异表达,而相关的调控通路上关键蛋白因子受基因调控也会差异表达,并最终产生一定的生理效应,这将为后续的基因和蛋白水平的研究提供线索。
对主流烟气粒相物有害成分释放水平的进一步研究表明,HCI模式下3R4F卷烟单位TPM和单位烟碱有害成分释放量低于ISO模式,这与Roemer等[22]的研究结果相一致。另一方面,HCI抽吸模式制备的烟气冷凝物含水率高于ISO模式。因此,上述两个因素是导致3R4F卷烟烟气冷凝物HCI模式下烟气冷凝物细胞毒性弱于ISO模式的主要原因。值得注意的是,在HCI模式下,单支卷烟的有害成分释放量大于ISO模式,对生物体存在较高的安全风险。然而,目前的体外毒理学评价是基于单位TPM的方式,这不能有效反映单支卷烟不同抽吸模式下有害成分释放物对生物体的影响,因此,为了更有效、真实地反映烟气暴露的生物效应,基于卷烟全烟气暴露的烟气毒理学评估方法今后将得到更多的关注。
[1] Rodriguez T,Altieri A,Chatenoud L,et al.Risk factors for oral and pharyngeal cancer in young adults[J].Oral Oncology,2004,40(2):207-213.
[2] Jorgensen E D,Dozmorov I,Frank M B,et al.Global gene expression analysis of human bronchial epithelial cells treated with tobacco condensates[J].Cell Cycle,2004,3(9):1152-1166.
[3] Fields W R,Leonard R M,Odom P S,et al.Gene expression in normal human bronchial epithelial(NHBE)cells following in vitro exposure to cigarette smoke condensate[J].Toxicology Science,2005,86(1):84-91.
[4] ISO 4387:2000 Cigarettes—Determination of total and nicotine free dry particulate matter using a routine analytical smoking machine[S].
[5] World Health Organization. WHO Framework Convention on Tobacco Control[R/OL].[2014-10-24].http://www.who.int/fctc/text_download/en/.
[6] Hammond D,Wiebel F,Kozlowski L T,et al.Revising the machine smoking regime for cigarette emissions:implicationsfortobacco controlpolicy[J].Tobacco Control,2007,16(1):8-14.
[7] Moir D,Rickert W S,Levasseur G,et al.A comparison of mainstream and sidestream marijuana and tobacco cigarette smoke produced under two machine smoking conditions[J].Chemical Research Toxicology,2007,21(2):494-502.
[8] Hammond D,O’Connor R.Constituents in tobacco and smoke emissions from Canadian cigarettes[J].Tobacco Control,2008,17(Suppl 1):i24-i31.
[9] 李中皓,唐纲岭,张洪非,等.两种抽吸模式下卷烟主流烟气中主要酚类的释放量比较[J].烟草科技,2010(10):27-33.
[10]李翔,聂聪,尚平平,等.采用全烟气暴露系统测试卷烟主流烟气细胞毒性[J].烟草科技,2012(5):44-47.
[11]卢斌斌,周骏,朱忠.不同焦油释放量卷烟烟气的细胞毒性和基因毒性研究[J].中国烟草学报,2010,16(增刊):66-69.
[12]Putnam K,Bombick D,Doolittle D.Evaluation of eight in vitro assays for assessing the cytotoxicity of cigarette smoke condensate[J].Toxicology in Vitro,2002,16(5):599-607.
[13]GB/T 5606.1—2004 卷烟第1部分:抽样[S].
[14]Health Canada Official Method T-501:2004 Bacterial reverse mutation assay for mainstream tobacco smoke[S].
[15]Agarwal A,Saleh R A,Bedaiwy M A.Role of reactive oxygen species in the pathophysiology ofhuman reproduction[J].Fertility and Sterility,2003,79(4):829-843.
[16]Binderup M L,Pedersen G A,Vinggaard A,et al.Toxicity testing and chemicalanalysesofrecycled fibre-based paper for food contact[J].Food Additives&Contaminants 2002,19(S1):13-28.
[17]Chang K W,Chang C S,Chou M J,et al.High prevalence of human papillomavirus infection and possible association with betelquid chewing and smoking in oral epidermoid carcinomas in Taiwan[J].Journal of Medical Virology 1989,28(1):57-61.
[18]Serrano G L,Montero M R.Micronuclei and chromatid buds are the result of related genotoxic events[J].Environmental and Molecular Mutagenesis 2001,38(1):38-45.
[19]Schembri F,Sridhar S,Perdomo C,et al.MicroRNAs as modulators of smoking-induced gene expression changes in human airway epithelium[J].Proceedings of the National Academy of Sciences 2009,106(7):2319-2324.
[20]Burns D,Dybing E,Gray N,et al.Mandated lowering of toxicants in cigarette smoke:a description of the World Health Organization TobReg proposal[J].Tobacco Control,2008,17(2):132-141.
[21]Wu J,Joza P,Sharifi M,et al.Quantitative method for the analysis of tobacco-specific nitrosamines in cigarette tobacco and mainstream cigarette smoke by use of isotope dilution liquid chromatography tandem mass spectrometry[J].Analytical Chemistry,2008,80(4):1341-1345.
[22]RoemerE,Carchman R.Limitations of cigarette machine smoking regimens[J].Toxicology Letter,2011,203(1):20-27.
Effects of Cigarette Smoke Condensate Collected Under Different Smoking Regimes on in vitro Proliferation of Human Oral Cell
FAN Ziyan1,ZHAI Niu2,LI Zhonghao1,YANG Fei1,LIU Shanshan1,ZHANG Hongfei1,BIAN Zhaoyang1,and TANG Gangling*1
1.China National Tobacco Quality Supervision and Test Center,Zhengzhou 450001,China
2.China National Tobacco Gene Research Center,Zhengzhou 450001,China
In order to investigate the effects of exposure to cigarette smoke on the in vitro proliferation of human oral cell,Kentucky 3R4F reference cigarette was used as experimental cigarette and human oral epidermoid carcinoma cell line KB as experimental model.Cigarette smoke condensates(CSCs)were collected under ISO and Health Canada Intense(HCI)smoking regimes for the exposure assessment of human oral cells,the effects of CSCs on the metabolic activity and nucleic acid replication activity of the cells were assessed,and further analyzed versus the release levels of main harmful components in total particulate matter(TPM)of mainstream cigarette smoke.The results indicated that:1)CSCs exposure inhibited the in vitro proliferation of oral cells and imparted certain toxicity to their metabolic activity andnucleic acid replication activity.2)Under HCI smoking regime,the release of harmful components per unit TPM and per unit nicotine in mainstream smoke of 3R4F reference cigarette was lower and the moisture content in CSCs was higher than those under ISO regime;these two factors explained the lower cytotoxicity of HCI regime CSCs.
Human oral cell;Cigarette smoke condensate;Cell proliferation toxicity;Smoking regime;3R4F
TS416
A
1002-0861(2015)12-0048-06
10.16135/j.issn1002-0861.20151208
2014-12-24
2015-08-12
中国烟草总公司科技重点项目“国内外卷烟主要有害成分释放量中位值及其影响因素研究”(562014AA0020);中国烟草总公司郑州烟草研究院院长基金项目“烟气暴露介导的口腔原代细胞miRNA表达谱及其靶基因的筛选与鉴定”(512013CA0120)。
范子彦(1983—),博士,工程师,主要从事烟草化学检验和烟气毒理学研究。E-mail:fanzy@ztri.com.cn;*
唐纲岭,E-mail:tglcttc@163.com
范子彦,翟妞,李中皓,等.不同抽吸模式下烟气冷凝物对人口腔细胞体外生长增殖的影响[J].烟草科技,2015,48(12):48-53.FAN Ziyan,ZHAI Niu,LI Zhonghao,et al.Effects of cigarette smoke condensate collected under different smoking regimes on in vitro proliferation of human oral cell[J].Tobacco Science&Technology,2015,48(12):48-53.
责任编辑 洪广峰
