聚乙烯醇绿色还原法制备银纳米粒子的研究
2015-12-05袁新松齐春霞
陈 琛,袁新松,齐春霞
(合肥师范学院 化学与化学工程学院 安徽 合肥 230601)
1 引言
纳米材料由于具有不同于其它块状材料的表面效应、量子尺寸效应、小尺寸效应和宏观量子隧道效应等,而在电磁学、光学、材料学等领域都有广泛的应用,已成为人们的研究热点[1]。其中,银纳米粒子由于具有特殊的物理化学性质,该特殊性充分表现在分子电子、免疫分析、传感器研制等方面[2,3],因此越来越受到人们的重视。如在热交换器中,银纳米粒子作为稀释制冷机的原料可以使机器的效率提高百分之三十左右;在化纤中掺杂少许纳米银也可以改善化纤品的一些功效,包括杀菌能力的提高[4];工业上,催化剂的使用,最好的原料就是银纳米粒子;同时,提高灵敏表面增强效果最好的衬底材料之一就是纳米银粒子[5]。
目前报道的制备银纳米粒子的方法有很多,如电化学合成法、光化学法、辐射还原法、物理气相法、化学还原法等[6,7]。林峰等[8]在以二丁酸二异辛酯磺酸钠为表面活性剂、异辛烷为油相形成的 W/O型微乳体系中,以AgNO3为银源、抗坏血酸为还原剂,制备了大小为10nm左右,单分散性好的均匀球状纳米银溶胶。但是上述有些方法存在反应时间较长、实验的条件控制不容易等缺点;有些方法制备出的银纳米粒子稳定性较差,制备条件较苛刻,不易控制;有些反应采用的原料或稳定剂都是一些有毒或者价钱昂贵的有机物,因此研究一种简单、绿色的方法来合成纳米银粒子是非常有意义的。
在所有制备银纳米粒子的方法中,微波法也是一种重要的方法。通常波长在100cm至1cm范围内的电磁波即为微波,其频率大概在300MHz-300GHz,它的波长是在电磁波谱的红外辐射与射频段之间。微波可以与化学体系直接发生作用,促进各类化学反应的进行。某些特定的气体会因为它们的转动能级的能量和某些相对应的特定频率微波的量子能量相应而吸收所对应的特定频率的微波。目前微波在化学领域中的应用主要涉及两个方面:一是利用微波加快化学反应速度,即微波热效应;二是化学反应中的机制被微波所改变,从而所得到的化学产物含有独特的性质。微波法作为一种合成纳米材料技术,应用于纳米银的制备上,具有很多的优点,包括加热均匀、污染少、易于成核[9],制备出的纳米材料纯度高、分布均匀,且此方法操作方便、反应迅速、效率较高,受到各国化学工作者的喜爱。而淀粉是一种来源非常广泛的聚合物,含有丰富的羟基,且该物质绿色、无毒、可再生,在绿色化学上的应用较广泛。因此,本实验采用微波合成法,以聚乙烯醇为还原剂,淀粉为稳定剂,制备出银纳米粒子。改变反应时间、反应温度、仪器功率等条件研究银纳米粒子的吸收光谱,得出最佳反应条件。并对最优条件下制备的银纳米粒子进行紫外(Uv-vis)、透射电镜(TEM)表征,研究其性质和形貌。
2 实验部分
2.1 试剂与仪器
淀粉(分析纯,西陇化工股份有限公司);硫酸银(分析纯,上海中博化工有限公司);聚乙烯醇(PVA,分析纯,平均聚合度为1750±50,上海山谱有限公司)。
JRY-MH微波合成仪(湖南金蓉园仪器设备有限公司),JEOL TEM-100SX型透射电镜(日本电子公司,加速电压80kV),U251紫外-可见光分光光度计(日本岛津公司)。
2.2 实验方法
2.2.1 储备液的配制
称取一定量的硫酸银,配制1.0×10-3mol·L-1硫酸银溶液;再称取25g的平均聚合度为1750的聚乙烯醇(PVA)在500ml的水溶液中加热溶解,配制出50g·L-1的PVA水溶液;称取2.0g的淀粉在热水中溶解,配制20g·L-1的淀粉溶液。以上溶液在密闭条件下储存,作为储备液备用。
2.2.2 反应液的配制
准确移取1×10-3mol·L-1Ag2SO4溶液2ml,50g·L-1的PVA-1750溶液30ml和20g·L-1淀粉水溶液18ml置于50ml的容量瓶中,稀释至刻度,使其混合均匀。
2.2.3 纳米银粒子的制备
移取上述反应液5ml置于10ml的微波反应器中,参数设定为功率为50W,温度为130℃,反应时间设为275s,让其在此条件下反应。将反应后的溶液移取至10ml的比色管中,置于暗处。
2.2.4 紫外表征
将反应后的溶液先稀释50倍,取4ml于石英比色皿中,置于紫外-可见分光光度计中,在350-600nm范围内扫描其紫外可见吸收光谱。
2.2.5 透射电镜表征
取一部分溶液进行离心、分离、洗涤,再滴在碳膜涂层的铜网上,干燥后进行TEM表征。
3 结果与讨论
3.1 反应机理
聚乙烯醇(PVA)是长链聚合物,分子链之间的羟基很容易形成分子间的氢键(如图1所示),所谓的活性PVA指的是没有形成氢键的羟基,所以在常温下PVA的活性氢很少,所以其还原性很差,与Ag2SO4的反应就会很慢。而聚乙烯醇在微波法下可以还原银离子是因为在微波合成仪中,由于微波的辐射提供很高的瞬时能量破坏聚乙烯醇的链间的氢键,获得大量的活性游离聚乙烯醇分子,出现大量的活性氢键。同时,高能量也使得化学键产生断裂,聚乙烯醇分子端的羟基就会失去一个H原子,形成C=O键,而游离的H原子使溶液中的银离子还原成银原子,大量的银原子堆积就形成了银纳米粒子,反应方程式如式(1)、(2)所示。而淀粉含有丰富的羟基,能与金属银粒子配位,使用淀粉作为稳定剂,能使金属表面“钝化”得到稳定性高的金属银纳米粒子。

图1 PVA分子链间形成的氢键示意图
反应方程式:

3.2 反应温度的影响
在功率、合成时间等条件一致的情况下,我们考察了反应温度对制备纳米银粒子的影响,图2为功率是60W,反应时间是200s,不同温度下制备出的纳米银的紫外-可见光谱图(a:120℃;b:130℃;c:140℃)。可以看出,不同温度下制备得到的粒子都在400—425nm范围内出现最大吸收峰,此时吸光度最强。相比较可以得出在温度为130℃时,溶液的吸光度最大。a曲线和b曲线相比较,一开始反应温度的增大会加快反应速度,生成的银纳米粒子会相应的增多,溶液的吸光度是增大的,所以相同波长下,b曲线对应的吸光度大于a曲线。而b曲线与c曲线比较,在130℃之后,温度过高,纳米银大量聚集成大颗粒而沉淀,同时由于聚乙烯醇本身的粘性很大,温度过高使其溶液粘度更大,会夹带些银纳米粒子附于容器壁面使溶液中的纳米银粒子减少,导致吸光度下降,所以相同波长下,b曲线对应的吸光度大于c曲线。实验得出制备银纳米粒子的最佳反应温度为130℃。

图2 功率是60W,反应时间是200s,不同温度下制备出的纳米银的紫外-可见光谱图(a:120℃;b:130℃;c:140℃)
3.3 合成时间的影响
在温度、功率、浓度等条件一致的情况下,考察不同反应时间对制备纳米银的影响,图3为温度是130℃,功率为60W,波长为410nm处的纳米银的吸光度-时间曲线。可以看出,在反应时间在175s之前溶液的吸光度很低,表明在此之前基本不生成银纳米粒子或反应液基本不反应。但在175s后,随着时间的推移,溶液的吸光度逐渐增大,光强增大,表明生成的银纳米粒子数目增多。在275s时出现最大吸收峰,之后吸光度开始减小。因为一开始是反应刚发生,随着辐射时间逐渐增长,反应条件中压力和温度都得到相应的增大,因而反应速度增快,溶液中的银离子被还原成银单质,堆积成银纳米粒子,溶液中的吸光度就逐渐增大。到一定程度,银离子基本被反应完全,之后辐射继续进行,所生成的纳米银粒子增多并相互聚集而出现大颗粒沉淀或吸附在器壁表面,使得残留在溶液里的纳米银粒子数目减少,吸光度就相对应的开始减小。所以,在温度、压强、仪器功率等实验条件基本一致的情况下,最佳反应时间为275s。
3.4 仪器功率的影响

图3 温度是130℃,功率为60W,波长为410nm处的纳米银的吸光度-时间曲线
在合成时间、反应温度等条件一致的情况下,考察仪器功率对制备纳米银粒子的影响,图4为温度是130℃,合成时间是275s,波长为410nm处的纳米银的吸光度-功率曲线。可以看出,在功率为50W时纳米银粒子的紫外可见光强度最大,在50W—90W之间溶液的吸光度有所下降,在90W—110W之间的吸收不明显,在110W后吸光度开始急剧减小。因为一开始在低功率下,功率的增大使得反应的温度和压强也相应的增大,反应速度有所增大,生成的纳米银粒子数目也会相应的增多,因而吸光度会有所提高。而在50W后由于所对应的反应温度增大,速度较快,生成的银纳米粒子有可能少量的聚集成大颗粒状沉淀,但此时沉淀不明显,溶液吸光度波动很小。在50W至110W之间,沉淀的速度有可能跟纳米银粒子生成的速度相持平,所表现出来的是吸光度基本不变。在功率显示是110W以后,温度会超过130℃,温度过高,反应速度过快,很可能会使大量的纳米银粒子相互碰撞产生聚沉,其速度远远超过了银纳米粒子的生成速度,或最后银离子反应完全基本不生成银纳米粒子,导致溶液中的纳米银粒子数目减少,所得出曲线的吸光度会出现急剧下降。因此实验所得出制备纳米银最佳的仪器功率是50W。

图4 温度是130℃,合成时间是275s,波长为410nm处的纳米银的吸光度-功率曲线
3.5 最佳条件下制得纳米银的Uv-vis表征
综上可知,制备银纳米粒子的最佳条件是:反应温度为130℃,合成时间是275s,微波仪器功率为50W。图5为最佳条件下制备的纳米银胶体溶液的紫外-可见光谱图。由图可见,该最佳条件下制备的溶液的紫外-可见光谱在412nm处的吸光强度最大,此处存在最大吸收峰,此为纳米银粒子的吸收峰,与文献[11]所述的基本一致。说明溶液中存在了银纳米粒子。

图5 最佳条件下制备的银纳米粒子的紫外-可见光谱图
3.6 TEM 表征
图6为在最优条件下:温度为130℃,反应时间为275s,功率为50W制备出的银纳米粒子的TEM图,可以看出纳米银主要是以粒子形态出现,粒子的外形为球形,较为规则,且结构较均一。其分散性粒径数据如图7所示,可以看出银纳米粒子平均粒径为12nm,且分布比较均匀。

图6 最优条件下:温度为130℃ ,反应时间为275s,功率为50W制备出的银纳米粒子的TEM图
4 结论
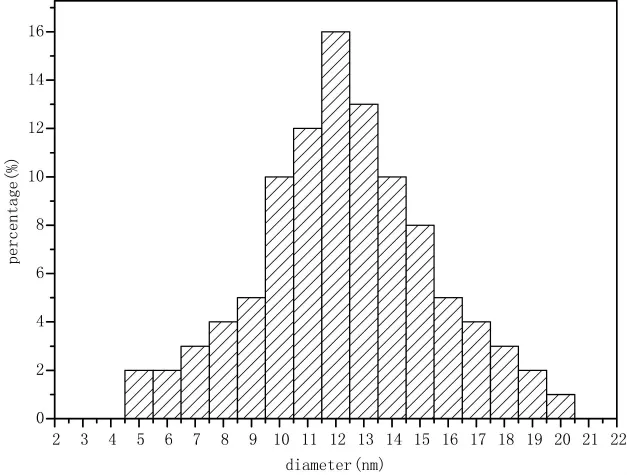
图7 银纳米粒子粒径分布柱状图
本实验采用微波合成法,以聚乙烯醇作为还原剂,淀粉作为稳定剂,制备出黄色的银纳米粒子,并通过改变反应时间、反应温度、仪器功率等制备条件,研究出其最佳反应条件为:温度在130℃,仪器功率为50W,反应时间为275s。对在最佳反应条件下制备的纳米银粒子进行紫外、TEM表征,结果表明:纳米银粒子在波长为412nm处出现最大吸收峰,纳米银粒子呈球形、分布较均匀,平均粒径为12nm。本实验用一种绿色的还原法制备银纳米粒子,反应过程无污染,操作简单,所制备的银纳米粒子分布均匀、粒径较小,是一种较好的制备金属纳米粒子的方法,该方法对纳米材料的合成有着重要的促进意义。
[1]凌邵明.银纳米粒子的绿色合成及其光谱特性[J].化学世界,2010,6:44-47.
[2]Liu J,Hurt R H.Ion Release Kinetics and Particle Persistence in Aqueous Nano-Silver Colloids[J].Environ.Sci.Technol.,2010,44(6):2169-2175.
[3]Moghaddam J,Kolahgar-Azari S,Karimi S.Determination of Optimum Conditions for Nano-Silver Preparation from AgCl Based on the Taguchi Design by the Use of Optical Properties of Silver [J].Ind.Eng.Chem.Res.,2012,51 (8):3224-3228.
[4]陈水挟,罗颖,曲振平,等.银型抗菌活性炭纤维的结构及其抗菌性能的研究[J].材料科学与工程,2001,19(4):66-79.
[5]凌邵明,蒋治良,闭献树,等.光谱学与光谱分析[J].2001,21(6):819-821.
[6]ŠiškováK,VlˇckováB,Turpin P Y,et al.Laser Ablation of Silver in Aqueous Solutions of Organic Species:Probing Ag Nanoparticle-Adsorbate Systems Evolution by Surface-Enhanced Raman and Surface Plasmon Extinction Spectra[J].J.Phys.Chem.C,2011,115(13):5404-5412.
[7]Lin L,Shang K,Xu X,et al.Formation of Ag Nanoparticle-Doped Foam-like Polymer Films at the Liquid– Liquid Interface [J].J.Phys.Chem.B,2011,115 (38):11113-11118.
[8]林峰,苏伟,许利剑,等.纳米银粒子在微乳液中的制备及其抗菌性能[J].包装学报,2010,2(1):28-32.
[9]金钦汉.微波化学[M].科学出版社,1999:32.
[10]Akaighe N,MacCuspie R I,Navarro D A,et al.Humic Acid-Induced Silver Nanoparticle Formation Under Environ-mentally Relevant Conditions[J].Environ.Sci.Technol.,2011,45(9):3895–3901.
[11]陈琛,姚成立,袁新松等.维生素E绿色还原法制备银纳米粒子的研究[J].分析测试学报,2013,32(11):61-66.
