利用函数关系作图解读中和滴定原理
2015-12-05吴文中徐俊龙申
吴文中徐俊龙申 燕
(1越州中学 浙江 绍兴 312075;2深圳科学高中 广东深圳 518129)
利用函数关系作图解读中和滴定原理
吴文中1徐俊龙2申燕2
(1越州中学浙江 绍兴312075;2深圳科学高中广东深圳518129)
中和滴定原理,高中学生理解起来是有一定困难的。文章介绍如何利用电解质溶液中的定量关系,建立中和滴定过程中溶液pH值与所滴加溶液体积(V)的函数关系,利用计算机对函数作图,引导学生直观、生动地理解体会中和滴定原理。
中和滴定;原理;函数关系;计算机辅助作图
一、问题的起因
高中化学在阐述NaOH溶液滴定CH3COOH溶液原理时,教师往往采用计算滴入一定量的NaOH溶液时的pH值,然后作V(NaOH(aq))-pH图得出的,但教师为什么偏偏去引导学生选择计算少加一滴NaOH溶液或多加一滴NaOH溶液的pH值?其原因在于:教师已然知道最后的结论,教材也安排了这样的计算引导,这样的教学过程,“预设”非常严重,这并不有利培养学生严谨的思维品质,严格意义上说,属于“灌输型”教学,倘若要求学生单独来完成这项“艰巨”任务的话,学生也许会计算出“很多很多”的pH值,然后“描点”作图来说明中和滴定的科学性、可行性,许多教师也就是采用这种方法教学设计来帮助学生体会中和滴定原理[1],但这样的教学方法实为先入为主,存“先入之见”之嫌疑。
酸碱恰好完全反应时,尽管恰好反应点可能呈酸性、中性或碱性,但由于在酸碱中和滴定过程中,当非常接近酸碱恰好完全反应点时,溶液的pH值变化量很大,依据这样的情景,假如滴入酚酞或甲基橙等指示剂会在这个“节骨眼”上颜色发生突变,依据颜色变化确定“终点”,再加上酸碱中和是“几乎”完全反应且误差很小的事实来说明中和滴定的科学性、可行性和合法性[2]。
绝大多数教材也都是这样来说明中和滴定原理,但这样的方法是采用不完全归纳法的结果,只是被“后来”的许多实验证实其准确性而已,对于刚接触中和滴定的学生来说,很容易持怀疑态度,甚至觉得是不可信的,同时无法解释为什么某些一元酸或二元酸无法采用中和滴定来测定其浓度的原因。
二、利用函数关系建立中和滴定的pH-V图的可行性
利用数学方法建立函数作图完全则可避免以上问题的出现,现阐述如下:
20 mL 0.1 mol·L-1的CH3COOH溶液,当加入x mL 0.1mol·L-1的NaOH溶液后,设其pH值为y,则存在如下关系:(注:滴入x mL 0.1mol·L-1的NaOH溶液后,混合溶液的体积为(20+x)mL,Kw、Ka分别为室温下水的离子积常数和CH3COOH的电离常数)
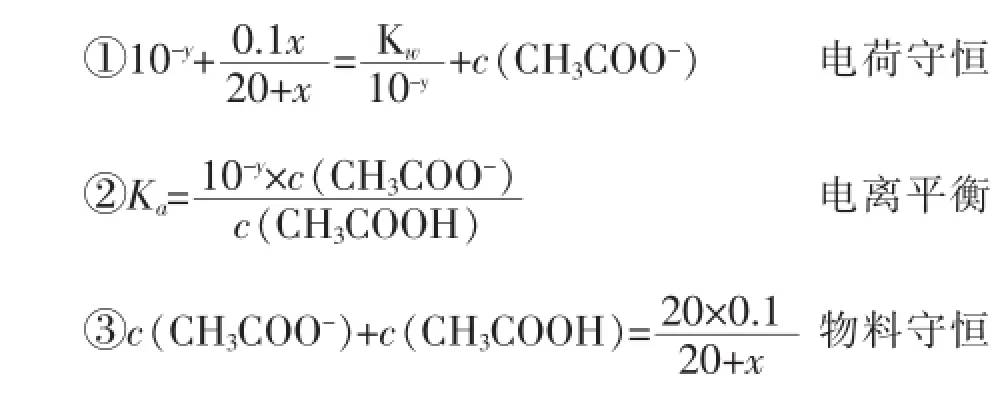
利用以上等量关系,消去 c(CH3COO-)和c(CH3COOH)两个“未知数”,可得关于x、y的函数关系式如下:
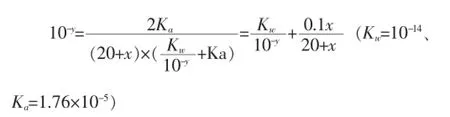
其中关于x、y的函数关系就是中和滴定原理的理论基础。
利用Wolfram Mathematica 8数学软件,可作如图1的pH-V图。
In:ContourPlot[{10-y+(0.1x)/(20+x)=10(-14+y)+(2× 1.76×10-5)/((20+x)(10-y+1.76×10-5))},{x,0,40},{y,0,14}]
Out:
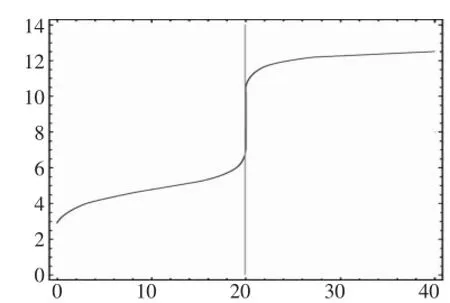
图1 NaOH溶液滴定CH3COOH溶液
显然,用NaOH溶液滴定CH3COOH溶液的过程中,混合溶液的pH值有明显的突变阶段,只要我们能找到一种指示剂,在非常接近CH3COOH溶液和NaOH溶液完全反应点时,颜色发生显著变化即可,从而说明中和滴定原理,说明中和滴定实验的合法性和可行性。
三、建立函数关系作图在滴定原理教学中的实践
1.利用作图法理解强碱滴定一元酸的前提条件
大学教材分析化学中明确指出[2],当某一元酸的酸性太弱的时候,一般不建议直接采用中和滴定方法,为什么不建议采用中和滴定方法的原因实难说清楚,但假如采用建立函数,计算机辅助作图的方法,通过简单的观察其pH值的“突跃”情景,即可直观地说明问题:对于电离常数很小的弱酸(如氢氰酸),为什么不能直接采用中和滴定方法确定其浓度的原因,具体如图2(作图方法原理同上)。
从图2可以看出,氢氰酸若采用中和滴定的方法来测定其浓度,是不明智的,其原因就是氢氰酸和NaOH溶液恰好完全反应时,其pH无明显“突跃”过程,会造成滴定误差较大的后果。

图2 NaOH溶液滴定不同的一元酸
同时可以看出相同浓度的不同一元酸,滴入同浓度的NaOH溶液时,开始阶段,pH值变化显著的是电离常数更小的弱酸,在达到酸碱中和的理论终点时,电离常数越小的一元酸的pH值变化量越不明显。
教材分析化学中指出[2],若某弱酸的浓度 c=0.1mol/L,当c×Ka≥10-8时,可以用强碱标准溶液直接滴定,若当c×Ka<10-8时,则不宜用碱溶液直接滴定,其原因就是此时化学计量点的突跃范围很小 (pH值“突跃”不明显,见图2)。如HCN的Ka=6.2×10-10,无法直接滴定,而乙酸的Ka=1.76×10-5,则可用NaOH溶液直接滴定。
2.利用作图法发现强碱滴定二元酸的局限性
那为什么实验室又很少采用中和滴定的方法测定大多二元酸的浓度呢?
同样方法,可以作一系列二元酸的中和滴定曲线,如图5(假定标准液NaOH浓度和二元酸浓度为0.10mol·L-1)。
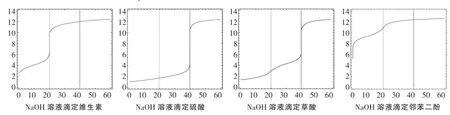
图3 不同二元酸用NaOH溶液滴定的曲线
从图3中发现,尽管H2SO4、维生素、草酸、邻苯二酚等都是二元酸,出现明显的pH值的“突跃”时,化学计量比是不一样的,滴定硫酸溶液的化学计量比(n酸/n碱)为1∶2,维生素的化学计量比为1∶1,草酸的化学计量比是1∶2;而对邻苯二酚而言,是不能使用中和滴定方法来测定其浓度。
假如不预先从理论上作NaOH溶液滴定二元酸的滴定曲线,几乎不可能知道不同的二元酸的滴定计量比是不一样的,也不可能知道某些二元弱酸是不能采用滴定的方法来测定其浓度的。
正因为存在以上的复杂情况,实验室不建议采用中和滴定的方法来测定二元弱酸的浓度。
之所以出现以上的情景,主要原因在于:不同的二元弱酸的一、二级电离常数绝对大小的显著差异和电离常数的相对大小的显著差异。
3.双指示剂中和滴定原理解读
NaOH溶液中若混有Na2CO3,或Na2CO3溶液中混有NaHCO3,其杂质的含量也都可以采用中和滴定方法来测定,其原理就是“双指示剂滴定法”[3],其原理理解起来非常困难,不管教师用多么生动的、形象地言语来描述其原理,都是徒劳的,但通过建立函数关系,计算机辅助作图的方法,则可让学生直观理解其滴定原理,现把其思想方法解析如下:
若有待测液为NaOH和Na2CO3混合溶液,浓度分别为0.1 mol·L-1,则当加入0.1 mol·L-1的盐酸体积为x L,所得溶液的pH=y,作相应函数图如图4:本案的函数关系的得出,依据还是电荷守恒、电离平衡、物料守恒,推演过程并不困难。
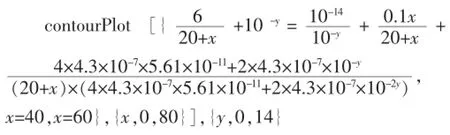
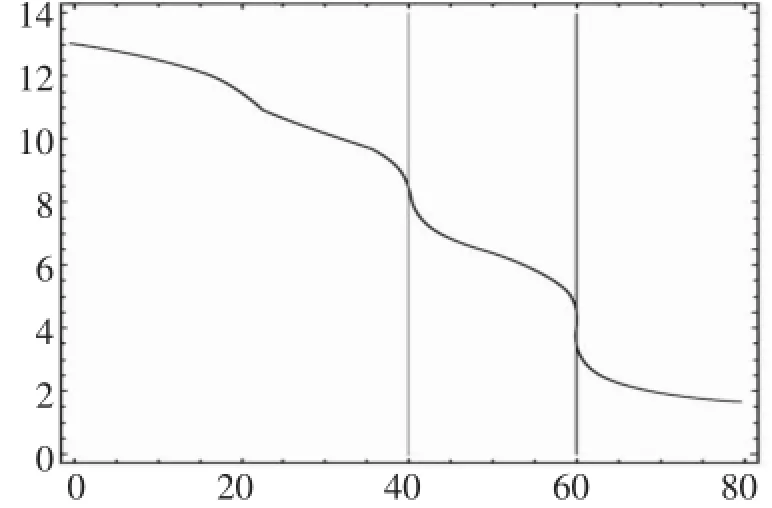
图4 盐酸滴定NaOH和Na2CO3混合溶液
观察图4发现,“双指示剂滴定法”第一次指示剂使用酚酞比较合理,而第二次滴定使用甲基橙为好,很直观地说明了“双指示剂滴定法”合理性。
4.解读以“弱”滴“强”的“不合法”性
教材分析化学中同时也指出[2],实验室一般情况下,不会用弱酸或弱碱去滴定强碱或强酸,其主要原因和上述很弱的酸用氢氧化钠溶液滴定“突跃”不明显的道理一样,当实验者以弱酸或弱碱去滴定强碱或强酸时,很难看到滴定过程中pH值的“突跃”过程,从而严重影响滴定终点的判断,造成很大的误差。
本文采用同样方法建立相应函数,利用Wolfram Mathematica 8数学软件作如图5的pH-V图,这些曲线分别代表用0.10mol·L-1的NaOH溶液滴定0.10mol·L-1盐酸和醋酸,以及0.10mol·L-1的氨水滴定0.10mol·L-1盐酸和醋酸的四条曲线(注:用氨水滴定盐酸和醋酸是不合法的,但这里是假定可以滴定做出的滴定曲线)。
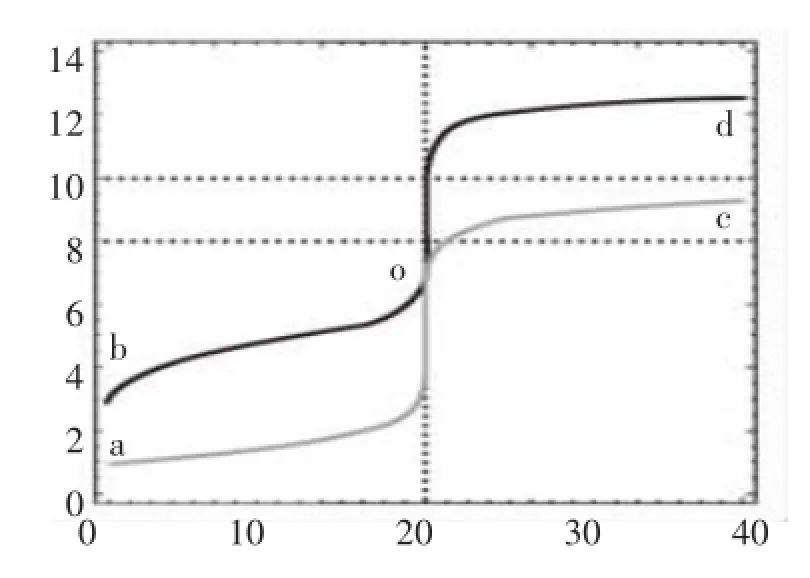
图5 0.1mol·L-1的NaOH和氨水分别滴定同浓度的盐酸和醋酸曲线
图5看上去好像是2条曲线,实为4条曲线,原因是四条曲线有部分几乎是重合的,看上去好像就象2条曲线,其中:
曲线aod为0.10mol·L-1的NaOH滴定同浓度的盐酸——经典滴定,合法
曲线bod为0.10mol·L-1的NaOH滴定同浓度的的醋酸——pH“突跃”明显,酚酞做指示剂,合法
曲线aoc为0.10mol·L-1的氨水滴定同浓度的盐酸——pH“突跃”明显,不能用酚酞做指示剂,不合法曲线 boc为 0.10mol·L-1的氨水滴定同浓度的醋酸——pH“突跃”不明显,不合法
图5非常“生动”地说明了以“弱”滴定“强”的不合理性,其中氨水滴定醋酸的情况一无明显的pH“突跃”,也很难选择判断滴定终点的恰当指示剂。
用氨水滴定盐酸,在没有达到滴定终点时,溶质为盐酸和氯化铵,其中氯化铵的水解在盐酸的存在条件下,完全可以忽略不计,因此氯化铵的存在与否,基本不影响溶液的pH值,当盐酸完全反应后,再滴入氨水,溶质则为氯化铵和氨水,是典型的缓冲溶液,溶液pH不会因为氨水的加入,pH变化很大,这就造成了氨水滴定盐酸在完全反应时,溶液的pH几乎没有突跃的原因。
同理,用氨水滴定醋酸,即便是在达到滴定终点前,生成的醋酸铵和未反应的醋酸已形成了缓冲溶液,在完全反应前,溶液的pH变化缓慢,最后的结果就是pH变化平缓,“突跃”现象很不明显。
5.直观分析缓冲溶液的缓冲作用
CH3COONa和CH3COOH混合溶液 (假定浓度相同),具有缓冲作用,这是众所周知的,大学教材一般采用化学平衡的理论或具体计算的方法,利用不完全归纳法得到该溶液对加入一定量酸或碱后pH值变化很小的事实[4](即缓冲作用)。但学生也只存“只缘身在此山中”之感觉,不能很好地去理解缓冲作用的基本原理,勉强接受教师“强加”的结论。若采用建立函数并作图的方法,就可以直观地体会理解缓冲溶液的缓冲作用,现以浓度分别为0.1 mol·L-1的CH3COONa和CH3COOH缓冲溶液为例,展示推演建立函数并作图来说明问题的教学过程。
1 L0.1mol·L-1的CH3COOH和CH3COONa溶液,当滴加x L 0.1mol·L-1的NaOH溶液后,设其pH为y,则存在如下关系(混合后溶液的体积约为1+x L):
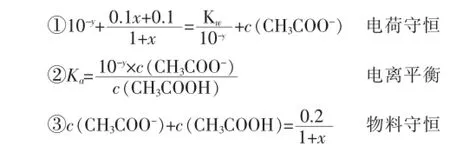
利用以上①②③等量关系,消去c(CH3COO-)和c(CH3COOH)两个未知数,得关于x、y的函数关系式:
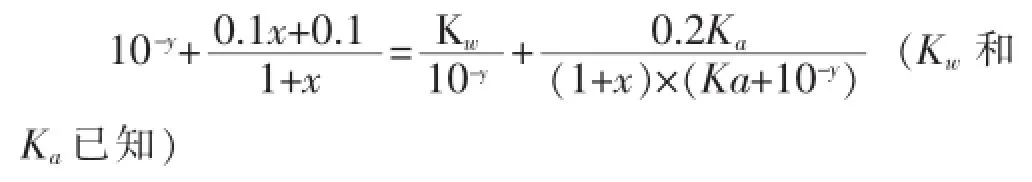
1 L 0.1molL-1的CH3COOH和CH3COONa溶液,当滴加x L 0.1molL-1的盐酸后,设其pH值为y,则存在以下关系(混合后溶液的体积约为1+x L):
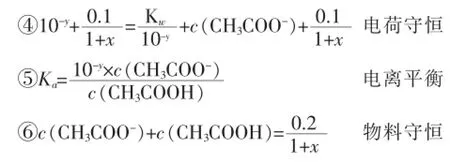
利用以上④⑤⑥等量关系,消去c(CH3COO-)和c(CH3COOH)两个未知数,得关于x、y的函数关系式:
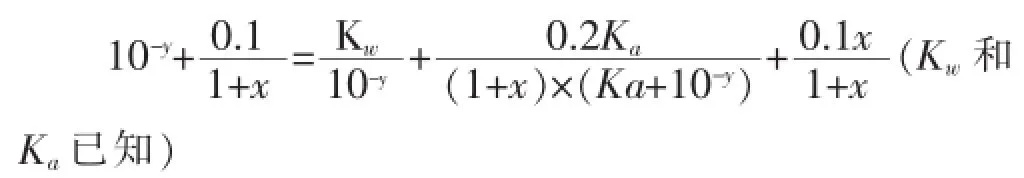
然后利用Wolfram Mathematica 8,同时在同一坐标系中作该缓冲溶液中滴加NaOH溶液或HCl溶液的pH值变化曲线图,如图6。
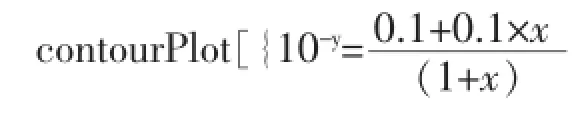
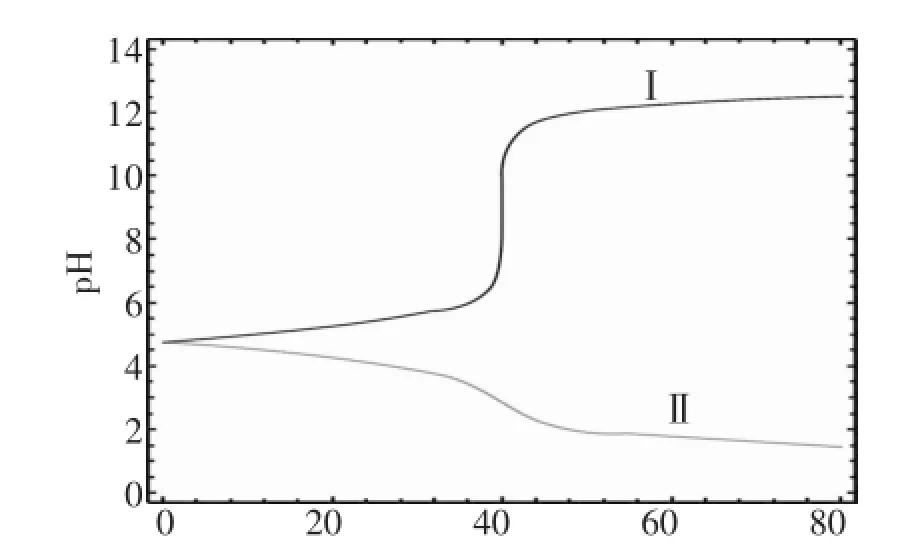
图6 缓冲溶液中加NaOH或盐酸的pH值变化曲线
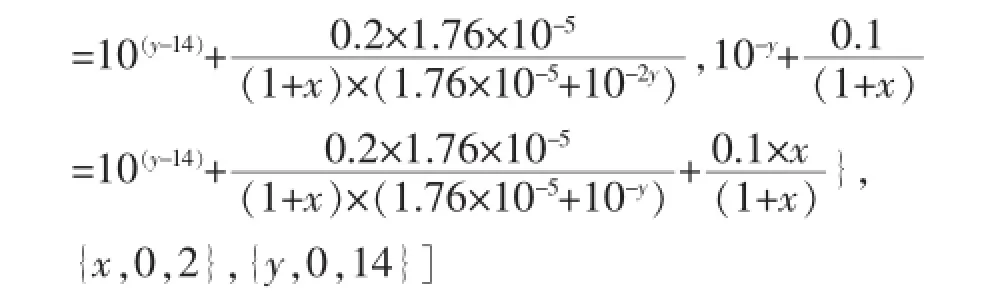
图6表明在CH3COOH和CH3COONa组成的缓冲溶液中加NaOH溶液或盐酸后,从图中可看出,缓冲溶液对酸碱的缓冲作用,且是有范围的,当滴加的NaOH溶液或盐酸过多时 (如超过1L的NaOH溶液时),缓冲溶液的pH值变化也是很大的。
注:曲线I描述的是在上述缓冲溶液中滴加NaOH溶液后的pH值变化曲线,曲线II描述的是在上述缓冲溶液中滴加盐酸后的pH值变化曲线。
四、结束语
中和滴定原理的教学是中学阶段的重点,也是难点,如何使用计算机辅助作图,直观感悟中和滴定原理,理解中和滴定的科学性,是值得研究和实践的,建立滴定过程中的函数关系(隐函数),利用计算机计算软件,快速作图,读图并理解其原理,不但是可行的,而且也是真正“讲理”的。
[1]邹晨光.定性走向定量 理论付诸实践:“酸碱中和滴定”教学设计[J].化学教与学,2011,(8)
[2]宋天佑,程鹏等.无机化学[M].北京:高等教育出版社,2009
[3]徐书绅主编.化学实验分册[M].长春:东北师范大学出版社,1987
[4]孙永华,张信凤,王艳艳.缓冲溶液教学方法的探讨[J].教育教学论坛,2012,(33)
1008-0546(2015)06-0065-04
G633.8
B
10.3969/j.issn.1008-0546.2015.06.026
