Gd2(CO3)3∶Eu@SiO2@APTES磁性-荧光双功能核壳微球的制备与性能
2015-12-05吴燕利徐贤柱李永绣
吴燕利 徐贤柱 文 佳 肖 强*, 李永绣
(1江西科技师范大学有机功能分子研究所,南昌 330013) (2江西师范大学生命学院,南昌 330022)(3南昌大学化学学院,南昌 330031)
Gd2(CO3)3∶Eu@SiO2@APTES磁性-荧光双功能核壳微球的制备与性能
吴燕利1徐贤柱2文佳1肖强*,1李永绣*,3
(1江西科技师范大学有机功能分子研究所,南昌330013) (2江西师范大学生命学院,南昌330022)
(3南昌大学化学学院,南昌330031)
采用尿素均相沉淀法和Stöber法制备了氨基化SiO2修饰的Gd2(CO3)3∶Eu顺磁性-荧光双功能微球。用扫描电镜(SEM)、红外光谱(IR)、X-射线粉末衍射(XRD)等测试手段对微球的结构和颗粒特征进行了分析。结果表明:微球为核壳结构,其Gd2(CO3)3∶Eu核平均直径为150 nm左右,SiO2壳层的厚度大约为30 nm,分散性良好。磁性测试显示微球拥有良好的顺磁性,荧光光谱表明,在396 nm紫外光激发下,微球在613 nm发射较强荧光,属于Eu3+的特征发射,同时微球能成功标记NCIH460肺癌细胞,MTT毒性测试表明该法制备的双功能微球在100~400 μg·mL-1的浓度范围内无毒,表明其在生物应用方面的潜在应用价值。
顺磁性;荧光;双功能微球;核壳结构;尿素均相沉淀法
0 引 言
近10年来,分子影像技术(包括磁共振成像,正电子发射计算机断层显像,光学成像等)已成为生物和医学领域开展高水平研究的重要手段,并在临床诊断和治疗等方面得到了广泛的应用。随着医学的进步,单一功能的探针技术已不能很好地满足实验研究和临床的需要。磁性荧光双功能纳米探针可实现磁性荧光双模态成像,大大提高灵敏度和准确度,因而细胞及活体成像、药物靶向输送、核磁共振等领域展现出优异的性能,引起了科研工作者们广泛的研究兴趣[1-4]。
目前,已报道的磁共振-荧光双模式成像探针往往是将磁性基元和发光基元通过合理的组装构成一个双功能的复合材料。其中的荧光粒子主要包括:有机荧光染料[5-6]、发光量子点[7-8]和稀土纳米荧光粒子[9-12]。尽管有机染料被广泛应用于生物医学领域,但它具有荧光寿命短、光致漂白、及对细胞潜在毒性等缺点。而半导体量子点固有的毒性和稳定性一直引起争议。与传统的荧光标记材料(有机荧光染料,半导体量子点)相比,稀土掺杂无机纳米荧光材料具有高化学稳定性、几乎无毒性、窄线宽、长荧光寿命以及高发光效率等优点,是目前普遍看好的一代生物荧光标记材料,因而受到了研究者的青睐[12]。这类复合材料的磁性中心一般选择具有超顺磁性的纳米Fe3O4粒子、Fe2O3粒子(作为T2造影剂)。例如,Sun等[13]采用水热法合成了Fe3O4/SiO2/YVO4∶Eu3+磁性-荧光性双功能纳米复合颗粒。Zhang等[14]采用均匀沉淀法合成了Fe3O4/SiO2/Y2O3∶Tb磁性-荧光性双功能纳米材料。但是,发光纳米粒子直接沉积到磁性核上会引起荧光猝灭,而导致发光强度减少。因此,设计一种同时拥有磁性和荧光性能的简单化合物是较为理想的途径之一。Gd3+的4f层有7个未成对电子,具有较强的顺磁性,被广泛应用在磁共振成像(MRI)中,加上稀土掺杂荧光粒子特有的荧光性能,稀土离子掺杂的含钆化合物,包括氧化钆[10,15]、氟化钆[16-17]、磷酸钆[18-20]、钒酸钆[21-22]等,引起了科研工作者的广泛关注。然而,对于其进一步的应用,其生物安全性仍然值得研究。
碳酸镧咀嚼片(FOSRENOL,La2(CO3)3)是目前治疗肾病中高磷酸盐血症选择性最好的新药,已经在全世界20多个国家上市销售[23],其安全性已经通过大量临床实验得到证明。我们曾报道,通过微乳液法制备Tb3+掺杂的Gd2(CO3)3磁性-荧光双功能纳米粒子[24],然而,考虑到微乳液法需要大量有机溶剂,成本较高且不利于环境保护,因此,寻找一种成本更加低廉,绿色环保的合成方法来制备稀土离子(Ln3+)掺杂的Gd2(CO3)3磁性-荧光双功能纳米粒子具有一定的研究价值。然而,未经保护的纳米粒子很容易团聚,且其生物相容性也较差。SiO2是一种常用的修饰纳米粒子的材料,具有较好的稳定性可抵抗生物降解作用、同时拥有良好的光学透明性、还可以提供一个具有生物兼容性的表面,其表面大量的羟基可以连接新的官能基团[25-26]。本文采用尿素共沉淀法制备了Eu3+掺杂的Gd2(CO3)3纳米粒子,并通过正硅酸乙酯(TEOS)的水解,在Gd2(CO3)3纳米粒子的表面引入一层SiO2保护层,形成核壳结构,然后通过3-氨丙基三乙氧基硅烷(APTES)在表面生成活性氨基,有利于进一步连接生物活性分子。
1 实验部分
1.1仪器和药品
稀土氯化物(是由99.99%的氧化稀土经分析纯盐酸溶解,蒸去多余的酸后用蒸馏水配)、尿素(AR),聚乙烯吡咯烷酮(AR),正硅酸乙酯(AR),氨水,3-氨丙基三乙氧基硅烷(AR),实验用水为去离子水。
用Nicollet 5700红外光谱(IR)仪扫描确定材料中主要化学键;X射线粉末衍射 (XRD)利用BRUKER D8 FOCUS衍射仪采用Cu Kα射线、2θ范围在10°~80°扫描获得;使用FEI Quanta200F场发射环境扫描电镜和Tecnai G20场发射高分辨透射电镜观察样品的形貌观察粒子的形貌特征;Hitachi4500荧光分光光度计分析粒子的荧光光谱;MPMS-XL-7超导量子磁强计测试样品的磁性,zeiss710共聚焦显微镜观察细胞的荧光成像,ELX-800型酶标仪测定MTT吸光值。
1.2微球合成
微球的制备流程图如下图1所示。
1.2.1Gd2(CO3)3∶Eu的制备
将Gd2O3(99.99%)和Eu2O3(99.99%)经分析纯盐酸溶解,蒸去多余的酸后用蒸馏水配置GdCl3及EuCl3料液,用EDTA标定其浓度后待用。
在圆底烧瓶中加入GdCl3(0.05 mol·L-1,190 mL)和EuCl3(0.05 mol·L-1,10 mL),再加入过量的尿素(3 g,50 mmol),聚乙烯吡咯烷酮(PVPk30,3 g),搅拌溶解后,设置油浴温度90℃,回流3 h,反应结束后,离心分离,用乙醇和水分别洗涤3次,置于真空干燥箱中干燥。

图1 Gd2(CO3)3∶Eu@SiO2@APTES纳米粒子的制备流程图Fig.1 Scheme of preparation of the Gd2(CO3)3∶Eu@SiO2@APTES
1.2.2Gd2(CO3)3∶Eu@SiO2@APTES微球制备
取所制的300 mg Gd2(CO3)3∶Eu及十六烷基三甲基溴化铵(CTAB,300 mg),超声分散在160 mL乙醇和40 mL水的混合溶液中,加入氨水1 mL和TEOS 300 μL,25℃下搅拌12 h。反应结束后,离心分离,用乙醇和水分别洗涤3次,再放入真空干燥箱中干燥。将得到的白色粉末超声分散在无水乙醇中,再加入3-氨丙基三乙氧基硅烷(APTES,20 μL)搅拌24 h后离心分离,用无水乙醇和水反复洗涤,得到白色胶状物,置于真空干燥箱中干燥。
1.3细胞荧光成像
NCI-H460肺癌细胞由江西师范大学生命科学学院提供,首先,将冻存的细胞复苏,快速离心5 min(800 r·min-1),弃去上清液,在无菌条件下,将细胞接种于含10%(体积分数)的胎牛血清、100 u·mL-1青霉素、100 u·mL-1链霉素的高糖DMEM培养基的培养瓶中。然后将其置于37℃、5%CO2培养箱中培养,每3天用0.25%胰酶消化传代1次。之后,调整细胞悬液浓度为2.5×104mL-1,再接种于共聚焦专用的培养皿中,将培养皿置于六孔培养板中,然后置于CO2培养箱 (5%CO2,37℃)中继续孵育24 h,让细胞贴壁,移弃培养液,用PBS缓冲液洗涤3次,再向培养皿中加入浓度为100 μg·mL-1培养基稀释的纳米微球,置该培养皿于CO2培养箱中继续孵育4 h,用PBS缓冲液洗掉未结合的纳米粒子,于共聚焦显微镜下观察荧光图像。
1.4细胞毒性实验
将对数生长期的大鼠肾细胞用胰酶消化后制成5×104mL-1的细胞悬液,接种于96孔板,每孔加100 μL;将平板置37℃、5%CO2培养箱中24 h待细胞贴壁后,移弃培养基。向每个孔加入含有不同浓度微球的培养基100 μL,每个浓度样本设平行的8个副孔,空白对照组加不含样本的培养液100 μL,再放入培养箱中孵育24 h,然后向每孔加入新鲜配制的浓度为5 mg·mL-1MTT溶液10 μL,温育4 h,使MTT还原为在水中不溶的蓝紫色结晶甲臜。弃上清液,每孔加DMSO(二甲基亚砜)200 μL使甲臜溶解,用平板摇床摇匀后使用酶标仪测定各孔的吸光度(A)值(检测波长490 nm),细胞的存活率(Cell viability)按如下公式计算:

2 结果与讨论
2.1SEM分析
采用扫描电镜(SEM)对样品的形貌进行表征,所得结果如下图2所示。Gd2(CO3)3∶Eu粒子(图2a)呈规则的球形,颗粒均匀,粒度约为150 nm,分散性良好。在纳米微球的成核和生长过程中,聚乙烯吡咯烷酮(PVP)与尿素(CO(NH2)2)起到了很好的调节作用:首先,稀土离子(Gd3+,Eu3+)在水溶液中与聚乙烯吡咯烷酮形成配合物,使溶液中游离的稀土离子减少;在加热条件下,尿素缓慢分解释放碳酸根离子(CO32-);有限的稀土离子与缓慢释放出来的碳酸根离子反应,生成碳酸稀土(Gd2(CO3)3∶Eu),有效的控制了瞬间大量成核而导致的粒子团聚问题。图2b是粒子包硅后(Gd2(CO3)3∶Eu@SiO2@APTES)的扫描电镜图片,从图中可以看出,粒子为核壳结构,核的直径为150 nm左右与图2a是相符的,图2c是粒子包硅后的透射电镜图,从图中进一步观察到粒子为核壳结构,核的直径大约为150 nm,SiO2壳层的厚度大约为30 nm。

图2 (a)Gd2(CO3)3∶Eu的扫描电镜图;(b)Gd2(CO3)3∶Eu@SiO2@APTES的扫描电镜图; (c)Gd2(CO3)3∶Eu@SiO2@APTE的透射电镜图Fig.2 SEM images of the samples∶(a)Gd2(CO3)3∶Eu;(b)Gd2(CO3)3∶Eu@SiO2@APTES; (c)TEM image of the Gd2(CO3)3∶Eu@SiO2@APTES
2.2XRD和FTIR分析
首先,利用X-射线粉末衍射对合成的Gd2(CO3)3∶Eu微球进行晶格类型的表征,其结果如下图3所示,未得到明显的衍射峰,推断其为无定形结构。
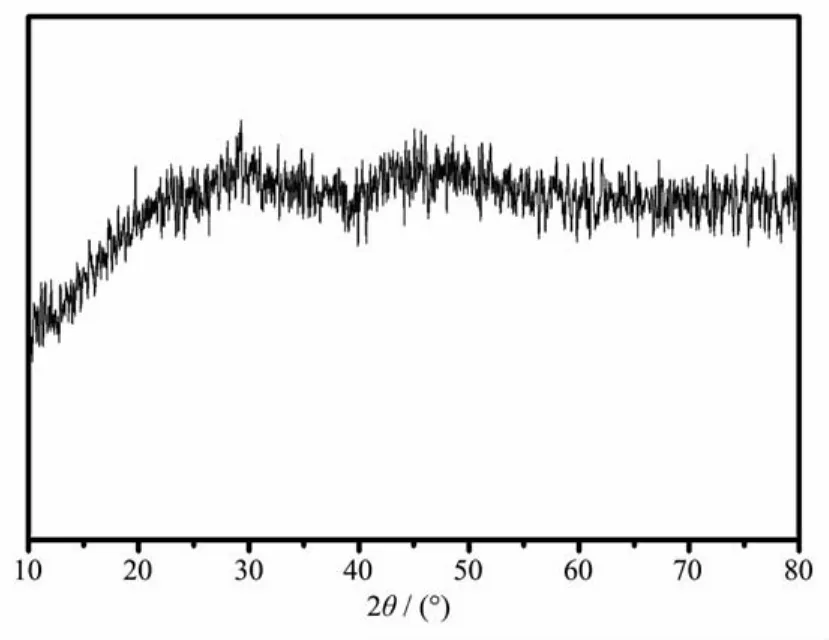
图3 Gd2(CO3)3∶Eu纳米粒子的XRD图Fig.3 XRD patterns of Gd2(CO3)3∶Eu nanoparticles
为了进一步确认微球的组成,用Nicollet 5700红外光谱(IR)仪扫描16次后收集米粒子的红外光谱,确定材料中主要化学键,结果如图4所示,3条曲线分别对应 Gd2(CO3)3∶Eu(a),Gd2(CO3)3∶Eu@SiO2(b),Gd2(CO3)3∶Eu@SiO2@APTES(c)的红外光谱图。如图4a所示,3 420 cm-1的宽峰对应Gd2(CO3)3·H2O结晶水中O-H的伸缩振动,(1 520,1 410 cm-1)对应CO32-的反对称伸缩振动峰,(1 079 cm-1)CO32-的对称伸缩振动峰,(851 cm-1)对应CO32-的面外弯曲振动峰,曲线b中除了上述特征峰以外,还出现了1 080 cm-1处的强吸收峰,可以归属于Si-O-Si的伸缩振动峰,进一步证明SiO2是成功包覆在粒子表面的,而曲线c与曲线b的明显不同之处在于1 580 cm-1处出现了N-H的弯曲振动峰,说明3-氨丙基三乙氧基硅烷(APTES)也已经成功的修饰在 Gd2(CO3)3∶Eu@SiO2微球表面。
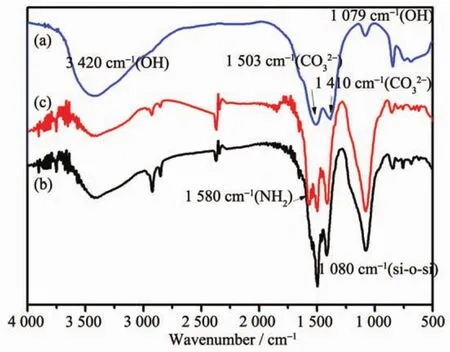
图4 样品的红外光谱:(a)Gd2(CO3)3∶Eu;(b)Gd2(CO3)3∶Eu@SiO2;(c)Gd2(CO3)3∶Eu@SiO2@APTESFig.4 FTIR spectrum of the samples:(a)Gd2(CO3)3∶Eu; (b)Gd2(CO3)3∶Eu@SiO2;(c)Gd2(CO3)3∶Eu@SiO2@APTES
2.3顺磁性
Gd2(CO3)3∶Eu@SiO2@APTES微球的顺磁性由超导量子干涉磁强计测定。图5为样品在300 K下升场和降场过程中的磁化(M-H)曲线。由该图可知,随着磁场强度H的上升,磁化强度M与之呈线性关系,说明样品具有顺磁性,这是由于Gd3+的4f层拥有7个未成对电子,其磁化率χ=6.105×10-5emu·g-1·Oe-1。
2.4荧光光谱性质
Gd2(CO3)3∶Eu@SiO2@APTES微球的荧光光谱如图6所示,图6左边是以613 nm为监控波长测得的Gd2(CO3)3∶Eu@SiO2@APTES激发光谱,激发光谱由200~300 nm的激发带和几组锐形激发峰构成。宽激发带的峰值波长位于250 nm左右,来自于电荷迁移态,274 nm的锐峰属于Gd3+的8S7/2→6I11/2的跃迁,由此可以看出在Gd2(CO3)3@SiO2@APTES中存在较好的能量传递,最强吸收在396 nm,属于典型的Eu3+(7F0→5L6)吸收。图6右边是以396 nm为激发波长测得的Gd2(CO3)3∶Eu@SiO2@APTES发射光谱,由592、613、650、697 nm的发射峰所构成,分别对应Eu3+的5D0→7F1,5D0→7F2,5D0→7F3,5D0→7F4跃迁,其中613 nm的荧光最强,呈现Eu3+的特征红色。

图5 Gd2(CO3)3∶Eu@SiO2@APTES纳米粒子的M-H曲线Fig.5 M-H plot of the Gd2(CO3)3∶Eu@SiO2@APTES nanoparticles

图6 Gd2(CO3)3∶Eu@SiO2@APTES的荧光光谱图Fig.6 Optical properties of Gd2(CO3)3∶Eu@SiO2@APTES nanoparticles
图7为质量浓度为100 μg·mL-1Gd2(CO3)3∶Eu@ SiO2@APTES溶液作用NCI-H460肺癌细胞4 h后在488 nm的蓝光激发下,观察在明场(中)、暗场(左)和叠加场(右)下的荧光显微成像照片。结合明场和暗场中的成像,可见红色荧光是由 Gd2(CO3)3∶Eu @SiO2@APTES纳米微球发出的,这表明Gd2(CO3)3∶Eu@SiO2@APTES纳米微球能成功穿透细胞膜,对NCI-H460肺癌细胞成功标记。
2.5细胞毒性
本实验采取Mosmann的MTT(四唑盐)比色法量化细胞毒性。将不同浓度的纳米粒子与大鼠肾脏细胞共孵24 h,用酶标仪测定各孔在490 nm波长下的吸光度A值,由MTT法可知,吸光度值和活细胞数成正比,即吸光值越大,活细胞数目越多。从图7可知,在100~400 μg·mL-1的浓度范围内,不同浓度颗粒对吸光度值的影响不大,没有明显的变化规律,在粒子浓度达到400 μg·mL-1时,细胞活力仍可达90%以上,表明其对细胞的毒性作用较弱。

图7 Gd2(CO3)3∶Eu@SiO2@APTES纳米粒子与肺癌细胞共孵4后荧光显微照片:(a)暗场;(b)明场;(c)叠加场Fig.7 Confocal microscope images of NCI-H460 cell incubated with Gd2(CO3)3∶Eu@SiO2@APTES NPs:(a)Fluorescence images under 488 nm wavelength excitation;(b)Bright-field images;(c)Merged image

图8 不同浓度Gd2(CO3)3∶Eu@SiO2@APTES NPs溶液作用大鼠肾细胞24h后对应的细胞相对活力图Fig.8 Cell viability(%)estimated by MTT proliferation tests versus the concentration of Gd2(CO3)3∶Eu@ SiO2@APTES NPs
3 结 论
采用均相沉淀法合成了Gd2(CO3)3∶Eu纳米微球,再利用Stöber法对微球表面包覆SiO2和进一步氨基化。结果表明:Gd2(CO3)3∶Eu@SiO2@APTES复合粒子为球形核壳结构,核的直径大约为150 nm,壳层的厚度为30 nm。磁性和荧光分析表明,粒子具有优越的顺磁性,在紫外光激发下,粒子在613 nm有较强发射,属于Eu3+的特征红光。共聚焦成像结果表明粒子能成功标记NCI-H460肺癌细胞,MTT毒性分析表明粒子浓度高达400 μg·mL-1时,细胞仍呈现良好的活性,因此,该磁共振-荧光双模式探针有望用于生物医学领域。
[1]Lee D E,Koo H,Sun I C,et al.Chem.Soc.Rev.,2012,41: 2656-2672
[2]Key J,Leary J F.Int.J.Nanomed.,2014,9:711-726
[3]Zhu H,Shang Y,Wang W.Small,2013,9(17):2991-3000
[4]Kim J,Piao Y,Hyeon T.Chem.Soc.Rev.,2009,38:372-390
[5]Yu M,Shi M,Chen Z,et al.Chem.-Eur.J.,2008,14(23): 6892-6900
[6]YIN Dong-Guang(尹东光),LIU Bin-Hu(刘斌虎),ZHANG Li (张礼).Chinese J.Inorg.Chem.(无机化学学报),2010,26 (9):1612-1616
[7]Sheng Z H,Han H Y,Hu X F,et al.Dalton Trans.,2010,39 (30):7017-7020
[8]Derfus A M,Chan W C W,Bhatia S N.Nano Lett.,2004,4 (1):11-18
[9]Liu Q,Feng W,Li F Y.Coord.Chem.Rev.,2014,273/274: 100-110
[10]Luo N Q,Yang C,Tian X M,et al.J.Mater.Chem.B,2014, 2:5891-5897
[11]Shen J,Sun L D,Yan C H.Dalton Trans.,2008(42):5687-5697
[12]CHEN Liang-Dong(陈良冬),ZHENG Xiao-Rui(郑小睿), DING Yun(丁耘),et al.Chinese J.Inorg.Chem.(无机化学学报),2009,25(2):285-289
[13]Sun Z W,Liu D M,Tong L Z.Solid State Sci.,2011,13(2): 361-365
[14]Zhang Y X,Pan S S,Teng X M.J.Phys.Chem.C,2008, 112(26):9623-9626
[15]Majeed S,Shivashankar S A.J.Mater.Chem.B,2014,2: 5585-5593
[16]Cao T Y,Yang T S,Gao Y,et al.Inorg.Chem.Commun., 2010,13:392-394
[17]Hu Y L,Sun Y X,Li Y,et al.RSC Adv.,2014,4:43653-43660
[18]Debasu M L,Ananias D,Pinho S L,et al.Nanoscale,2012, 4:5154-5162
[19]Ren W L,Tian G,Zhou L J,et al.Nanoscale,2012,4:3754-3760
[20]Liviano S R,Becerro A I,Alcántara D,et al.Inorg.Chem., 2013,52:647-654
[21]Yin W Y,Zhou L J,Gu Z J.J.Mater.Chem.,2012,22:6974 -6981
[22]Jia G,Zhang C M,Ding S W.CrystEngComm,2012,14:573-578
[23]Harrison T S,Scott L J.Drugs,2004,64(9):985-996
[24]Wu Y L,Xu X Z,Tang Q,et al.Nanotechnology,2012,23 (20):205103-205108
[25]PENG Hong-Xia(彭红霞),LIU Gui-Xia(刘桂霞),DONG Xiang-Ting(董相廷),et al.Chinese J.Inorg.Chem.(无机化学学报),2012,18(7):1305-1309
[26]ZHONG Wen-Ying(钟文英),YANG Shuo(杨硕),HUANG Bin(黄斌),et al.Chinese J.Inorg.Chem.(无机化学学报), 2012,28(11):2021-2028
Synthesis and Properties of Paramagnetic-Fluorescent Gd2(CO3)3∶Eu@SiO2@APTES Core-Shell Structured Microspheres
WU Yan-Li1XU Xian-Zhu2WEN Jia1XIAO Qiang*,1LI Yong-Xiu*,3
(1Jiangxi Key Laboratory of Organic Chemistry,Jiangxi Science and Technology Normal University,Nanchang 330013,China) (2College of Life Science,Jiangxi Normal University,Nanchang 330022,China) (3College of Chemistry,Nanchang Universtiy,Nanchang 330031,China)
Monodisperse core-shell structured Gd2(CO3)3∶Eu@SiO2@APTES microsphere was successfully prepared via the stöber method by coating a layer of silica on the surface of Gd2(CO3)3∶Eu microspheres which derived from a simple urea assisted coprecipitation method.Their structural,optical and magnetic properties were investigated using SEM,TEM,XRD,FTIR,PL,and MPMS.The results indicated that the microspheres with general 30 nm shell thickness and 150 nm core size has spherical morphology with smooth surface and narrow size distribution. The paramagnetic property of the synthesized Gd2(CO3)3∶Eu@SiO2@APTES microspheres were confirmed with its linear hysteresis plot(M-H).The synthesized microspheres can enter into living cancer cells and emit orange-red luminescence light due to the5D0→7F2transition of the Eu3+ions,and Gd2(CO3)3∶Eu@SiO2@APTES microspheres showed no cell cytotoxicity or adverse affect on kidney cell growth under high dose up to 400 μg·mL-1.Therefore, Gd2(CO3)3∶Eu@SiO2@APTES microspheres provides the dual modality of optical and magnetic resonance imaging.
paramagnetic;fluorescent;bifunctional microsphere;core-shell structure;urea assisted coprecipitation method
O614.33+8
A
1001-4861(2015)06-1125-06
10.11862/CJIC.2015.154
2014-12-03。收修改稿日期:2015-02-09。
江西省教育厅一般项目(No.GJJ14578,GJJ13216),江西省科技支撑项目(No.20142BBF60008)资助。
*通讯联系人。E-mail:wanny118@126.com,yxli@ncu.edu.cn;会员登记号:S06NS032M1204。