猪感染肺炎支原体模型的建立及评估
2015-12-05代长云吴建英阮征胡修忠周
代长云吴建英阮 征胡修忠周 华
刘开武2张四化2夏 瑜1华 娟1李 杰1黄海军1,2 *
(1.武汉市畜牧兽医科学研究所,湖北武汉 430208;2.武汉市畜牧兽医局,湖北武汉 430023)
猪感染肺炎支原体模型的建立及评估
代长云1,2吴建英2阮 征2胡修忠1周 华1
刘开武2张四化2夏 瑜1华 娟1李 杰1黄海军1,2 *
(1.武汉市畜牧兽医科学研究所,湖北武汉 430208;2.武汉市畜牧兽医局,湖北武汉 430023)
为了建立猪肺炎支原体感染的动物模型,选取实验室培养保存的猪肺炎支原体济南株F66株(编号:CVCC354),在不同时间点对12头实验猪进行人工感染,分别建立早期、中期和晚期猪支原体肺炎动物模型。采用PCR、形态学、组织学等多种方法对模型进行评估,证实早期、中期和晚期猪支原体肺炎动物模型成功建立。
猪 肺炎支原体 动物模型
猪支原体肺炎(Mycop lasma pneumonia of swine)亦称猪喘气病或猪流行性肺炎,是由猪肺炎支原体(M ycop lasm a hyopneumonia,MhP)引起的一种慢性呼吸道传染病。此病具有高发病率、低死亡率、流行范围广的特点,严重影响猪的生长率和饲料转化率,是造成养猪业经济损失的重要疾病之一。
MhP是猪呼吸道疾病中最常见的分离病原之一,主要危害除降低日增重和提高料肉比之外,最重要的是它能破坏呼吸道黏膜-纤毛屏障,从而引起多病原的继发感染和混合感染,引发猪支原体肺炎。为了更直观有效地研究该病的临床治疗方法,我们模拟临床发病过程,复制了肺炎支原体感染的动物模型,为下一步临床治疗研究提供合适的实验材料。
1 材料与方法
1.1 主要试剂
PPLO肉汤培养基、酵母粉由BD公司生产,马血清、MEM培养基由Gibco公司生产,葡萄糖、琼脂粉、精氨酸、青霉素、1%酚红均购自武汉众一生物科技有限公司。
1.2 菌种
菌种及菌液制备;猪肺炎支原体(Mhp)济南株F66株(编号:CVCC354)由中国兽药监察所提供。开封后以PPLO培养基原量稀释、培养、传代并测其颜色变化单位(ccu/ m l),置-20℃保存,3 d 内使用。用前稀释至104~ 5ccu/ml。
1.3 PPLO培养基配制
葡萄糖2.5g,PPLO 10.5g,酵母粉2.5g,琼脂粉7.5g(液体培养基中不加),超纯水定容至445m l,116℃灭菌20min后,加入马血清50m l,无菌10%精氨酸5ml,灭菌10×MEM 5ml,无菌8万单位/m l青霉素溶液5m l,无菌1%酚红溶液500μL(固体培养基中不加)。
1.4 Mhp的培养及Mhp菌数的测定(CCU 实验)
取无菌 PPLO 培养基 100 ml,按 5∶1 比例加入小牛血清 20 m l 混匀,分装到无菌锥形瓶中,60m l/瓶。培养基中加入 100μl菌液(4℃保存)。盖硬胶塞后用封口膜封口,静置培养在 37℃恒温箱中。每日观察其颜色变化。我们采用颜色改变单位测定法计算Mhp 的菌数,具体如下:
取 11 支无菌小试管,按①~⑩编号,取 1.8 m l已添加小牛血清的PPLO培养基溶液(5∶1 比例)分别加入试管中。取 200μl已传代培养 7d的处于对数生长期的菌种加入①号试管中,依次1∶10 递减稀释,即①号为Mhp原液,②号管为 10-1,③号管为10-2,依次类推,⑩号管为 10-9,第 11 号试管作为阴性对照管不加Mhp菌液。将各组试管加盖硬胶塞并用封口膜封口后,静置于37℃恒温箱中培养,每日观察颜色变化以及液体有无浑浊改变。发生颜色改变的最高稀释度为颜色改变单位。
1.5 试验动物
12头健康杜洛克长白杂交猪,公母兼有,购自武汉市畜牧兽医科学研究所试验猪场。在猪场实验猪舍观察两周,无咳嗽、气喘等症状后进入试验环节。随机分为4组,试验1组(早期)3头(24.4±1.6kg),试验2组(中期)3头(24.2±1.7kg),试验3组(晚期)3头(24.6±1.4kg),对照组3头(24.5±1.2kg)。饲养管理按照《武汉市畜牧兽医科学研究所试验猪场饲养管理规定》进行。
1.6 动物感染 MhP
1.6.1 接种批次与剂量
试验组(早、中、晚期)每头动物第 0 天接种含 1×107ccu/ ml的MhP液各10ml;对照组动物第 0 天接种无菌 0.9%生理盐水各10m l。
1.6.2 接种方法
用加样器吸入处于对数生长期的Mhp 菌液,缓滴入试验猪鼻腔使其进入气管支气管[5]。
1.7 动物模型的评估
1.7.1 样品收集
试验1组(早期)、试验2组(中期)、试验3组(晚期)分别于接种后12d、16d、21d后采集样品。收集鼻腔及咽喉处分泌物,放入加有1 m l 生理盐水的灭菌试管中。
1.7.2 模型建立标准
(1)外观表现观察
接种后,每间隔6h 观察1 次,分别记录试验猪和对照猪的精神状态及临床表现。每天记录日增重、体温。
(2)剖检及组织病理切片检测
剖检时主要观察肺部、淋巴等组织器官病变情况。按常规程序制备肺脏和淋巴组织切片,行HE染色,在显微镜下观察病变情况。
(3)PCR检测
将收集的样品高速离心,弃上清后加入20μl STET 细胞裂解液,煮沸10 m in,离心后取上清用于PCR 检测。PCR反应体系25μl:10×PCR Buffer 2.5μl,dNTP(2.5mM/L)2μl,阳性引物5’-ACACCATGGGAGCTGGTAA-3’和5’-CATCGACTTTCAGACCCAAGGCAT-3’(10μl/L)各0.5μl,阳性模板1μl,Taq DNA polymerase(2.5U/μl)0.25μl,加ddH2O至25μl。同时设立ddH2O阴性对照。反应条件为:94℃5min,94℃ 30s,58℃ 30s,72℃ 30s,35个循环,72℃ 10min。PCR反应结束后,取1μl PCR扩增产物经琼脂糖凝胶电泳,在凝胶成像系统中观察记录结果。
2 结果与分析
2.1 MhP的培养
MhP在含有 20%胎牛血清的 PPLO 培养基中生长时能够分解葡萄糖产酸但不产气,使培养液的 pH 值降低,酚红指示剂由红色变为橘黄色,随着MhP的生长,pH 值进一步降低,黄色逐渐加深,到 3 周末时已全部变成黄色。
于 37℃恒温箱内静置培养 1 个月后,各试管中培养液颜色改变在⑧号管(10-7)处停止,表明其 CCU 值为 107,即被测菌液稀释到 10-7仍有MhP生长,每支试管中液体均无沉淀浑浊。
2.2 感染猪外观表现
感染猪表现明显的精神沉郁,靠墙角呆立或卧倒,活动减少,被毛粗糙,肺部出现明显的肺湿呼吸音(图1a)。感染12 d以后模型组各种症状逐渐加重(图1b),尤其是鼻部出现脓性分泌物,个别者带有少量血丝,呼吸时可听到鼻塞声和喘鸣声。体重下降,体温升高。
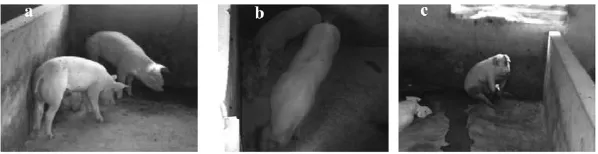
图1 感染猪精神沉郁、呆立或卧倒
2.3 组织病理变化
剖检显示对照组3头猪的肺组织及其他脏器无明显炎症反应。试验组肺组织、淋巴组织多呈中度或重度炎症改变(图 2),肺部病变明显,外观充血、水肿,严重者肺叶分布散在大小不等的坏死灶。其中试验1组有2头猪肝脏呈轻度炎症改变,试验1组有2头猪的肾脏呈轻度炎症改变。
组织切片结果显示了早期、中期、晚期3组试验猪的肺脏、淋巴等病理变化特征,与其对应分为轻度感染、中度感染、重度感染3个过程,具体如下:
轻度(早期):病变范围比较局限,肺泡间隔轻度增宽,间隔内有少量淋巴细胞浸润,细支气管上皮排列尚规则,管腔的周围有少量炎症细胞浸润。
中度(中期):病变范围比较广泛,肺泡间隔增宽较明显,间隔内有较多淋巴细胞浸润,肺泡结构部分破坏,细支气管上皮增生、破坏,小血管周围淋巴细胞浸润。
重度(晚期):病变范围广泛,肺泡间隔明显增宽,间隔内有大量淋巴细胞浸润,细支气管上皮破坏、脱落,管腔内有明显渗出,肺间质毛细血管、支气管旁小静脉瘀血。
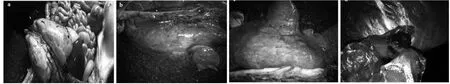
图2 感染猪肺脏、淋巴病变
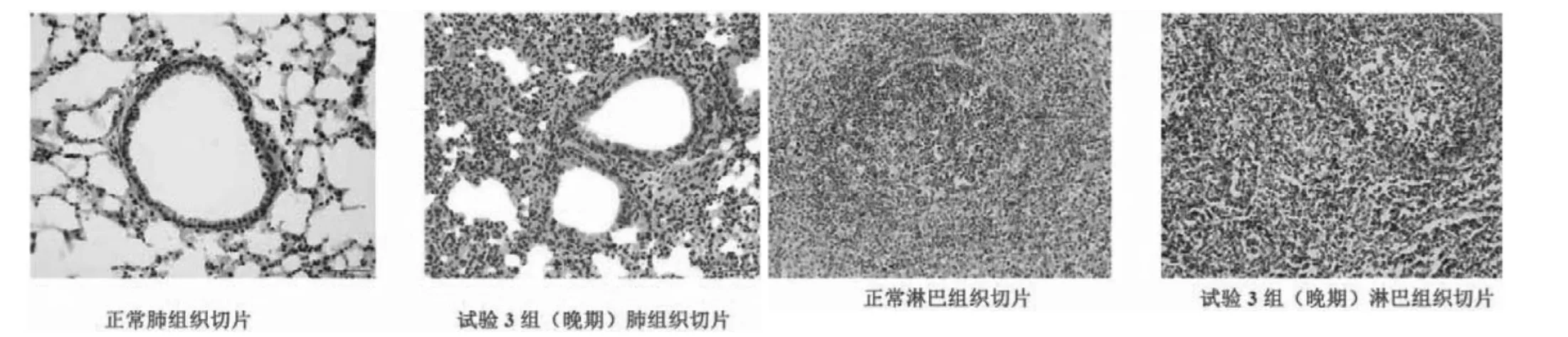
图3 猪肺脏、淋巴病理切片
2.4 PCR检测结果
PCR检测结果表明,收集的试验组9头猪样品中均检测到猪肺炎支原体阳性,且在一定程度上感染时间延长呈阳性增强趋势,对照组3头猪均为阴性(图4)。证实猪肺炎支原体模型构建成功。
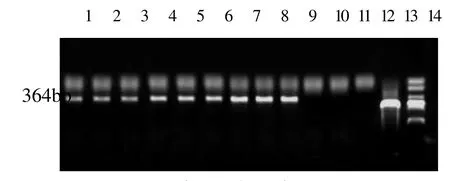
图4 PCR检测结果
3 讨论
猪支原体肺炎对各种猪均易感,在新引进猪群多呈急性暴发,其发病率和死亡率常在20%以上,最急性型的死亡率可高达80%~100%。本病发病率高,流行快,除引起死亡外还导致病猪长时间带菌,大量消耗机体组织,严重影响猪的生产性能和商品性能,大大增加养殖成本。而且,支原体可通过空气传播,很难隔离阻断传播途径,极易引起全群发病,是公认的最难净化的猪病,给养殖业带来巨大损失。本病在我国的流行十分广泛,呈逐年上升趋势,已成为危害养猪业最严重的疾病之一,给我国养猪业造成严重的经济损失。
目前,已有多种动物成功建立了支原体肺炎的模型,但是对猪支原体肺炎模型的建立及相关研究非常有限。本研究建立猪肺炎支原体感染模型,旨在为有针对性地治疗猪支原体肺炎疾病提供理想的动物模型。
本研究中采用的 PPLO 培养基成分和常用于 MhP 分离培养的Hayflick 培养基基本相同。此外 SP-4 培养基、马丁氏肉汤培养基等也用于 MhP 分离培养,其基础培养基成分基本相同[10]。MhP的培养要求比普通细菌高,除了一般基础营养物质外,还需添加10%~20%的动物血清提供胆固醇、脂肪酸和蛋白质及 10%的新鲜酵母浸液以提供核苷酸前体、维生素及刺激生长因子等。接种前应将培养基的 pH 值调至 7.8,因 MhP 生长的最佳 pH 值范围是7.6~7.8。MhP 分解葡萄糖产酸后使培养基的 pH 值下降,故添加 0.002%的酚红可作为观察培养基颜色变化的指示剂。MhP 在固体或液体培养基中生长繁殖达高峰后,若继续培养则由于培养基pH 值的变化而很快死亡。虽然有资料显示死的 MhP 也能引起实验动物肺部炎症改变,但却不如活菌明显,因此本研究使用的是107ccu/ml 的MhP 菌液,以保证其中 MhP 的活力。
本实验接种结果显示,试验组接种后第5d即出现了精神状态略差,进食及活动减少等表现,以后逐渐恢复,第10d鼻部出现分泌物,伴随气喘、竖毛、寒战等症状。在感染晚期,口、鼻分泌物较前明显增多,提示其气道反应性增加。实验组动物肺组织病理切片提示不同程度的炎症改变,如:肺泡间隔增宽,间隔内、支气管旁、血管周围以淋巴细胞为主的炎症细胞浸润,支气管上皮细胞增生、坏死、脱落,肺泡结构破坏等。试验1组多呈轻度改变或无炎症;试验2组动物多呈中重度改变;试验3组多呈重度改变。所有实验组动物的鼻腔分泌物的 MhP 培养均为阳性结果,对照组为阴性。综上所述:本研究成功建立猪支原体肺炎感染模型,为进一步研究 MhP 感染的发病机制和 MhP 感染后机体免疫状态及对症治疗奠定了基础。
[1] 金洪效,毛洪先.猪气喘病的诊断与防治[M].江苏科学技术出版社,1993:8-12.
[2] 祝俊杰,刘贵滨,李秀敏,等.猪喘气病综合防治技术的研究及应用[J].中国兽医杂志,1993,19(8):10-12.
[3] 刘晓红,辛德莉,侯安存,等.小鼠肺炎支原体肺炎模型的建立及组织病理学评分方法的应用[J].重庆医学,2004,33(9):1338-1340.
[4] 杨春,周莉,何永林.探讨接种时间和剂量对小鼠肺炎支原体肺炎模型建立的影响[J].四川动物,2009,28(4):524-528.
国家自然科学基金(31201938)、武汉市晨光计划(201150431078)、武汉市农科院英才计划(YC201101)项目资助。
代长云,男,高级兽医师,学士,研究方向为畜牧兽医研究与技术推广。
黄海军,男,副研究员,博士,研究方向为动物生物技术与疫病防控。
