单细胞海藻提取物对人脐带间充质干细胞的抗衰老作用*
2015-12-04马珊珊崔渊博渠瑞娜王欣欣宋及时关方霞1
姚 宁,马珊珊,崔渊博,渠瑞娜,王欣欣,孟 楠,宋及时,赵 云,高 军,关方霞1,#
1)郑州大学生命科学学院 郑州450001 2)郑州大学第一附属医院干细胞研究室 郑州450052 3)北京高新源新兴技术开发有限公司北京100029
间充质干细胞是一类具有自我更新、高度增殖和多向分化潜能的细胞群体[1],在细胞治疗、组织修复、基因治疗等方面显示出巨大的应用潜力[2-3]。但是在体外培养过程中,随着传代次数的递增,人脐带间充质干细胞(human umbilical cord derived mesenchymal stem cells,hUC-MSCs)的增殖和黏附力下降,细胞凋亡率增加,生物活性逐渐下降[4]。单细胞海藻(marine phytoplankton,MPPT)是海洋中重要的生物资源[5],具有抗病毒、抗氧化、抗过敏、抗肿瘤等生物学活性[6]。该实验通过观察MPPT 提取物对hUC-MSCs 增殖、凋亡以及衰老相关基因表达的影响,探讨MPPT 对hUC-MSCs 的抗衰老作用及其可能机制。
1 材料与方法
1.1 标本和试剂 人脐带标本来源于郑州大学第一附属医院产科正常剖宫产的健康产妇志愿捐献的3 份脐带,乙肝五项、HIV、HCV、梅毒等检测均呈阴性。Trizol、qRT-PCR 试剂盒和逆转录试剂盒均购自TaKaRa 公司,Western blot 相关试剂盒抗体均购自北京鼎国生物技术有限公司。荧光定量PCR 引物均由生工生物工程(上海)股份有限公司合成。MPPT 提取物由北京高新源新兴技术开发有限公司提供。
1.2 不同质量浓度MPPT 提取物培养基的配制按10 g/L 的质量浓度将MPPT 溶于DMEM/F12 培养基中,超声破碎5 min,使用0.2 μm 过滤器无菌过滤培养基,37℃培养箱中放置24 h,然后4℃保存,作为贮存液。使用时,用培养基将贮存液稀释至所需质量浓度(1、2、3、4、5 g/L)。
1.3 hUC-MSCs 的分离和传代 取4 cm 长无菌脐带组织,PBS 洗除余血,剪成约1 mm×1 mm×1 mm组织块,将组织块移入培养瓶中,加入含体积分数10% FBS 的DMEM/F12 培养基,置37℃、体积分数5% CO2、饱和湿度培养箱中培养。当细胞达90%融合时用2.5 g/L 胰蛋白酶消化,并按同一细胞密度传代。
1.4 hUC-MSCs 免疫表型鉴定 取原代hUCMSCs(P0 细胞)、第3、10、15 代hUC-MSCs(P3、P10和P15 细胞),采用流式细胞术检测不同传代次数的hUC-MSCs 表面CD44、CD29、CD90、CD31、CD45的表达情况。
1.5 qRT-PCR 检测hUC-MSCs p16、p21、p53、PCNA、Sirt2 mRNA 的表达 分别收集P3、P10 和P15 细胞,采用Trizol 法抽提各代细胞总RNA,逆转录合成cDNA,采用qRT-PCR 试剂盒并按照说明书进行操作,以GAPDH 作为内参。引物序列见表1。反应条件:95℃30 s,95℃5 s,60℃34 s,40个循环。mRNA 相对表达量的计算采用文献[7]方法。实验重复3次。

表1 人p16、p21、p53、PCNA、Sirt2 及内参引物序列
1.6 CCK-8 法检测MPPT 提取物对hUC-MSCs增殖的影响 取第15 代hUC-MSCs,调整细胞密度为2 ×107mL-1。将细胞接种于96 孔板,每孔100 μL。实验组分别加入100 μL 1、2、3、4、5 g/L MPPT提取物的培养液,对照组为正常培养的hUC-MSCs,每组3个复孔。在37℃、体积分数5% CO2、饱和湿度培养箱中培养过夜。分别于1、2、3 和4 d 后避光下每孔加10 μL CCK-8 溶液并放置培养箱中继续孵育2 h,然后使用酶标仪检测450 nm 波长处的吸光度值,记录数据并绘制生长曲线。
1.7 PI 染色法检测MPPT 提取物对hUC-MSCs细胞周期的影响 实验分为3组,分别为P3组、P15组和1 g/L 的MPPT 提取物预处理的P15组(MPPT+P15组),培养72 h 后终止培养,调整细胞密度为2 ×106mL-1。取1 mL 单细胞悬液,离心后去除上清,加入11 mL 预冷的PBS 重悬细胞,离心去除上清,加入1 mL 预冷的体积分数70%乙醇固定过夜。预冷PBS 洗去固定液,加入0.5 mL PI 染色液,37℃避光温浴30 min,然后上流式细胞仪检测细胞周期。实验重复3次。
1.8 FITC-Annexin V 染色法检测MPPT 提取物对hUC-MSCs 凋亡的影响 细胞分组及处理同1.7。使用预冷PBS 洗去培养基,加入100 μL Binding Buffer 重悬细胞,加入5 μL FITC-Annexin V 和5 μL PI,室温避光孵育15 min,补加400 μL Binding Buffer,然后上流式细胞仪检测细胞凋亡。实验重复3次。
1.9 qRT-PCR 检测MPPT 提取物对hUC-MSCs p16、p21、p53、PCNA、Sirt2 mRNA 表达的影响 细胞分组及处理同1.7。qRT-PCR 检测方法同1.3。
1.10 β-半乳糖苷酶染色检测细胞衰老情况 细胞分组及处理同1.5。吸取各组细胞培养液,加入1 mL β-半乳糖苷酶染色固定液,室温固定10 min;去除细胞固定液,PBS 洗涤细胞3次,每次3 min;然后每孔加入1 mL 染色工作液,37℃孵育过夜。光学显微镜下观察,蓝染细胞为衰老细胞。100 倍镜下选取3个视野,观察并计算衰老细胞率。
1.11 统计学处理 采用SPSS 17.0 进行数据分析。不同组间细胞周期、细胞凋亡率、衰老细胞率及p16、p21、p53、PCNA、Sirt2 mRNA 相对表达量的比较均采用单因素方差分析,两两比较采用LSD-t 检验。检验水准α=0.05。
2 结果
2.1 hUC-MSCs 的形态及生长特性 hUC-MSCs接种2 周后贴壁,10 d 后细胞形态呈长梭形(图1A)。第3 代细胞形态呈长梭形(图1B),大小均一,平行排列。继续培养至第10 代,细胞形态无明显变化(图1C)。当培养至第15 代时,细胞生长速度缓慢,细胞变大,形态杂乱(图1D)。
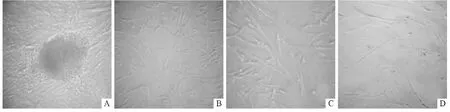
图1 不同传代次数hUC-MSCs 的形态(×100)
2.2 hUC-MSCs 的免疫表型鉴定 不同传代次数的hUC-MSCs 均表达CD29、CD44 和CD90,而不表达CD31 和CD45。
2.3 P3、P10、P15 细胞中p16、p21、p53、PCNA、Sirt2 mRNA 的表达 随着传代次数的增加,hUCMSCs 中p16、p21、p53 mRNA 的相对表达量逐渐增加,PCNA 和Sirt2 mRNA 的相对表达量逐渐减少。见表2。
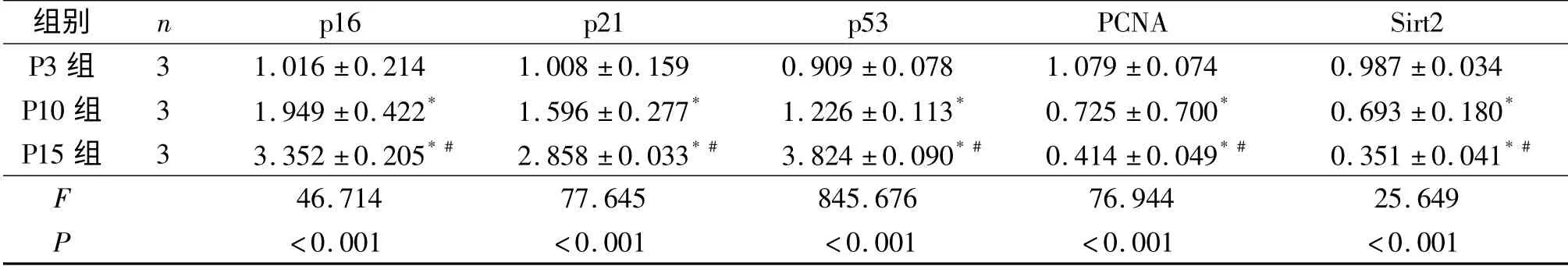
表2 P3、P10、P15 细胞中p16、p21、p53、PCNA、Sirt2 mRNA 的相对表达量
2.4 不同质量浓度MPPT 提取物对hUC-MSCs增殖的影响 低质量浓度(1、2 g/L)MPPT 提取物可以促进hUC-MSCs 的增殖,而高质量浓度(3、4、5 g/L)MPPT 提取物抑制细胞增殖(图2)。故后续实验采用1 g/L MPPT 提取物对hUC-MSCs 进行处理。

图2 MPPT 提取物对hUC-MSCs 增殖的影响
2.5 MPPT 提取物对hUC-MSCs 细胞周期和凋亡的影响 结果见表3、4。可见1 g/L MPPT 提取物能够促使细胞周期进入S 期,并可抑制细胞凋亡。
2.6 qRT-PCR 检测MPPT 提取物对hUC-MSCs p16、p21、p53、PCNA、Sirt2 mRNA 表达的影响 结果见表5。
2.7 各组细胞衰老情况比较 结果见表6。

表3 各组细胞周期的变化 %
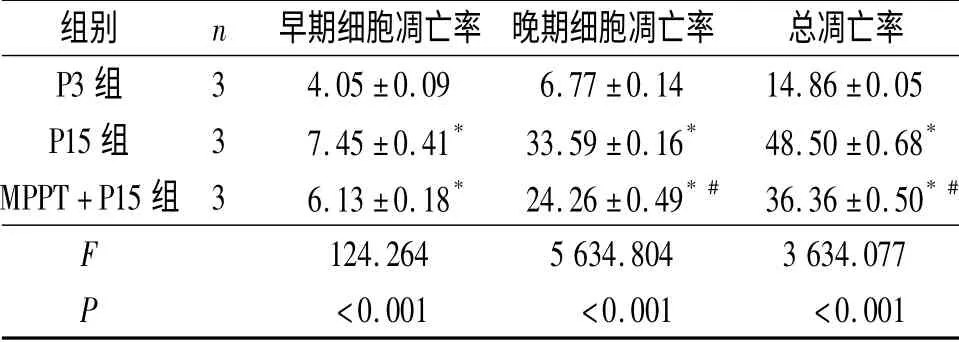
表4 各组细胞凋亡率的变化 %
3 讨论
hUC-MSCs 是多能干细胞,易获取和扩增,并且不涉及伦理问题[6]。但是由于体外分离培养原代细胞受外界因素的限制,长期培养的MSCs 生物学特性和遗传稳定性发生变化[8]。作者发现将hUCMSCs 连续传代培养,P15 代hUC-MSCs 细胞形态发生改变,细胞增殖能力下降,衰老细胞增多。qRT-PCR 检测结果显示,hUC-MSCs 中PCNA、Sirt2 mRNA 的相对表达量随培养传代次数增加而减少,而p16、p21、p53 mRNA 的相对表达量随传代次数增加而增加。该结果说明长期传代培养的hUCMSCs 会发生复制性衰老,这与Beerman 等[8]的研究一致。
前期研究[9]发现,MPPT 能够抑制人脑胶质瘤干细胞的增殖,并促进其分化。该研究发现1 g/L MPPT 提取物能够促进hUC-MSCs 增殖,并抑制hUC-MSCs 凋亡。研究[10-13]发现,细胞的衰老是受一系列基因调控的,许多基因都参与这一复杂的生物过程,如p16、p21、p53、PCNA 和Sirt2 等。该研究发现,1 g/L 的MPPT 提取物能将hUC-MSCs 阻滞在S 期,降低p16、p21、p53 mRNA 的表达,提高PCNA和Sirt2 mRNA 的表达,降低衰老细胞率,从而增强hUC-MSCs 的增殖能力,发挥抗衰老作用。
综上,该研究通过体外实验初步探讨MPPT 对hUC-MSCs 的抗衰老作用及其机制,下一步将继续通过体内实验研究MPPT 对干细胞的抗衰老作用。
[1]Can A,Balci D.Isolation,culture,and characterization of human umbilical cord stroma-derived mesenchymal stem cells[J].Methods Mol Biol,2011,698:51
[2]Dantuma E,Merchant S,Sugaya K.Stem cells for the treatment of neurodegenerative diseases[J].Stem Cell Res Ther,2010,1(5):37
[3]程梅,王洪岩,于大海,等.脐带间充质干细胞长期体外培养的生物学特性及遗传稳定性[J].中国生物制品学杂志,2014,27(3):356
[4]Cheung RC,Wong JH,Pan WL,et al.Antifungal and antiviral products of marine organisms[J].Appl Microbiol Biotechnol,2014,98(8):3475
[5]Aslam MN,Kreider JM,Paruchuri T,et al.A mineral-rich extract from the red marine algae lithothamnion calcareum preserves bone structure and function in female mice on a Western-style diet[J].Calcif Tissue Int,2010,86(4):313
[6]于程程,汤勇勇,盛宏霞,等.人脐带来源间充质干细胞移植急性阿尔茨海默病模型小鼠引发的免疫应答反应[J].中国组织工程研究,2012,16(19):3476
[7]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2+-ΔΔCTmethod[J].Methods,2001,25(4):402
[8]Beerman I,Maloney WJ,Weissmann IL,et al.Stem cells and the aging hematopoietic system[J].Curr Opin Immunol,2010,22(4):500
[9]段小兵,关方霞,邓晓辉,等.海洋单细胞海藻体外对人脑胶质瘤干细胞生物学活性的影响[J].中国组织工程研究与临床康复,2011,15(23):4215
[10]Gu Z,Tan W,Feng G,et al.Wnt/β-catenin signaling mediates the senescence of bone marrow-mesenchymal stem cells from systemic lupus erythematosus patients through the p53/p21 pathway[J].Mol Cell Biochem,2014,387(1/2):27
[11]Jackstadt R,Jung P,Hermeking H.AP4 directly downregulates p16 and p21 to suppress senescence and mediate transformation[J].Cell Death Dis,2013,4:e775
[12]Krishnamurthy J,Ramsey MR,Ligon KL,et al.p16INK4a induces an age-dependent decline in islet regenerative potential[J].Nature,2006,443(7110):453
[13]闫海龙,龚勇珍.氧化应激及p16 和p53/p21 与细胞衰老关系的研究进展[J].医学综述,2011,17(5):682
