五种昆虫多糖的体外抗氧化活性
2015-12-03陈智勇
何 钊,李 娴,孙 龙,陈智勇,冯 颖
(中国林业科学研究院资源昆虫研究所,国家林业局资源昆虫培育与利用实验室,昆明 650224)
自由基是生物体新陈代谢过程中产生的一类可以单独存在、具有高度氧化活性、带有一个或几个不配对电子的原子团或原子,其化学性质相当活跃(Mcclements et al.,2009)。生物体内一定的自由基水平是维持正常生命活动所必须的,其与细胞的增殖、分化、凋亡、坏死等多种生理、病理现象密切相关(Zhang et al.,2009)。机体的氧化与抗氧化在正常情况下处于一种动态的平衡之中,各种外源性和内源性的氧化应激均会影响动物体内自由基稳定平衡性动态(Gulcin et al.,2012),如果自由基产生过多或清除过少机体内就会有剩余自由基,自由基及其代谢产物积累过多可引起细胞代谢功能障碍及损伤,过量的自由基攻击DNA、蛋白质和碳水化合物等生物大分子,产生多种不良后果(如肿瘤、畸形及衰老等)(Asker et al.,2009;Jia et al.,2009)。由于天然抗氧化剂能够减少自由基对人体的损伤及减缓慢性疾病的发生,维持细胞和机体的健康,而且在安全性方面天然抗氧化剂比合成抗氧化剂更具有优势,近几年来对其研究日益重视(Xu et al.,2009)。
目前已证实具有抗氧化活性的物质有来源于植物、动物、微生物的黄酮、多酚、多肽及生育酚和维生素C(Vc)等(Song et al.,2009;Gulcin et al.,2012;Li et al.,2013),其中也包括多糖。多糖是广泛存在于自然界的天然高分子化合物,具有增强机体免疫、抗肿瘤、降血糖、抗衰老等多种生物活性(何钊等,2008)。近年来对植物源多糖和真菌源多糖的自由基清除、抗氧化功效日益受到关注(方积年等,2007)。如灵芝多糖(Youguo et al.,2009)能明显增加小鼠血液中的SOD 含量和谷胱甘肽酶的活力,银耳多糖(吴琼等,2009)可抑制自由基过氧化作用,铁皮石斛多糖(何铁光等,2007)可以降低自由基和H2O2诱发的小鼠肝组织丙二醛的生成。与其它生物多糖相比,对昆虫来源多糖研究相对较少,但已有的研究发现昆虫多糖与其他多糖一样具有一定的生物活性,如白蜡虫雌Ericerus pela Cavannes成虫(冯颖等,2006a,2006b;何钊等,2008)多糖由水提醇沉制备,主要单糖组成为甘露糖、葡萄糖及半乳糖等组成,是白蜡虫具有提高免疫作用的成分之一,碱提的家蚕Bombyx mori L.蛹多糖(孙龙等,2006)具有非特异免疫、细胞免疫及体液免疫功能,美洲大蠊Periplaneta americana L.多糖(孙龙等,2009)具有非特异性免疫及体液免疫功能;黄粉虫Terebrio molitor L.多糖(何钊等,2011)的提取及抗氧化研究发现其多糖具有抗氧化作用。本文对传统资源昆虫白蜡虫雌成虫、家蚕蛹、药用昆虫美洲大蠊、喙尾琵甲Blaps rhynchopetera F.及可人工养殖的蝗虫Hieroglyphus annulicornis 等5种昆虫多糖进行体外抗氧化活性研究,为开发和利用昆虫来源多糖、拓宽昆虫资源利用途径提供基础。
1 材料与方法
1.1 仪器
Varioskan Flash 多功能读数仪(美国Thermo scientific)、二氧化碳培养箱(美国 Thermo scientific)、细胞活力计数仪(美国Beckman)
1.2 材料与试剂
原料:白蜡虫雌成虫、蝗虫、美洲大蠊、喙尾琵甲、家蚕蛹通过水提醇沉制备(孙龙等,2007;何钊等,2008;孙龙等,2009),超滤浓缩(NW=3000),Sevag 法脱蛋白后冷冻干燥得到白蜡虫多糖、蝗虫多糖、美洲大蠊多糖、琵甲多糖及蚕蛹多糖。
试剂:二苯代苦味肼基自由基(DPPH·)、三吡啶三吖嗪(tripyridyl-triazine,TPTZ)(美国Sigma),Dulbecco's modified Eagle's medium(DMEM)高糖培养基(美国Gibco),胎牛血清(美国Hyclon),胰蛋白酶(美国Amresco),磷酸盐缓冲液(PBS)(美国Hyclon),甲基噻唑基四唑溴盐(MTT)(美国Amresco),二甲基亚砜(DMSO)(美国Amresco),其余均为国产分析纯。人神经母细胞瘤细胞(SH-SY5Y)购至中国科学院昆明动物研究所。
1.2 实验方法
1.2.1 铁离子总还原/抗氧化能力(Ferric reducing/antioxidant power,FRAP 法)
FRAP 试剂:10 mmol/L 的TPTZ(用40 mmol/L盐酸溶解),20 mmol/L 的FeCl3·6H2O 和pH 3.6的乙酸缓冲液以1∶1∶10 的体积比混匀,在37℃下保温备用(Benzie et al.,1996)。
标准曲线的绘制:分别吸取0.1 mL 不同浓度的FeSO4溶液,各加入3.9 mL FRAP 试剂,混匀后37℃下反应10 min,测定593 nm 下吸光值。以吸光度为纵坐标,FeSO4浓度为横坐标,绘制标准曲线。
样品测定:0.1 mL 不同浓度(0.05-1.0 mg/mL)样品稀释液,加入3.9 mL FRAP 试剂,混匀后37℃反应10 min,593 nm 下测定吸光值。以去离子水作为空白对照,样品还原能力以达到同样吸光度所需的FeSO4的摩尔浓度表示。
1.3.2 清除DPPH·自由基
0.4mmol/L DPPH·乙醇溶液0.2 mL 与1.0 mL不同浓度(0.05-1.0 mg/mL)的样品混和,再加2 mL 去离子水,充分混匀后在暗处静置30 min,517 nm 处测定其吸光度。清除率计算公式为:清除率(%)=[A0-(Ai-Aj)]/A0×100%,式中Ai为样品与DPPH·反应后体系的吸光度;Aj为样品本身吸光度(以0.2 mL 乙醇替代DPPH·);A0为未加样品空白值(以去离子水替代样品)的吸光度(Dasgupta et al.,2004)。
1.3.3 清除·OH 自由基
采用Fenton 反应产生羟自由基,反应体系中含0.5 mL 8.8 mmol/L H2O2,0.5 mL 9 mmol/L FeSO4、0.5 mL 9 mmol/L 水杨酸-乙醇溶液、不同浓度(0.05-1.0 mg/mL)多糖4 mL,混匀后加0.5 mL 9mmol/L H2O2启动反应,37℃水浴反应30 min,在510 nm 下测量吸光值。清除率计算公式为:·OH 清除率(%)=[A0-(Ai-Aj)]/A0×100%,式中,A0为未加样品(以去离子水代替样品)的空白对照液吸光度;Ai为加入多糖溶液后反应体系的吸光度;Aj为不加H2O2的多糖溶液(以去离子水代替H2O2)本底吸光度(杨江涛等,2008)。
1.3.4 清除超氧阴离子(O2-·)活性
采用邻苯三酚自氧化法测定清除O2-·活性。50 mmol/L Tis-HCl 缓冲液(pH=8.0,含1 mM EDTA)2.8 mL 与0.1 mL 各浓度(1-10 mg/mL)样品混和,置于25℃水浴中预热20 min,再加入0.2 mL 6 mmol/L 邻苯三酚溶液(以10 mmol/L HCl 配制),迅速混匀并计时,以10 mmol/L HCL为参比,325 nm 处每隔30 s 测定反应体系的吸光值,共记录前4 min,计算吸光度值随时间的变化值(邻苯三酚自氧化速率)。清除率计算公式为:O2-·抑制率(%)=(1-样品自氧化速率/空白自氧化速率)×100%(何钊等,2011)。
1.3.5 对H2O2氧化损伤细胞模型的保护作用
人神经母细胞瘤细胞(SH-SY5Y)采用含10% 胎牛血清的DMEM 培养液、于37℃、5%CO2、95%空气、饱和湿度的CO2培养箱中培养,0.25%胰酶消化传代,选取对数生长期细胞进行实验。96 孔培养板中加入6×105cells/mL 浓度的对数生长期细胞(200 μL/孔),培养24 h 后吸弃上清液,加入200 μL 含0.1、1、10、100 及1000 μg/mL 的不同浓度多糖样品培养基(200 μL/孔),每个浓度设4个平行孔,同时设正常对照组(未损伤细胞)、模型组(细胞损伤、未给药加入等量培养基),200 μg/mL 维生素C 为阳性组。各组细胞培养24 h 后取出吸弃上清液,用磷酸盐缓冲液清洗一遍,每孔加入200 μL、含800 μmol/L H2O2的DMEM 培养液,处理1h 后加入MTT 溶液(5 mg/mL,20 μLμg/孔)培养4 h,吸弃上清液,加入150 μL/孔DMSO,振荡15 min,570 nm 波长测定各孔吸光度,按照公式:细胞相对存活率(%)=(样品孔吸光度/未损伤对照孔吸光度)×100%计算细胞相对存活率,根据细胞相对存活率的高低确定抗氧化能力的强弱,细胞存活率高,即多糖抗氧化能力较强(Cho et al.,2008)。
1.4 数据处理
抗氧化试验均重复三次,由Excel 2003 软件处理数据,结果以±s 表示,组间差异进行方差分析。
2 结果与分析
2.1 5种昆虫多糖的铁离子总还原/抗氧化能力
5种多糖的铁离子总还原能力如图1 所示,在试验浓度条件下5种昆虫多糖均表现出了还原能力,总还原能力与浓度呈正相关,且具有较好的线性关系。但各种昆虫多糖的总还原能力有一定的差异,其中白蜡虫多糖的总还原能力在这5种昆虫多糖中最强,蚕蛹多糖的总还原能力最弱,5种多糖间的总还原能力具有显著性差异(P<0.05),相同浓度下各昆虫多糖总还原能力顺序为白蜡虫多糖>琵甲多糖>蝗虫多糖>美洲大蠊多糖>蚕蛹多糖。
2.2 5种昆虫多糖清除DPPH·自由基能力

图1 昆虫多糖的还原力Fig.1 Ferric reducing power of insect polysaccharides at different concentrations
5种多糖对DPPH 自由基清除能力如图2 所示,5种昆虫多糖均显示了一定的对DPPH·清除能力,随着多糖浓度的升高,对DPPH·清除能力增加,且各多糖间对DPPH·清除能力有一定差别。根据各多糖对DPPH·产生50% 清除效果(IC50值)所需浓度量来判断各多糖对DPPH·的清除能力为:白蜡虫多糖(IC50为0.28 mg/mL)>琵甲多糖(IC50为0.4 mg/mL)>美洲大蠊多糖(IC50为0.49 mg/mL)>蝗虫多糖(IC50为0.60 mg/mL)>蚕蛹多糖(IC50>1.0 mg/mL);蚕蛹多糖的对DPPH·清除能力最弱,试验范围内其对DPPH·的清除率均低于20%,而其余4种昆虫多糖的清除效果较为接近。

图2 昆虫多糖对DPPH·清除能力Fig.2 The scavenging activity on DPPH·of insect polysaccharides
2.3 5种昆虫多糖清除羟(·OH)自由基能力
5种多糖对羟自由基的清除能力如图3 所示,5种昆虫多糖对羟自由基的清除能力随浓度的增加而增强,当多糖浓度大于0.5 mg/mL 琵甲多糖、美洲大蠊多糖及蚕蛹多糖清除羟自由基能力逐渐达到饱和,变化趋缓;当多糖浓度达到1.0 mg/mL时,蚕蛹多糖、美洲大蠊多糖和琵甲多糖对羟自由基的清除率均接近100%。根据各多糖对羟自由基产生50%清除效果所需量(IC50)来判断,各多糖对·OH 的清除能力为蚕蛹多糖(IC50为0.22 mg/mL)>白蜡虫多糖(IC50为0.27 mg/mL)>美洲大蠊多糖(IC50为0.28 mg/mL)>琵甲多糖(IC50为0.34 mg/mL)>蝗虫多糖(IC50>1.0 mg/mL),且蚕蛹多糖、白蜡虫多糖、琵甲多糖及美洲大蠊多糖的IC50较为接近;蝗虫多糖的清除能力最弱,在试验范围内其对羟自由基的清除能力低于50%,表明其对羟自由基的清除能力不明显。

图3 昆虫多糖对羟自由基的清除作用Fig.3 The scavenging activity of different polysaccharides on hydroxyl radicals
2.4 5种昆虫多糖对超氧阴离子(O2-·)抑制能力
图4 为5种昆虫多糖对超氧阴离子清除效果,由图可知5种多糖对超氧阴离子有一定的清除作用,随浓度增加清除效果有一定的提升。其中美洲大蠊多糖的对超氧阴离子清除能力相对最强,琵甲多糖、蝗虫多糖及蚕蛹多糖清除效果较弱;在实验范围内,只有美洲大蠊多糖对超氧阴离子清除率能达到50%以上,其余均低于50%,说明几种多糖对超氧阴离子的清除作用不明显。

图4 昆虫多糖对超氧阴离子清除作用Fig.4 The scavenging activity of different polysaccharides on superoxideradicals
2.5 昆虫多糖对H2O2损伤细胞保护作用
采用H2O2损伤人神经母细胞瘤细胞造模,正常组(即未损伤组)细胞相对存活率为100%,H2O2损伤后的SH-SY5Y 细胞存活率为61.8±8.8%,明显低于正常对照组(P<0.01),阳性对照200 μg/mLVc 能显著增加H2O2氧化损伤的细胞相对存活率(84.0%±4.4%,P<0.01),对模型细胞显示出较好的抗氧化活性,表明本评价体系可行。
5种多糖在本文造模条件下,对过氧化氢损伤细胞保护作用结果见图5,图中0 μg/mL 多糖浓度组即为模型组(未给药)。白蜡虫多糖和美洲大蠊多糖在试验浓度较高的1000 μg/mL 条件下能够增加损伤细胞的存活率,但在其它浓度条件下的损伤细胞存活率没有提高;蚕蛹多糖仅在低浓度的0.1 μg/mL 条件下能增加细胞存活率,浓度增加存活率反而下降;琵甲多糖在1-1000 μg/mL 浓度范围均能增加细胞存活率,且1-10 μg/mL 存活率高于100-1000 μg/mL 浓度;蝗虫多糖在1-100 μg/mL 范围内细胞存活率增加,其它浓度下损伤细胞存活率没有增加。试验结果表明,5种昆虫多糖对过氧化氢损伤的细胞均有一定保护作用,可提高损伤细胞的存活率,但作用浓度范围及保护程度上存在一定差异,且量效关系不明显。
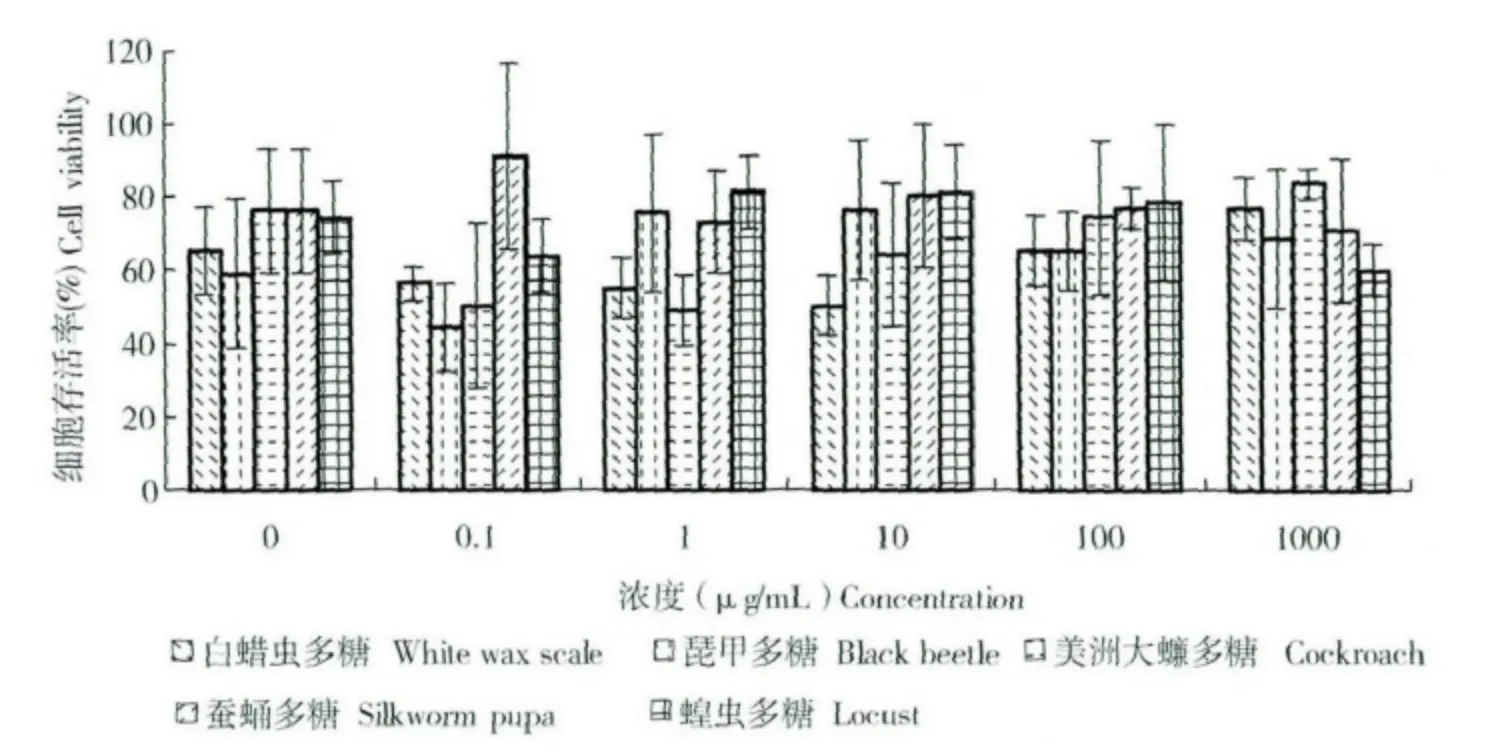
图5 昆虫多糖对H2O2损伤细胞保护作用Fig.5 Inhibition of H2O2-induced cell death by insect polysaccharides
3 结论与讨论
通过化学抗氧化和细胞抗氧化两种体外抗氧化性能试验显示,5种昆虫多糖对不同的自由基体系呈现出了清除活性,对过氧化氢损伤的人神经母细胞瘤细胞细胞均有一定保护作用,研究结果表明昆虫多糖与其它来源多糖类似具有较好的抗氧化活性,经过深入研究可作为天然抗氧化剂利用。
多糖的结构与其抗氧化活性具有相关性(Synytsya et al.,2013),如分子量越小的多糖抗氧化活性越强,从绿茶中分离得到3种杂多糖(Chen,2008),其中分子量最小的多糖抗氧化能力显著高于其它分子量较大的两种多糖;另外多糖分子中所含有吸电子基团影响清除自由基能力,如枸杞中提取的各多糖组分在清除自由基能力上强弱不一,除分子量外还受糖醛酸含量等多种因素影响(Lin,2009)。5种昆虫多糖来源不同且具有不同的化学结构,其中白蜡虫多糖的单糖组成为葡萄糖、半乳糖和甘露糖(何钊等,2008);美洲大蠊多糖的单糖组成以甘露糖、葡萄糖和半乳糖为主,含少量木糖、阿拉伯糖及葡萄糖醛酸、半乳糖醛酸(孙龙等,2009);蚕蛹多糖以葡萄糖为主含少量鼠李糖、甘露糖、半乳糖及葡萄糖醛酸(孙龙等,2007);琵甲多糖含阿拉伯糖、葡萄糖、鼠李糖半乳糖及葡萄糖醛酸(孙龙,2007)。5种昆虫多糖在各体外抗氧化活性检测中呈现一定的差异,应与这5种多糖的单糖组成、结构等化学性质有关。
体外抗氧化作用评测的机理多样,FRAP 和DPPH 法属于基于电子转移(SET)方法,羟自由基和超氧自由基活性氧自由基方法,其它还有基于原子转移(HAT)方法;而对过氧化氢损伤细胞保护作用为细胞抗氧化,为检测抗氧化活性的生物类方法(Gulcin et al.,2012)。由于体外检测的机理不同,在研究中需要通过多种方法联合检测才能全面准确评价待测物的抗氧化性能,以确保结果的可靠。
本文中5种昆虫多糖的体外抗氧化相对维生素C 效果要弱,对过氧化氢损伤的细胞均有一定保护作用,但作用浓度范围及保护程度上存在一定差异,且量效关系不明显。分析其原因可能是维生素C 和昆虫多糖的抗氧化机理上存在差异,也可能是由于提取物中有效活性物质含量较低造成的。对挂金灯Physalis alkekengi var.francheti 中的多糖进行提取分离并进行体外抗氧化活性研究表明,分离提纯后的各多糖组分抗氧化活性显著高于粗多糖(Ge et al.,2009)。Sun 等(2009)将紫球藻Porphyridium cruentum 中提取的多糖降解为不同分子量组分,对降解后各组分及原始提取多糖的抗氧化活性进行了比较,发现原始提取多糖无显著抗氧化活性,而降解后小分子量多糖均显著地具有不同程度的抗氧化活性,并认为多糖具有抗氧化活性是由分子量、多糖所带基团等多个因素共同作用的结果。由此分析5种昆虫多糖的体外抗氧化活性差异应与其纯度和结构等有关,分离纯化后抗氧化能力能否进一步提升以及测定各多糖结构确定与抗氧化能力的差异尚待研究。
References)
Asker MMS,Ahmed YM,Ramadan MF.Chemical characteristics and antioxidant activity of exopolysaccharide fractions from Microbacterium terregens[J].Carbohydrate Polymers,2009,77(3):563-567.
Benzie IF,Strain JJ.The ferric reducing ability of plasma(FRAP)as a measure of“antioxidant power”:the FRAP assay[J].Analytical Biochemistry,1996,239(1):70-76.
Dasgupta N,De B.Antioxidant activity of Piper betle L.leaf extract in vitro[J].Food Chemistry,2004,88(2):219-224.
Chen H,Zhang M,Qu Z,et al.Antioxidant activities of different fractions of polysaccharide conjugates from green tea(Camellia Sinensis)[J].Food Chemistry,2008,106(2):559-563.
Cho ES,Lee KW,Lee HJ.Cocoa procyanidins protect PC12 cells from hydrogen-peroxide-induced apoptosis by inhibiting activation of p38 MAPK and JNK[J].Mutation Research,2008,640(1):123-130.
Dasgupta N,De B.Antioxidant activity of Piper betle L.leaf extract in vitro[J].Food Chemistry,2004,88(2):219-224.
Fang JN,Dingf K.Bioactivities,isolation and purification methods of polysaccharide[J].Chinese Journal of Natural Medicines,2007,5(5):338-347.[方积年,丁侃.天然药物——多糖的主要生物活性及分离纯化方法[J].中国天然药物,2007,5(5):338-347]
Feng Y,Chen XM,Ma Y,et al.Experimental study on immunomodulation of white wax scale(Ericerus pela Chavannes)[J].Forest Resarch,2006,19(2):221-224.[冯颖,陈晓鸣,马艳,等.白蜡虫免疫调节作用试验研究[J].林业科学研究,2006,19(2):221-224]
Feng Y,Chen XM,He Z,et al.Antimutation experiment of white wax scale(Ericerus pela)and analysis of main function factors[J].Forest Resarch,2006,19(3):284-288.[冯颖,陈晓鸣,何钊,等.白蜡虫抗突变实验与主要功效成分分析[J].林业科学研究,2006,19(3):284-288]
Ge Y,Duan Y,Fang G,et al.Polysaccharides from fruit calyx of Physalis alkekengi var.francheti:Isolation,purification,structural features and antioxidant activities[J].Carbohydrate Polymers,2009,77(2):188-193.
Gulcin I.Antioxidant activity of food constituents:an overview[J].Arch.Toxicol.,2012,86(3):345-391.
He TG,Yang LT,Li YR,et al.Effects of the polysaccharides DCPP1a-1 from suspension-cultured protocorm s of Dendrobium candidum on oxygen radical and lipid peroxidation[J].Natural Product Research and Development,2007(3),19:410-414.[何铁光,杨丽涛,李杨瑞,等.铁皮石斛原球茎多糖DCPP1a-1 对氧自由基和脂质过氧化的影响[J].天然产物研究与开发,2007,19(3):410-414]
He Z,Sun L,Feng Y,et al.The extraction of polysaccharide from white wax scale and analysis of monosaccharide compositions[J].Forest Research,2008,21(6):792-796.[何钊,孙龙,冯颖,等.白蜡虫多糖的提取及单糖组分分析[J].林业科学研究,2008,21(6):792-796]
He Z,Feng Y,Sun L,et al.Optimization of extraction process by using response surface methodology and antioxidant activity of polysaccharide from yellow mealworm[J].Journal of Food Science and Biotechnology,2011,30(5):641-647.[何钊,冯颖,孙龙,等.黄粉虫多糖响应面法提取及抗氧化活性[J].食品与生物技术学报,2011(5):641-647]
Jia J,Zhang X,Hu Y,et al.Evaluation of in vivo antioxidant activities of Ganoderma lucidum polysaccharides in STZ-diabetic rats[J].Food Chemistry,2009,115(1):32-36.
Li CX,Li FX,Li P,et al.Study on Antioxidant activity of flavonoids from Sophora japonica Linn leaves[J].Natural Product Research Development,2013,25(5):676-680.[李彩霞,李复兴,李鹏,等.国槐叶黄酮的抗氧化活性研究[J].天然产物研究与开发,2013,25(5):676-680]
Lin CL,Wang CC,Chang SC,et al.Antioxidative activity of polysaccharide fractions isolated from Lycium barbarum Linnaeus[J].International Journal of Biological Macromolecules,2009,45(2):146-151.
Mcclements DJ,Decker EA.Lipid oxidation in oil-in-water emulsions:impact of molecular environment on chemical reactions in heterogeneous food systems[J].Journal of Food Science,2000,65(8):1270-1282.
Song YX,Wang CQ,Zhang GH,et al.Study on antoxidation effect of collagen peptide with different components[J].Natural Product Research Development,2009,21(3):388-390.[宋育璇,王常青,张国华,等.不同组分胶原多肽抗氧化作用的比较研究[J].天然产物研究与开发,2009,21(3):388-390]
Sun L.Studies on the Isolationand Purification of Polysaccharides from Three Insects and Their Immunomodulating Activities[D].Beijing:Chinese Academy of Forestry,2007.[孙龙.三种昆虫多糖的分离纯化与免疫活性研究[D].北京:中国林业科学研究院,2007]
Sun L,Feng Y,He Z,et al.Studies on alkaline solution extraction of polysaccharide from silkworm pupa and its immunomodula tingactivities[J].Forest Research,2007,20(6):782-786.[孙龙,冯颖,何钊,等.蚕蛹多糖的碱液提取及免疫活性初步研究[J].林业科学研究,2007,20(6):782-786]
Sun L,Feng Y,He Z,et al.Study on extraction,analysis of water soluble polysaccharide from cockroaches and its immunologic activities[J].Forest Research,2009,22(2):256-261.[孙龙,冯颖,何钊,等.蟑螂水溶性多糖提取、分析及免疫活性研究[J].林业科学研究,2009,22(2):256-261]
Sun L,Wang C,Shi Q,et al.Preparation of different molecular weight polysaccharides from Porphyridium cruentum and their antioxidant activities.[J].International Journal of Biological Macromolecules,2009,45(1):42-47.
Synytsya A,Novak M.Structural diversity of fungal glucans[J].Carbohydrate Polymer,2013,92(1):792-809.
Wu Q,Dai YG,Gao CC,et al.Antioxidations of acid-degrade water-soluble Polysaccharides from Tremella fuciformis[J].Food Science,2009,30(13):93-96.[吴琼,代永刚,高长城,等.酸降解水溶性银耳多糖及抗氧化作用研究[J].食品科学,2009,30(13):93-96]
Xu W,Zhang F,Luo Y,et al.Antioxidant activity of a water-soluble polysaccharide purified from Pteridium aquilinum[J].Carbohydrate Research,2009,344(2):217-222.
Yang HT,Yang J,Xie H,et al.The antioxidantive activities of crude and pure polysaccharides from Rosa roxburghii in vitro[J].Science and Technology of Food Industry,2008,29(2):94-96.[杨江涛,杨娟,谢红,等.刺梨多糖粗品与纯品体外抗氧化作用[J].食品工业科技,2008,29(2):94-96]
Youguo C,Zongji S,Xiaoping C.Modulatory effect of Ganoderma lucidum polysaccharides on serum antioxidant enzymes activities in ovarian cancer rats[J].Carbohydrate Polymers,2009,78(2):258-262.
Zhang Q,Zhang Z,Cheung H,et al.Antioxidant activity of Rhizoma smilacis Glabrae extracts and its key constituent-astilbin[J].Food Chemistry,2009,115(1):297-303.
