棉铃虫β-catenin 基因的克隆、表达分析及真核表达载体构建
2015-12-03徐卫华
陈 伟,徐卫华
(1.广东药学院生命科学与生物制药学院,广东省生物技术候选药物研究重点实验室,广州 510006;2.中山大学生命科学学院,有害生物控制与资源利用国家重点实验室,广州 510275)
β-连环蛋白(β-catenin)是一个多功能蛋白,它可以作为细胞骨架蛋白,与E-cadherin 形成复合体,介导细胞间的粘附作用。此外,更为科研工作者所关注的是其在Wnt/β-catenin 信号通路中的作用(Bienz,2005)。β-catenin 是Wnt/β-catenin 信号通路的重要成员,该通路的活性取决于细胞质中自由β-catenin 的多少,自由的β-catenin 可以由细胞质进入细胞核,与T 细胞因/淋巴细胞增强结合因子(TCF/LEF)结合而活化下游靶标基因的转录(Schuijers et al.,2014)。Wnt/β-catenin 信号通路是当前生物学研究的热点之一,该通路在调节细胞增殖、胚胎发育和肿瘤的发生发展方面起着重要的生物学作用(Logan and Nusse,2004;Clevers and Nusse,2012)
棉铃虫Helioverpa armigera 是一种世界性的农业害虫,其危害的经济作物较多,每年给全球农业造成很大的经济损失。棉铃虫以多种方式适应外界恶劣的环境条件,滞育是其中一种重要的方式(徐卫华,2008)。滞育是指昆虫发育的停滞,其重要的特征是发育缓慢、代谢速率下降以及抗逆性增强(Denlinger,2002)。滞育并非发育的完全停止,而是另外一种特殊的发育状态,滞育过程中部分基因的表达下降,也有部分基因的表达上升(Lu and Xu,2010;Bao and Xu,2011)。对棉铃虫滞育进行研究,有较大的理论意义和应用价值。棉铃虫滞育的激素调节已经研究得比较透彻,但从分子水平阐述滞育机制的研究较少(朱佳等,2010)。鉴于Wnt/β-catenin 信号通路在发育中的重要作用,我们通过克隆β-catenin 基因并比较分析滞育和非滞育蛹脑中β-catenin 基因的表达水平变化,试图窥探Wnt/β-catenin 信号通路是否在棉铃虫滞育过程中起作用。
本研究首先运用 RACE 技术(rapid-amplification of cDNA ends)首次克隆了棉铃虫的β-catenin 基因,分析了其在滞育和发育蛹脑的差异表达情况,并构建真核表达质粒,为进一步研究Wnt/β-catenin 信号通路在棉铃虫发育过程中的作用奠定基础。
1 材料与方法
1.1 实验昆虫
棉铃虫为本课题组所饲养,品系由南京农业大学苏建亚教授提供,原产河南省。保种用的棉铃虫一直在25oC,14L∶10D(光照:黑暗)的条件下饲养。滞育型棉铃虫的1-3 龄幼虫在25oC 条件下培养,光照条件设定为14L∶10D;生长到3 龄末期,将其转移到20oC 恒温培养箱,光照条件为10L∶14D。非滞育型棉铃虫的饲养过程与滞育型相同,差别在于其光照条件一直保持在光照14 h。
1.2 菌株、载体、细胞和试剂
大肠杆菌DH5α、昆虫表达载体pIZ/v5-GFP、美洲棉铃虫Helioverpa zea 的卵巢细胞HzAm1均为本实验室保存;pMD18-T 载体、Taq DNA polymerase 及限制性核酸内切酶购自Takara 公司;RACE 试剂盒购自Clontech 公司;M-MLV 反转录试剂盒购自Promega 公司;Trizol ® Reagent 购自Invitrogen 公司;质粒DNA 小量提取试剂盒、DNA产物纯化试剂盒购自爱思进生物技术有限公司;蛋白Marker、HRP 偶联的羊抗兔二抗以及Western blot 所用发光液均购自Thermo 公司。其它试剂均为分析纯(A.R.)。
1.3 引物设计和合成
本研究所用的引物,由英潍捷基(上海)贸易有限公司合成。具体序列及说明见表1。设计简并引物时,参考已报道的棉铃虫近缘物种序列,如家蚕Bombyx mori,帝王蝶Danaua plexippus 和烟草天蛾Manduca sexta,找到保守的DNA 序列,以此设计简并引物。原则是尽量选用包含简并碱基少的序列,引物长度为16-18 碱基。
1.4 总RNA 的提取及cDNA 第一链的合成
按照试剂盒提供的方法,取一定量的组织,加入1 mL Trizol 进行匀浆,提取总RNA。取1 μg RNA 进行逆转录,合成第一链cDNA。
1.5 RACE
按照试剂盒提供的说明,使用特定的接头作为反转录引物,取1 μg RNA 为模板,分别合成5'-RACE-Ready cDNA 和3'-RACE-Ready cDNA。用基因特异性引物和试剂盒提供的UPM 引物进行第一轮PCR 扩增;扩增产物稀释后作为模板,以基因特异性引物和试剂盒提供的NUP 引物进行第二轮PCR 扩增。扩增后的片段与pMD18-T 载体连接,转化大肠杆菌DH5α,鉴定正确后测序分析。
1.6 序列分析
利用 DNAStar 对序列进行分析和预测β-catenin 的ORF(开放阅读框)。用MEGA 6.06软件进行遗传距离分析,并用Maximum liklihood法构建系统进化树。
1.7 棉铃虫蛹脑中β-catenin 的表达分析
取15个蛹脑,按照1.4 的方法合成第一链cDNA,PCR 检测β-catenin 的表达情况,以RpL32 作为内参对照。
1.8 真核表达载体的构建
设计引物,正向引物带BamHI 酶切位点,反向引物带XbaI 酶切位点,PCR 扩增β-catenin 编码区全长。用BamHI 和XbaI 对扩增产物进行双酶切后,与同样双酶切的pIZ/v5-GFP 载体进行连接。转化大肠杆菌DH5α,鉴定后进行测序确认。
1.9 细胞培养、转染及细胞定位研究
HzAm1 是一种半贴壁细胞,培养所需的培养基为含10%胎牛血清的Grace's 昆虫培养基。在不含CO2的27℃细胞培养箱中进行培养。24 孔板中细胞密度约90%时进行转染,48 h 后按1∶1000 的比例加入5 mg/mL Hoechst 33342 染料,染核10 min后在倒置荧光显微镜下观察融合蛋白的表达情况,根据细胞核的位置判断目的蛋白的亚细胞定位。
1.10 Western blot 检测
转染48 h 后,提取蛋白,用Bradford 法测定蛋白浓度。取10 μg 蛋白上样电泳,100 v 转膜1 h。5% 脱脂牛奶室温封闭1 h 后分别用V5 标签抗体(1∶5000)和二抗(1∶3000)进行孵育,最后进行曝光显影。

表1 本研究所用到的引物Table 1 Primers used in this study
2 结果与分析
2.1 棉铃虫β-catenin 基因的克隆与氨基酸序列分析
根据近缘物种的β-catenin 基因序列,设计了两对简并引物。利用巢式PCR 的方法,扩增出了一条约700 bp 的条带,大小与预期相符(图1A)。对该片段测序分析,发现其与近缘物种的相似度较高。根据测定的序列设计基因特异性引物,进行3'-Race 和5'-Race,分别获得了1611 bp和942 bp 的条带(图1B 和1C)。测序后进行拼接,获得了棉铃虫β-catenin 基因的全长cDNA 序列,命名为Har-β-catenin(Genbank 登录号为KJ206237)。
Har-β-catenin 全长2682 bp,其中开放阅读框2382 bp,编码一个793 aa 的蛋白质,预测其分子量为86.7 kDa(图2)。已报道的β-catenin 蛋白的一个共同特征是具有多个ARM 重复结构域(Armadillo/β-Catenin-like repeats),将预测的棉铃虫β-catenin 蛋白质序列提交在线蛋白质分析工具ExPASy(http://prosite.expasy.org/)进行分析,结果也找到了多个ARM 重复结构域(图2),这说明β-catenin 蛋白是一个在生物进化上非常保守的蛋白质。

图1 Har-β-catenin 基因扩增产物的琼脂糖凝胶电泳分析Fig.1 Analysis of PCR products of Har-β-catenin by agarose gel electrophoresis
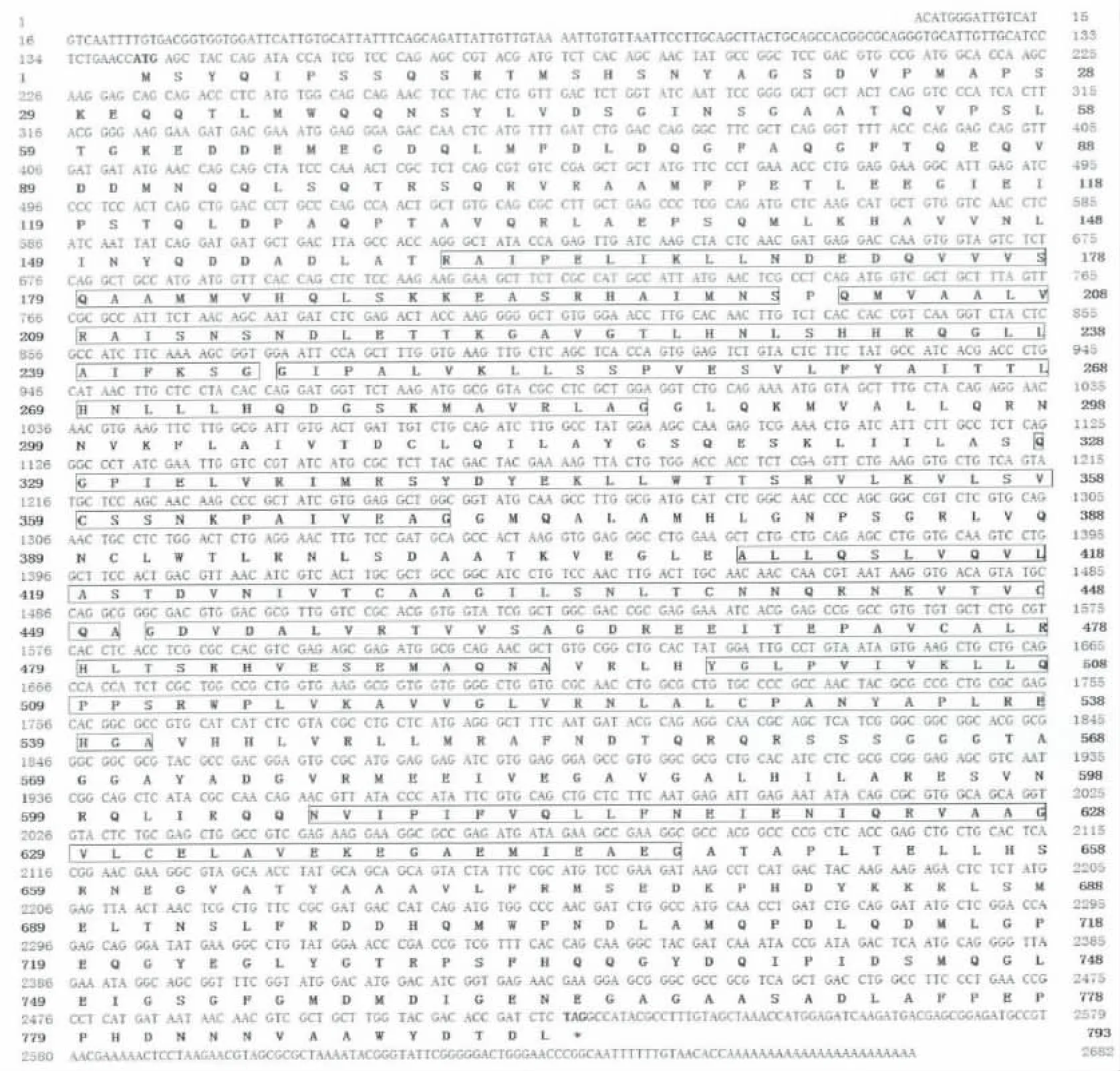
图2 Har-β-catenin cDNA 序列及推测的氨基酸序列Fig.2 cDNA and the duduced amino acid sequences of Har-β-catenin
2.2 棉铃虫β-catenin 与其它昆虫β-catenin 的系统进化分析
运用MEGA 6.06 软件对棉铃虫和其它已报道的部分昆虫β-catenin 进行系统进化树的分析,结果表明棉铃虫首先与家蚕聚到一起,然后与帝王蝶聚为一支。该支与蝇科的果蝇和家蝇、实蝇科的地中海实蝇Ceratitis capitata、蚊科的埃及伊蚊Aedes aegypti 和致倦库蚊Culex quinquefasciatus 有较近缘的关系,最后聚为一大支(见图3)。
2.3 Har-β-catenin 在滞育和发育蛹脑中的表达变化
选取化蛹后0、5、10 和15 d 的棉铃虫,利用RT-PCR 检测Har-β-catenin 基因在棉铃虫滞育蛹脑和非滞育蛹脑中的差异表达情况,RpL32 基因作为内参对照。结果表明,Har-β-catenin 在两种发育状态的蛹脑中均有表达。如图4B 所示,非滞育蛹脑中Har-β-catenin 的表达量较高,且随着发育的进行表达量逐步上升,而滞育蛹脑中的表达较低。
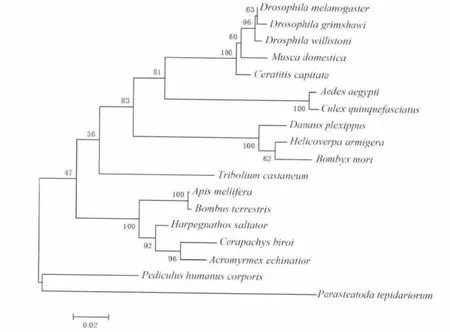
图3 Har-β-catenin 与其它昆虫β-catenin 的系统进化树Fig.3 Phylogenetic analysis based on amino acid sequences of Har-β-catenin protein
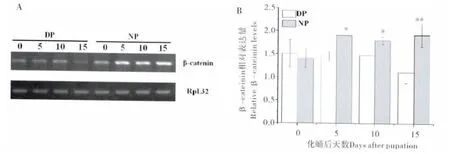
图4 Har-β-catenin 在棉铃虫蛹脑中的表达变化Fig.4 Expression pattern of Har-β-catenin in brains of Helicoverpa armigera
2.4 Har-β-catenin 真核表达质粒的构建及亚细胞定位研究
为了进一步研究棉铃虫β-catenin 基因的功能,构建了Har-β-catenin 的真核表达载体。验证正确的质粒转化棉铃虫HzAm1 细胞,用识别载体本身表达的V5 序列的标签抗体进行Western blot发现,在稍小于140 kDa 处有一条特异的条带,与预期大小一致(Har-β-catenin 86.7 kDa,载体本身表达的GFP 和V5 约35 kDa),说明构建的载体可以在HzAm1 细胞中正确表达。亚细胞定位实验如图5B 所示,Har-β-catenin 主要在细胞质中表达,预示着正常培养的棉铃虫细胞Wnt/β-catenin 信号通路未被激活。
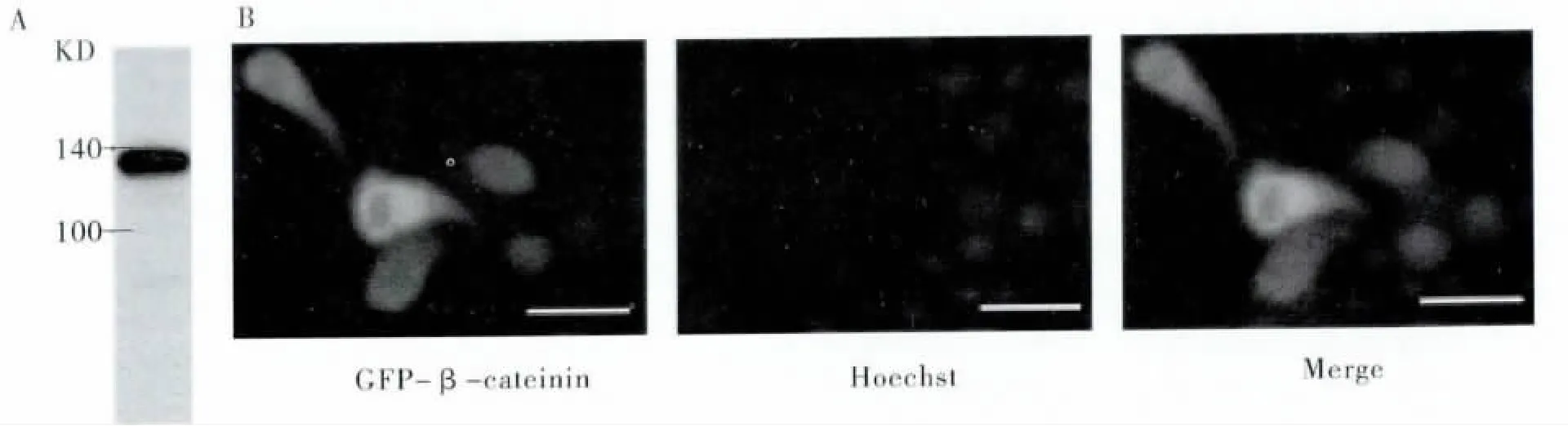
图5 Har-β-catenin 真核表达及亚细胞定位研究Fig.5 Eukaryotic expression and subcellular localization of Har-β-catenin
3 结论与讨论
β-catenin 在进化上高度保守,它是一个多功能蛋白,通过形成不同的蛋白复合物而参与调节不同的生理功能(Damalas et al.,1999)。在细胞中,β-catenin 主要参与形成两个重要的蛋白复合物(Kimelman and Xu,2006):①β-catenin 作为细胞骨架蛋白,通过α-catenin 在细胞膜处与E-cadherin(上皮细胞钙粘蛋白)形成复合物(Jou et al.,1995)。该复合物介导同质细胞间的粘附,在抑制肿瘤侵袭、防治细胞的移动等方面发挥重要的生理功能(王启明等,2006)。②β-catenin同时也是Wnt/β-catenin 信号通路中的至关重要的组分,通过与TCF/LEF 转录因子结合从而激活下游一系列靶标基因,如c-myc 和cyclin D1 等的转录。
Wnt/β-catenin 通路的框架的建立主要是源于对果蝇的研究。1991年Peifer 等人发现果蝇的armadillo 基因(β-catenin 同源基因)在Wnt/β-catenin 信号通路中起调节作用(Peifer et al.,1991)。之后该通路的其它成员也逐步被鉴定出来。目前,除了在模式生物果蝇中的研究,家蚕中β-catenin 的表达及作用也有一些报道(Dhawan and Gopinathan,2004),而其它昆虫中β-catenin的研究很少。
本研究通过分析已知的棉铃虫近缘物种β-catenin 基因的序列,设计简并引物扩增棉铃虫β-catenin 基因的中间片段,然后通过RACE 技术得到了棉铃虫β-catenin 基因的cDNA 序列。对其推导的氨基酸序列提交ExPASy 网站进行分析,发现其具有多个ARM 重复结构域。ARM 重复结构域是由约42个氨基酸组成的,一般认为该结构域作为分子适配器,协调β-catenin 蛋白之间的作用(Peifer,1995)。已报道的β-catenin 蛋白都含有多个串联的ARM 重复结构域,如人的β-catenin蛋白大小为92 kDa,含有13个ARM 重复结构域(Ilyas et al.,1997)。
克隆棉铃虫β-catenin 基因的cDNA 序列后,通过RT-PCR 的方法比较了滞育和非滞育蛹脑中β-catenin 基因的表达情况,结果表明滞育蛹脑中β-catenin 的表达水平明显低于非滞育蛹脑。这预示着非滞育蛹脑,也就是正常发育的棉铃虫蛹脑中Wnt/β-catenin 信号通路活性有可能要强于滞育蛹脑。换一句话说,有可能滞育蛹脑中Wnt/β-catenin 信号下调,从而使棉铃虫的发育受到抑制。当然,还需要进一步的证据才能确定该推论,因为β-catenin 除了在Wnt/β-catenin 信号通路中起作用外,还是细胞骨架的组成成分。在后续研究中,尚需作进一步的研究来调查棉铃虫滞育和非滞育蛹脑中Wnt/β-catenin 信号通路的活性,以确定该通路在棉铃虫滞育中的作用。
综上所述,本研究所取得的这些阶段性成果,为后续深入研究Wnt/β-catenin 信号通路在棉铃虫滞育中的作用奠定了一定的基础。
References)
Bao B,Xu W.Identification of gene expression changes associated with the initiation of diapause in the brain of the cotton bollworm,Helicoverpa armigera[J].BMC Genomics,2011,12(1):224.
Bienz M.β-Catenin:a pivot between cell adhesion and Wnt signaling[J].Current Biology,2005,15(2):R64-R67.
Clevers H,Nusse R.Wnt/β-catenin signaling and disease[J].Cell,2012,149(6):1192-1205.
Damalas A,Ben Ze'Ev A,Simcha I,et al.Excess β-catenin promotes accumulation of transcriptionally active p53[J].The EMBO Journal,1999,18(11):3054-3063.
Denlinger DL.Regulation of diapause[J].Annual Review of Entomology,2002,47(1):93-122.
Dhawan S,Gopinathan KP.Molecular cloning and expression pattern of anarmadillo homologue from the mulberry silkworm Bombyx mori[J].Gene Expression Patterns,2004,4(1):15-23.
Ilyas M,Tomlinson I,Rowan A,et al.β-Catenin mutations in cell lines established from human colorectal cancers[J].Proceedings of the National Academy of Sciences,1997,94(19):10330-10334.
Jou T,Stewart DB,Stappert J,et al.Genetic and biochemical dissection of protein linkages in the cadherin-catenin complex[J].Proceedings of the National Academy of Sciences,1995,92(11):5067-5071.
Kimelman D,Xu W.β-Catenin destruction complex:insights and questions from a structural perspective[J].Oncogene,2006,25(57):7482-7491.
Logan CY,Nusse R.The Wnt signaling pathway in development and disease[J].Annual Review of Cell and Developmental Biology,2004,20:781-810.
Lu Y,Xu W.Proteomic and phosphoproteomic analysis at diapause initiation in the cotton bollworm,Helicoverpa armigera[J].Journal of Proteome Research,2010,9(10):5053-5064.
Peifer,M,Rauskolb,C,Williams M,et al.The segment polarity gene armadillo interacts with the wingless signaling pathway in both embryonic and adult pattern formation[J].Development,1991,111(4):1029-1043.
Peifer M.Cell adhesion and signal transduction:the Armadillo connection[J].Trends in Cell Biology,1995,5(6):224-229.
Schuijers J,Mokry M,Hatzis P,et al.Wnt-induced transcriptional activation is exclusively mediated by TCF/LEF[J].The EMBO Journal,2014,33(2):146-156.
Wang QM,Li X,Jia LQ,et al.Role of Wnt/β-catenin signaling transduction pathway in rat hepatocarcinogenesis[J].Chinese Journal of Cellular and Molecular Immunology,2006,4:454-457.[王启明,李肖,贾连群,等.Wnt/β-catenin 信号通路在实验性大鼠肝癌形成过程中的作用[J].细胞与分子免疫学杂志,2006,4:454-457]
Xu WH.Advances in insect diapause[J].Chinese Bulletin of Entomology,2008,45(4):512-517.[徐卫华.昆虫滞育研究进展[J].昆虫知识,2008,45(4):512-517]
Zhu J,Yang J,Xu WH.Identification of the related genes at diapause termination in Helicoverpa armigera[J].Journal of University of Science and Technology,2010,40(1):48-52,57.[朱佳,杨靖,徐卫华.棉铃虫滞育解除的相关基因鉴定[J].中国科学技术大学学报,2010,40(1):48-52,57]
