德国小蠊几丁质酶基因的克隆及表达模式分析
2015-12-03张道伟钱正敏
张道伟,陈 静,袁 媛,杨 静,钱正敏
(1.遵义师范学院生命科学学院,贵州省赤水河流域动物资源保护与应用研究重点实验室,贵州遵义 563002;2.遵义医学院生化与分子生物学教研室,贵州遵义 563003)
德国小蠊Blattella germanica 在分类学上隶属于节肢动物门Arthopoda,昆虫纲Insecta,蜚蠊目Blattaria,是重要的城市环境卫生害虫之一,可携带多种病原菌,导致多种疾病的传播和引起哮喘等过敏反应,给人类的健康和生活质量带来严重影响(Oliva,et al.,2010;张凡,2011)。德国小蠊种群密度大,繁殖速度快,对杀虫剂的高抗性使德国小蠊的防治成为世界性的防治难题,给疾病预防与控制工作带来极大的困难(赵志刚等,2012)。随着人们对食品安全和环境意识的提高以及可持续农业发展战略的实施,人们越来越需要一种新型环保的措施治理德国小蠊。
几丁质是昆虫表皮和昆虫中肠围食膜的必需组份,对昆虫的发育至关重要。在进化过程中,昆虫利用几丁质的刚性和化学稳定性,形成其细胞外骨架如外表皮和中肠内壁的围食膜结构,从而保护昆虫在生长、移动和与外界交流等过程中免受环境中的各种伤害(Kramer and Muthukrishnan,2005)。由于其独特的结构和在昆虫生长过程中的重要作用,加之高等动物和植物中均不含几丁质,因此干扰几丁质的合成和降解,一直是新型农药靶标研究的热点。
几丁质酶(EC3.2.1.14)是降解几丁质的主要酶类之一,在自然界的存在范围也极为广泛。在昆虫中的主要功能是周期性的褪去旧表皮过程中降解几丁质。昆虫几丁质酶的研究始于19 世纪70年代,第一个几丁质酶基因cDNA 的克隆由Kramer 于1993年从烟草天蛾Manduca sexta 中获得。随后又有众多的昆虫几丁质酶基因的cDNA 序列从昆虫不同目的物种中被分离。目前已报道的几丁质酶主要集中在鳞翅目昆虫(Kim et al.,1998;Bolognesi et al.,2005;Zhang et al.,2012)、双翅目昆虫(Feix et al.,2000,Yan et al.,2002),而鞘翅目(Royer et al.,2002,Genta et al.,2006)及膜翅目昆虫(Krishnan et al.,1994)等也有少量报道。在已报道的这些昆虫中,一般只有一个基因或cDNA 序列被鉴定出来。近年来随着越来越多昆虫基因组序列测序工作的完成,利用生物信息学方法鉴别出多个几丁质酶和类几丁质酶基因。Zhu 等2004 首先在果蝇Drosophila melanogaster 基因组发现存在多个几丁质酶或类几丁质酶成员并初步将其分类。随后Zhu 等(2008a)进一步通过搜索D.melanogaster、赤拟谷盗Tribolium castaneum和埃及伊蚊Aedes aegypti 基因组序列,结果显示分别有23、17 和16个几丁质酶或类几丁质酶家族基因被识别出来。Pan 等(2012)重新搜索家蚕基因组也发现有12个几丁质酶或类几丁质酶被鉴定出来,说明在昆虫中几丁质酶是一个多基因家族成员。识别出来的几丁质酶和类几丁质酶基因通过昆虫细胞表达重组蛋白(Zhu et al.,2008b)和注射几丁质酶基因特异性dsRNA 的RNAi 实验(Zhu et al.,2008c)进一步得到功能上的鉴定;不同类型的几丁质酶基因表达受到抑制后,会出现畸形发育、死亡等各种表型(Zhu et al.,2008c;Zhang et al.,2012),显示几丁质酶在昆虫发育过程中的具有重要功能。这些研究表明利用几丁质酶在不同害虫防治应用有着良好的前景。本研究根据几丁质酶保守序列结构设计简并引物,从德国小蠊中克隆到其BgChi 基因的全长cDNA 序列,并进一步对其系统进化树、组织和时间表达特异性进行了分析,本研究结果为利用几丁质酶基因为靶标防治德国小蠊奠定了基础。
1 材料与方法
1.1 实验材料与仪器
1.1.1 德国小蠊的饲养
德国小蠊由贵阳医学院张春林教授惠赠,在本实验室内饲养多代。饲养条件为温度25℃±1℃,光照条件为14L∶10D,相对湿度为70%-80%,用大鼠饲料继代饲养。
1.1.2 主要试剂及仪器
SMARTTMRACE cDNA Amplification Kit、定量PCR 试剂(SYBR Premix Ex Taq)、pMD-18T Cloning Vector 购自宝生物(大连)有限公司,TransTaqTMHiFi DNA Polymerase 购自北京全式金生物公司,AxyPrep 质粒小量制备试剂盒和DNA 凝胶回收试剂盒购自爱思进生物公司,所有引物合成和序列测序由上海生物工程有限公司完成。常规PCR 仪PTC-1000、定量PCR 仪CFX96 和凝胶电泳系统购自Bio-rad公司、凝胶成像系统GelDoc-IT 购自美国Springsci 公司。
1.1.3 本研究采用的引物序列及作用

表1 德国小蠊几丁质酶基因cDNA 扩增的策略和引物Table 1 Strategy and primers used for amplification chitinase gene cDNA in Blattella germanica
1.2 实验方法
1.2.1 总RNA 的提取、cDNA 合成和PCR 反应
采用Trizol 方法提取德国小蠊从卵发育至成虫时期的总RNA。步骤如下:将样品放入液氮预冷的无RNase 的研钵,研磨至粉末状,加1 mL Trizol,继续研磨至液体;转入1.5 mL EP 管,涡旋震荡15 s,室温静置5 min;加入0.2 mL 氯仿,混匀静置3-5 min,4℃,12000 g,15 min;转移上清至新的EP 管中,加入0.5 mL 异丙醇,室温静置10 min,4℃,12000 g 离心10 min;弃上清,加入1 mL 75% 乙醇洗涤沉淀,4℃,7500 g,5 min,弃上清;稍微干燥,用适量无RNase 的去离子保存。
首先用Nano drop-2000 微量分光光度计测定总RNA 浓度,然后再0.2 mL PCR 管中按顺序加入以下样品:1 μg 总RNA,5 μL 的5×Buffer,2 μL的dNTPs,0.5 μL 的AMV RTase,1 uL 引物dT18,补充DEPC 水至25 uL。在PCR 仪上进行如下反应:37℃,10 min;42℃,1.5 h;90℃,5 min,即获得第一链cDNA。两对简并引物BgChi-F1,BgChi-F2,BgChi-R1 和BgChi-R2 根据已知昆虫几丁质酶基因的保守序列设计。中间片段获得由两轮PCR 组成,第一轮PCR 采用BgChi-F1 和BgChi-R1 为引物,进行如下反应:预变性94℃,5 min;然后30个循环94℃,30 s,50℃,30 s,72℃,1 min;第二轮PCR 采用BgChi-F2 和BgChi-R2 为引物,模板为第一轮PCR 产物稀释50 倍,进行如下反应:预变性94℃,5 min;然后30个循环94℃,30 s,50℃,30 s,72℃,40 s。
1.2.2 目的片段的回收、连接、转化和验证
将第二轮PCR 产物采用琼脂糖凝胶电泳,割胶回收合适的大小片段,根据pMD-18T Cloning Vector 说明书进行连接,然后转入DH 5α 大肠杆菌感受态细胞中,用BgChi-F2 和BgChi-R2 为引物进行菌落PCR 验证,将阳性克隆摇菌,送样品到上海生物工程公司进行测序。
1.2.3 BgChi 的3' RACE 和5'RACE 扩增
根 据 Clontech 的 SMARTTMRACE cDNA Amplification Kit 试剂盒说明书分别构建了德国小蠊整个发育时期(卵、1-6 龄幼虫、雌成虫、雄成虫等)的5'RACE 和3'RACE cDNA 库。特异性引物BgChi-3' GSP1 和BgChi-3' GSP2 以 及BgChi-5'GSP1 和BgChi-5'GSP2 根据获得的中间片段设计。其中BgChi-3'GSP1 和BgChi-3'GSP2用于扩增3' RACE 片段,第一轮 PCR 采用BgChi-3'GSP1 和UPM 引物,第二轮巢氏PCR 采用BgChi-3'GSP2 和NUP 引物进行扩增,作为模板第一轮PCR 产物稀释50 倍;BgChi-5'GSP1 和BgChi-5'GSP2 用于扩增5'RACE 片段,第一轮PCR 采用BgChi-5'GSP1 和UPM 引物,第二轮巢氏PCR 采用BgChi-5'GSP2 和NUP 引物进行扩增,作为模板第一轮 PCR 产物稀释50 倍。RACE-PCR 扩增的程序均为:预变性94℃,5 min;然后30个循环94℃,30 s,50℃,30 s,72℃,1 min。获得的片段采用与方法1.2.2 相同的步骤进行回收、连接、转化和验证。
1.2.4 序列分析
德国小蠊几丁质酶基因BgChi 核苷酸序列分析软件采用DNAstar 软件分析,其它物种几丁质酶从GenBank 数据库获得;蛋白质功能域的搜索用Blast(http://blast.ncbi.nlm.nih.gov/Blast.cgi);信号肽采用 SignaIP 进行预测(http://www.cbs.dtu.dk/services/SignalP/);结构域分析采用 Swiss-Model(http://smart.embl-heidelberg.de/);跨膜结构TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/);核苷酸序列和氨基酸序列搜索采用在线分析工具blastn 和blastp;进化树的构建采用软件Clustalw2(http://www.ebi.ac.uk/Tools/msa/clustalw2/)和MEGA 5.1。
1.2.5 组织分布和时间表达检测
取德国小蠊6 龄3 d(卢慧明等,2013)幼虫的不同组织(包括表皮、脂肪体、中肠、气管、血淋巴),6 龄蜕皮前1-3 d 和蜕皮后1-5 d 收集样品。按照1.2.1 中的方法提取各组织的RNA 并进行质量检测,然后分别取1 μL RNA 反转录为cDNA 后,以rtBgChi F 和rtBgChi R 为引物进行BgChi 基因组织分布和时间表达检测。扩增程序为:预变性94℃,5 min;然后28个循环94℃,30 s,57℃,30 s,72℃,25 s。
1.2.6 荧光定量PCR 检测
实时荧光定量PCR 采用TaKaRa 公司的Real Time PCR-SYBR Green 试剂在Bio-Rad 新一代CFX96 实时定量PCR 仪器上进行,检测BgChi 在6 龄幼虫期前后表达量的变化。检测过程中以β-actin基因为内参基因,无菌水阴性对照。每个cDNA 样品重复3 次。反应程序为:预变性94℃,5 min;然后28个循环94℃,15 s,57℃,15 s,72℃,20 s。反应结束后计算目的基因的Ct值和内参基因的Ct平均值,采用2-△Ct相对定量法计算相对表达量。
2 结果与分析
2.1 德国小蠊几丁质酶基因的克隆与序列分析
为了获得德国小蠊几丁质酶基因,首先通过GenBank 数据库比对其它昆虫几丁质酶基因的序列,根据保守区域设计简并引物两对BgChi-F1,BgChi-R1 和BgChi-F2,BgChi-R2 用于扩增BgChi 的中间片段。经过两轮PCR,获得了一条约480 bp 左右的核苷酸片段(图1 所示),测序结果显示该片段与禾沫蝉Poophilus costalis 几丁质酶的同源性为81%,可以初步确定扩增的中间片段为几丁质酶基因。根据这段序列,分别在3'端和5'端设计特异性引物。利用德国小蠊5'RACE 和3'RACE cDNA 库,分别获得约500 bp 和1100 bp 左右的片段(图1 所示)。经过回收,连接,转化,菌落PCR 验证和测序,结果表明获得的目的基因为BgChi,属于几丁质酶18 家族基因。

图1 BgChi 基因中间片段及RACE PCR扩增的凝胶电泳结果Fig.1 Gel electrophoresis analysis of BgChi part fragment and RACE amplification by PCR
通过在线分析软件SignaIP 4.1 发现BgChi 蛋白N-端含有一个1-23个氨基酸的信号肽;Swiss-Model 分析表明其存在一个几丁质酶18 家族的催化结构域和一个C-端的几丁质结合域(图2 所示);TMHMM 2.0 软件分析BgChi 无跨膜区域,为胞外蛋白。
在线生物软件比对,拼接中间片段,3'和5'RACE 序列,获得德国小蠊几丁质酶基因BgChi 的cDNA 全长为1881 bp,开放阅读框(ORF)为1620 bp,编码539个氨基酸(图3 所示)。预测的分子量大小为59.7 kDa,理论等电点为5.0。BgChi蛋白含有几丁质酶18 家族4个保守的氨基酸序列:保守区 Ⅰ:KXXXXXGGW,保守区 Ⅱ:FDGXDLDWEYP,保守区 Ⅲ 和 Ⅳ 分别为:MXYDXXG 和GXXXWXXDXDD,表明其属于典型的几丁质酶18 家族成员,主要与昆虫的蜕皮相关(图3 所示);在终止密码子TAA 的后面和polyA的前面发现了典型的加尾信号序列AATAAA 结构,表明获得的为完整的cDNA 序列。通过与其它物种中克隆得到的几丁质酶比对结果也证明了这点。

图2 SMART 软件分析BgChi 结构域Fig.2 Domain analysis of BgChi chitinase protein by SMART software

图3 德国小蠊几丁质酶基因序列及保守氨基酸序列分析。Fig.3 The nucleotide and deduced amino acid sequences of Blattella germanica chitinase

图4 利用MEGA 5.1 构建的BgChi 与其它几丁质酶的系统进化树Fig.4 Phylogenetic analysis of BgChi and other insect chitinase genes by MEGA 5.1
2.2 BgChi 的同源性和进化分析
将BgChi 与其它昆虫几丁质酶进行进化树分析,这些物种及其基因氨基酸序列来自:德国小蠊Blattella germanica(KJ789158);禾沫蝉Poophilus costalis(AFW03959);蝇蛹金小蜂Nasonia vitripennis(NP_001155084);家蚕Bombyx mori(BAB13481);赤拟谷盗Tribolium castaneum(NP_001034524);冈比亚按蚊Anopheles gambiae(AAB87764);红火蚁Solenopsis invicta(EFZ09833);野桑蚕 Bombyx mandarina(AF326596_1);埃及伊蚊Aedes aegypti(AAB81849);东方粘虫 Mythimna separate(AAS92245);东亚飞蝗 Locusta migratoria(ABK76337);欧洲熊蜂Bombus terrestris(XP_003402985);金纹小潜细蛾Phyllonorycter ringoniella(AEP25533);二化螟 Chilo suppressalis(AAW30162);番茄夜蛾 Lacanobia oleracea(CAF05663);甜菜夜蛾 Spodoptera exigua(GU371868);亚洲玉米螟 Ostrinia furnacalis(ABI81757);斜纹夜蛾 Spodoptera litura(BAB12678);小地老虎 Agrotis ipsilon(ABW03227);甘蓝夜蛾 Mamestra brassicae(ACL30984);印度跳蚁 Harpegnathos saltator(EFN88161);小菜蛾 Plutella xylostella(ACU42267);切叶蚁 Acromyrmex echinatior(EGI64271)。图4 结果表明德国小蠊与同翅目禾沫蝉Poophilus costalis 的亲缘关系最近,与膜翅目熊峰Bombus terrestris 和切叶蚁Acromyrmex echinatior 几丁质酶的亲缘关系次之。
2.3 BgChi 在不同组织器官的表达特性
解剖6 龄3 d 德国小蠊幼虫组织,包括表皮、脂肪体、中肠、气管、血细胞等,用RT-PCR 方法检测德国小蠊几丁质酶BgChi 基因的表达。由图5 结果可知:德国小蠊几丁质酶基因BgChi 在表皮、中肠和气管均有表达,其中在表皮和气管中的表达量较高,在中肠的表达量稍低。在脂肪体及血淋巴中未检测到BgChi 基因的表达。说明几丁质酶的表达具有组织特异性,通常在含几丁质的组织中表达,如昆虫的表皮、气管是含有几丁质结构,中肠由于内部有围食膜所以也含有几丁质结构,在这几个组织器官中,BgChi 的表达量较高。

图5 RT-PCR 检测德国小蠊几丁质酶BgChi 基因的组织分布Fig.5 Tissue distribution of BgChi by RT-PCR in Blattella germanica
2.4 BgChi 的时间表达结果
取6 龄幼虫蜕皮前1-3 d 和蜕皮后1-5 d 幼虫不同发育时期样品,提取RNA,反转录后用定量PCR 检测BgChi 基因mRNA 的表达情况。如图6 所示,德国小蠊几丁质酶的表达量在蜕皮前达到高峰,随着蜕皮的结束表达量随之下降;在6 龄蜕皮幼虫初期表达量趋于平稳。
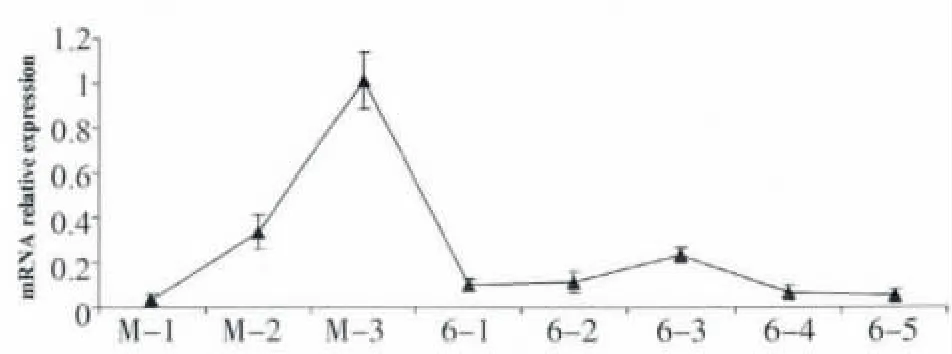
图6 德国小蠊6 龄幼虫蜕皮前后BgChi 表达量qTR-PCR 分析Fig.6 The relative mRNA expression of Bgchi during molting in 6th larval stage of Blattella germanica detected by qRT-PCR
3 结论与讨论
几丁质酶是降解几丁质的最主要酶类之一,广泛存在于自然界,包括细菌,真菌,病毒,昆虫和植物等(Arakane and Muthukrishnan,2010)。本研究通过生物信息学方法比对昆虫几丁质酶保守序列,采用同源克隆及RACE-PCR 方法从德国小蠊中克隆得到几丁质酶基因。自从1993年Kramer 等首次从烟草天蛾Manduca sexta 中克隆出全长的几丁质酶基因cDNA 序列,已有超过几十种编码几丁质酶基因的cDNA 序列从昆虫不同目的多个物种中被分离出来(Kcramer et al.,1993;Bolognesi et al.,2005;Genta et al.,2006;Kim et al.,2010;Zhang et al.,2012)。特别是随着越来越多昆虫基因组测序工作的完成,利用生物信息学方法运用几丁质酶保守结构域获得几丁质酶和类几丁质酶基因序列得以实现。Zhu 等利用生物信息学方法比对搜索果蝇、赤拟谷盗和埃及伊蚊基因组序列,结果显示分别有16、16 和13个几丁质酶或类几丁质酶家族基因被识别出来(2008a),表明昆虫几丁质酶是多基因家族。但对于非模式昆虫物种来讲,通过构建cDNA 文库或利用同源克隆和RACE 扩增的方法仍是获得靶标功能基因的主要手段。
本研究利用同源克隆的方法从德国小蠊中只得到了一个几丁质酶基因,但通过序列比对和结构分析发现:BgChi 含有几丁质酶典型的结构域(如图2 和图3 所示):1个N-端的信号肽序列,1个几丁质催化区域,1个C-端的几丁质结合区域,以及连接催化区和结合区之间的连接区域。这和昆虫几丁质酶家族Group 1 的分类特征完全一样(Zhu et al.,2008a)。Group 1 几丁质酶家族主要在表皮、中肠和气管分布,在昆虫蜕皮阶段(幼虫-幼虫、幼虫-蛹、蛹-成虫)前表达降解老的旧表皮(Daimon et al.,2005),在这些变态阶段蜕皮激素对其具有正调控作用,保幼激素起负调控作用(Zhu et al.,2008a)。氨基酸序列研究表明,BgChi 具有昆虫几丁质酶4个保守的氨基酸序列:KXXXXXGGW,FDGXDLDWEYP,MXYDXXG 和GXXXWXXDXDD,是几丁质酶催化结构域的重要功能区域,与几丁质酶的活性密切相关(Zhang et al.,2002;Zhu et al.,2004;Zhu et al.,2008b)。BgChi 几丁质结合区约含60个氨基酸,主要功能使几丁质酶结合不溶性的几丁质底物提高降解效率。用分子生物学软件对几丁质酶的糖基化位点进行分析显示,多数糖基化位点位于连接区域和部分催化区。除了糖基化作用之外还存在多个硫酸化和磷酸化作用位点,它们的修饰对蛋白功能的发挥也起到重要作用。
随着多个昆虫基因组测序工作的完成和生物信息学手段的使用使我们明确昆虫几丁质酶是多基因家族,而RNAi 技术的发展成熟则使我们能鉴定家族中的不同成员在昆虫发育中的具体功能。这些被识别出来的几丁质酶和类几丁质酶成员进一步通过昆虫细胞表达重组蛋白和通过注射几丁质酶家族成员的特异性dsRNA 的RNAi 实验得到功能上的鉴定,确认其与几丁质降解有密切关系。在赤拟谷盗中,RNAi 沉默Group 1 几丁质酶TcChi5 导致注射组在成虫阶段完全死亡,RT-PCR 检测结果表明正是TcChi5 转录本的降低所导致(Zhu et al.,2008c)。通过注射能够产生表型的还有隶属于其它组的几丁质酶成员如TcChi10,TcChi7 和IDGF4。注射TcChi10 dsRNA 不仅导致幼虫-幼虫期间不能完成蜕皮而死亡,而且幼虫-蛹、蛹-成虫阶段也不能顺利完成发育,死亡率几乎达到100%。几丁质酶基因TcChi7 对赤拟谷盗腹部的形成和翅膀的发育时不可缺少的,沉默其表达导致出现腹部发育不全和翅膀畸形(Zhu et al.,2008c)。相似的研究成果在甜菜夜蛾中也得到验证,抑制SeChi 基因的表达会影响其幼虫阶段的蜕皮;而抑制SeChi-h 基因的表达则会影响幼虫化蛹及成虫的羽化(Zhang et al.,2012)。说明Group 1 几丁质酶基因在昆虫的生长发育中具有重要功能,通过抑制其表达则在害虫防治中有着良好的应用前景。
由于昆虫的围食膜和表皮主要是由几丁质和蛋白质组成,利用几丁质酶来降解昆虫含几丁质的组织来抑制害虫的正常生理活动,从而可以达到防治害虫的目的(李瑶和范晓军,2011)。同时,高等植物和高等动物并不含几丁质,因此利用几丁质酶防治害虫是一种相对安全、有效的手段,而针对几丁质代谢水平设计开发新型农药品种,其应用前景也必将极为广阔。
References)
Arakane Y,Muthukrishnan S.Insect chitinase and chitinase-like proteins[J].Cell Mol.Life Sci.,2010,67(2):201-216.
Bolognesi R,Arakane Y,Muthukrishnan S,et al,.Sequences of cDNAs and expression of genes encoding chitin synthase and chitinase in the midgut of Spodoptera frugiperda[J].Insect Biochem.Mol.Biol.,2005,35(11):1249-1259.
Daimon T,Katsuma S,Iwanaga M,et al.The BmChi-h gene,a bacterial-type chitinase gene of Bombyx mori,encodes a functional exochitinase that plays a role in the chitin degradation during the molting process[J].Insect Biochem.Mol.Biol.,2005,35(10):1112-1123.
Genta FA,Blanes L,Cristofoletti PT,et al.Purification,characterization and molecular cloning of the major chitinase from Tenebrio molitor larval midgut[J].Insect Biochem.Mol.Biol.,2006,36(10):789-800.
Kim JS,Je YH.A novel biopesticide production:attagel-mediated precipitation of chitinase from Beauveria bassiana SFB-205 supernatant for thermotolerance[J].Appl.Microbiol.Biotechnol.,2010,87(5):1639-1648.
Kramer KJ,Corpuz L,Choi HK,et al.Sequence of a cDNA and expression of the gene encoding epidermal and gut chitinases of Manduca sexta[J].Insect Biochem.Mol.Biol.,1993,23(6):691-701.
Kramer KJ,Muthukrishnan S.Chitin Metabolism in Insects[M].Oxford:Elsevier Press,2005,111-134.
Li Y,Fan J.Insect chitinase and its application in insect pest control[J].Chinese Journal of Applied Entomology,2011,48(5):1489-1494.[李瑶,范晓军.昆虫几丁质酶及其在害虫防治中的应用[J].应用昆虫学报,2011,48(5):1489-1494]
Lu HM,Meng FX,Gao CF,et al.Study on physical characteristics of Blattella germanica in different nymphal instars[J].Chin.J.Vector Biol.& Control,2013,24(2):125-127.[卢慧明,孟凤霞,高聪芬,等.德国小蠊若虫龄期区别的体征研究[J].中国媒介生物学及控制杂志,2013,24(2):125-127]
Merzendorfer H,Zimoch L.Chitin metabolism in insects:structure,function and regulation of chitin synthases and chitinases[J].J.Exp.Biol.,2003,206:4393-4412.
Oliva GR,Díaz C,Fuentes GO,et al.Blatella germanica as a possible cockroach vector of micro-organisms in a hospital[J].Journal of Hospital Infection,2010,1:93-95.
Pan Y,Lu P,Wang Y,et al.In silico identification of novel chitinaselike proteins in the silkworm,Bombyx mori,genome[J].J.Insect Sci.,2012,12:150.
Zhang DW,Chen J,Yao Q,et al.Functional analysis of two chitinase genes during the pupation and eclosion stages of the beet armyworm Spodoptera exigua by RNA interference[J].Arch.Insect Biochem.Physiol.,2012,79(3-4):220-234.
Zhang F.Advances in mechanisms of insecticide resistance in Blattella germanica[J].Chemistry of Life,2011,31(5):747-750.[张凡.德国小蠊抗药性机理[J].生命的化学,2011,31(5):747-750]
Zhang H,Huang X,Fukamizo T,et al.Site-directed mutagenesis and functional analysis of an active site tryptophan of insect chitinase[J].Insect Biochem.Mol.Biol.,2002,32(11):1477-1488.
Zhao ZG,Huo XB,Wang XJ,et al.Resistance of Blattella germanicato nine kinds of commonly used insecticides[J].Chin.J.Hyg.Insect & Rquip.,2012,18(1):38-40.[赵志刚,霍新北,王学军,等.德国小蠊对9种常用杀虫剂的抗性测定[J].中华卫生杀虫药械,2012,18(1):38-40]
Zhu Q,Arakane Y,Banerjee D,et al.Domain organization and phylogenetic analysis of the chitinase-like family of proteins in three species of insects[J].Insect Biochem.Mol.Biol.,2008a,38(4):452-466.
Zhu Q,Arakane Y,Beeman RW,et al.Characterization of recombinant chitinase-like proteins of Drosophila melanogaster and Tribolium castaneum[J].Insect Biochem.Mol.Biol.,2008b,38(4):467-477.
Zhu Q,Arakane Y,Beeman RW,et al.Functional specialization among insect chitinase family genes revealed by RNA interference[J].Proc.Natl.Acad.Sci.USA,2008c,105(8):6650-6655.
Zhu Q,Deng Y,Vanka P,et al.Computational identification of novel chitinase-like proteins in the Drosophila melanogaster genome[J].Bioinformatics,2004,20(2):161-169.
