菌落PCR改良技术快速鉴定阿萨希毛孢子菌的实验研究
2015-12-03张德全刘涵廖勇夏志宽杨冬倩杨阳吕雪莲杨蓉娅
张德全 刘涵 廖勇 夏志宽 杨冬倩 杨阳 吕雪莲 杨蓉娅
(1.北京军区总医院全军皮肤损伤修复研究所,北京100700;2.总政治部机关医院,北京100120)
菌落PCR改良技术快速鉴定阿萨希毛孢子菌的实验研究
张德全1,2刘涵1廖勇1夏志宽1杨冬倩1杨阳1吕雪莲1杨蓉娅1
(1.北京军区总医院全军皮肤损伤修复研究所,北京100700;2.总政治部机关医院,北京100120)
目的 探索快速鉴定阿萨希毛孢子菌(Trichosporon asahii,T.asahii)的简便方法。方法 分别应用直接法、直接离心法、酶解法、酶解改良法4种方法进行样本预处理后的菌落PCR技术检测16株T.asahii,评价上述4种方法的敏感性和微量样本阳性率,同时与DNA常规提取法PCR结果进行比较。结果 酶解改良法、直接法、常规提取法敏感性均为102CFU/mL,阳性率分别为93.75%、75%、50%;直接离心法敏感性为104CFU/mL,阳性率为43.75%;酶解法结果为阴性。结论 酶解改良法是一种简便快速的PCR模板获取方法,适用于菌落PCR技术对T.asahii进行快速鉴定时的样本预处理。
菌落PCR;阿萨希毛孢子菌;DNA初提
[Chin J Mycol,2015,10(1):6⁃10]
阿萨希毛孢子菌(Trichosporon asahii,T.asahii)是毛孢子菌病最常见的致病菌,近年来关于T.asa⁃hii引起院内感染的相关报道较多[1⁃2],特别是侵袭性T.asahii感染,由于临床表现缺乏特异性,仅根据临床症状很难及时作出准确诊断,因此病原学的准确鉴定对于T.asahii引起院内感染的早期诊断和临床药物选择具有重要意义。然而目前T.asahii的传统与分子鉴定常受到菌落培养时间长、生化鉴定特异性不高、DNA提取复杂、分子鉴定耗时长等多种因素限制,这给临床诊断鉴定带来了很多不便。因此,寻找快速、准确的诊断方法对于争取T.asahii感染的救治时机具有重要意义[3]。以往菌落PCR技术较多应用于基因载体构建后的验证研究[4],近年有学者尝试应用菌落PCR技术进行病原微生物的临床诊断鉴定,该方法可在短时间内完成病原菌的检测,不仅节约了时间和劳动成本,同时也给临床治疗工作争取了空间优势。我们对以往文献报道过的菌落PCR技术进行了比较和改进,以期缩短诊断时间,对T.asahii进行更准确的鉴定,为临床治疗赢得时间。
1 材料与方法
1.1 材料
菌株来源 T.asahii(BZP07001、07002、07003、07004、07005、09001、09002、6108、6198、6674、4848、6956)为本实验室保存菌株,T.asahii参考菌株(8904、8520、7137)购自荷兰皇家科学院真菌多样性研究中心(Centraalbureau voor Schimmelcultures,CBS),标准株CBS2479为日本千叶大学赠送。
仪器与试剂 干式恒温器产自杭州瑞诚仪器有限公司,Thermo高速冷冻离心机产自美国热电公司,FASTPREP⁃24核酸蛋白提取仪购自美国MP公司,PCR扩增仪和凝胶成像系统均产自美国Bio⁃Rad公司,Taq DNA聚合酶、dNTP、250 bpDNA Marker等购自宝生物工程(大连)有限公司,PDA成品干粉产自德国默克公司,山梨醇、柠檬酸钠、蜗牛酶均购自生工生物工程(上海)股份有限公司,酸洗玻璃珠产于Sigma公司。
1.2 方法
PCR引物 应用真菌通用引物[5]26SF(5′⁃ATCCTTTGCAGACGACTTG A⁃3′)和 5SR (5′⁃AGCTTGACTTCGCAGATC GG⁃3′)扩增部分26S rD⁃NA、IGS1区和部分5S rDNA区域。
PCR反应体系与循环条件 反应总体积为25 μL,10倍缓冲液3 μL,dNTP(各2.5 mmol/L)2 μL,MgCl21.5 μL,上下游引物各1 μL(10 μmol/L),Taq酶1 U,模板DNA 1 μL,无菌双蒸水补足至反应总体积25 μL。反应条件:94℃预变性5 min,94℃变性45 s,53℃退火45 s,72℃延伸75 s,共30个循环,总延伸72℃ 7 min。
培养和菌悬液制备 将16株T.asahii接种于马铃薯葡萄糖琼脂培养基中,置于35℃恒温培养箱培养48 h后,挑取单菌落与无菌生理盐水制备菌悬液,应用血细胞计数板计数调整至浓度为1.0× 107CFU/mL。菌悬液3 000 r/min离心5 min,弃上清液,加入等量TE缓冲液重悬菌细胞,并用TE缓冲液对菌悬液进行10倍连续稀释,使菌悬液浓度为107、106、105、104、103、102、101CFU/mL。采用平板涂布方法对菌悬液浓度进行复核,吸取20 μL浓度为103CFU/mL菌悬液涂布于平板之上,本实验中所有菌株菌悬液平板涂布经35℃培养48 h后,平皿中菌落计数为15~25个。
直接法和直接离心法 直接法为从制备好的菌悬液中直接吸取1 μL做为模板加入PCR反应体系中。直接离心法是将制备好的菌悬液400 μL以3 000 r/min离心5 min后,吸取1 μL上清液作为模板进行PCR反应。
酶解法和酶解改良法 用10 mL pH 5.8的磷酸钾缓冲液溶解1.82 g山梨醇、0.042 g柠檬酸钠,取此溶液5 mL将1 g蜗牛酶完全溶解,制成蜗牛酶溶液。酶解法为取制备好的菌悬液400 μL加至无菌EP管中,并加入10 μL蜗牛酶溶液,置于37℃干式恒温器温浴1 h,取1 μL做为模板进行后续PCR反应。酶解改良法的不同之处在于将37℃温浴后的菌悬液以14 000 r/min离心5 min,弃上清,加等量 TE重悬后再取1 μL作为模板加入PCR反应体系中。
常规提取法 将制备好的菌悬液按所需浓度进行稀释,取400 μL至无菌EP管,3 000 r/min×5 min离心,弃上清,常规提取T.asahii DNA的方法参照文献执行[6]。
敏感性检测 将制备的标准菌株CBS2479倍比稀释菌悬液(107、106、105、104、103、102、101CFU/mL)分别应用上述5种方法预处理后进行PCR扩增。
微量样本阳性率检测 选取103CFU/mL作为微量阳性率检测菌悬液浓度,应用制备好的16株T.asahii 103CFU/mL浓度菌悬液,通过上述5种方法预处理后各取1 μL分别进行PCR扩增。
琼脂糖凝胶电泳 用1×TAE缓冲液配制浓度为1.5%的琼脂糖凝胶,100 V电泳45 min,凝胶成像仪下观察拍照。
2 结 果
2.1 菌落PCR敏感性检测
5种不同方法处理菌悬液并进行PCR扩增,结果显示,直接法在102处可见电泳条带(见图1a),提示最低检测浓度为102CFU/mL;直接离心法在104处可见电泳条带(见图1b),提示最低检测浓度为104CFU/mL;酶解法未见任何阳性条带(见图1c);酶解改良法在102处可见电泳条带(见图1d),最低检测浓度为102CFU/mL;常规提取法在102处出现特异性条带(见图1e),提示最低检测浓度为102CFU/mL。
2.2 菌落PCR微量菌悬液阳性率检测
16个样本中,直接法可获得12条特异性条带(见图2a),阳性率为75%;直接离心法得到7条特异性条带(见图2b),阳性率为43.75%;酶解法未见特异性条带(见图2c),酶解改良法可见15条特异性条带(见图2d),阳性率为93.75%;常规提取法仅得到8条特异性条带(见图2e),阳性率为50%。
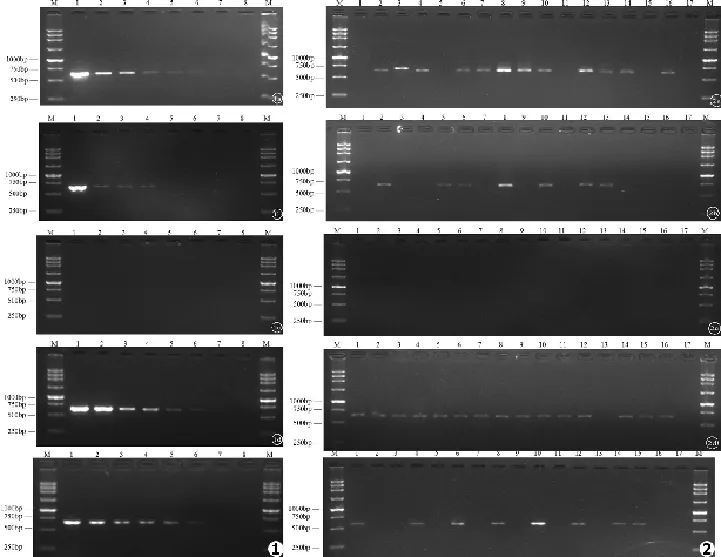
图1 不同预处理方法的阿萨希毛孢子菌标准株菌落PCR敏感性检测电泳图:M.DNA标准参照物;1⁃7.CBS2479连续10倍稀释菌悬液,浓度依次为107、106、105、104、103、102、101CFU/mL;8.阴性对照(a.直接法,b.直接离心法,c.酶解法,d.酶解改良法,e.常规提取法) 图2 16株阿萨希毛孢子菌不同预处理方法的菌落PCR微量样本阳性率检测电泳图:M.DNA标准参照物,1.BZP07001,2.BZP07002,3.BZP07003,4.BZP07004,5.BZP07005,6.BZP09001,7.BZP09002,8.CBS2479,9.CBS7137,10.CBS8520,11.CBS8904,12.BZP6108,13.BZP6198,14.BZP6674,15.BZP6956,16.BZP4848,17.阴性对照(a.直接法,b.直接离心法,c.酶解法,d.酶解改良法,e.常规提取法)Fig.1 The sensitivity of Colony PCR detection based on different methods:M.250 bp DNA Ladder;1⁃7.Suspension of the type strain of T.asahii CBS2479,Concentration followed by 107,106,105,104,103,102,101CFU/mL;8.Negative control(a.direct colony,b.direct colony with centrifugation,c.enzymolysis,d.improved enzymolysis method,e.traditional DNA extraction) Fig.2 The evaluation of positive rate of colony PCR trace detection based on different methods for 16 isolates of Trichosporon asahii:M.250 bp DNA Ladder,1.BZP07001,2.BZP07002,3.BZP07003,4.BZP07004,5.BZP07005,6.BZP09001,7.BZP09002,8.CBS2479,9.CBS7137,10.CBS8520,11.CBS8904,12.BZP6108,13.BZP6198,14.BZP6674,15.BZP6956,16.BZP4848,17.Negative control(a.direct colony,b.direct colony with centrifugation,c.enzymolysis,d.improved enzymolysis method,e.traditional DNA extraction)
3 讨 论
T.asahii感染常见于免疫功能低下患者,特别是血液病、恶性肿瘤、免疫缺陷、白细胞减少症的住院患者,更是T.asahii感染的高危人群。自2001年国内首例播散性毛孢子菌病报道以来,国内由该菌引起的院内感染报道亦明显增多[7⁃9]。但目前,由于T.asahii的鉴定常需要基于病理组织活检标本和血培养基础上的生化鉴定、常规PCR或实时定量PCR等分子技术来明确,而PCR扩增常需要预先应用液氮研磨、酶解、冻融、机械裂解等各种传统的破壁方法后再进行较为复杂的DNA提取,所需时间较长,这给临床诊断和治疗带来了很多不便。因此,建立一种快速诊断鉴定T.asahii的分子方法对于赢取临床治疗时间具有重要意义。
Gussow和Clackon于1989年首次报道了菌落PCR的方法[10],即挑取单个菌落到TE缓冲液中并煮沸5 min,涡旋振荡后短暂离心,用少量裂解液作为DNA模板加入到PCR反应体系中进行扩增。但传统的菌落PCR技术常因假阳性的出现以及敏感性较低等原因,限制了该技术在临床中的应用[11]。为了克服传统菌落PCR技术的这一不足,已有很多关于在进行PCR扩增之前对菌落进行预处理的方法研究,如液氮冻融、超声破碎、高盐溶液、溶胞酶消解、阳离子螯合树脂等[12⁃13]。到目前为止,在T.asahii鉴定过程中尚无采用菌落PCR方法的报道。我们采取直接法、直接离心法、酶解法和酶解改良法对T.asahii菌体进行预处理,以期建立一种快速、经济、简便的鉴定 T.asahii的菌落PCR技术。
直接菌落PCR法即直接挑取少量菌落加入到PCR反应体系中,在反复高温变性过程中部分菌体出现裂解,从而释放出少量基因组DNA作为模板进行PCR扩增。本研究中其菌落PCR敏感性为102CFU/mL,微量检测阳性率为75%。我们推测该方法微量检测时的阳性率偏低一方面由于菌体破裂后产生的杂质可在一定程度上影响或抑制PCR扩增反应,从而降低扩增效率;另一方面由于PCR循环扩增中高温条件有限,只能使少量孢子破壁并释放出相对含量较低的基因组DNA,且不同菌株所释放出的基因组DNA存在差异,从而导致该方法的微量检测阳性率偏低,这提示基于直接法的菌落PCR技术更适用于菌含量较多的样本检测,如需对微量病原菌进行检测,尚需探索其他更为有效的菌落预处理方法。因此我们尝试了在直接法基础上对已有菌悬液进行3 000 r/min离心5 min后,吸取1 μL上清液作为模板进行PCR反应,以期通过高速离心增加孢子破裂的概率,从而释放出较直接法更多的基因组DNA,同时通过离心去除菌悬液中可能存在的抑制PCR反应的杂质。但我们的研究结果显示,直接离心法敏感性为105CFU/mL,阳性率为43.75%,低于直接菌落法的阳性率。我们推测,高速离心只能使极少量孢子破裂,同时由于高速离心使未破裂孢子沉于管底,以致在应用1 μL上清液作为模板加入至PCR反应体系时,模板中实际DNA含量较少,从而使直接离心法的敏感性和微量检测阳性率进一步降低。
为解决真菌细胞壁破壁困难,影响菌落PCR扩增效率的问题,本研究还采用酶解法对T.asahii进行酶解破壁,并检测其菌落PCR扩增的敏感性和微量菌悬液阳性率,但均为阴性结果。蜗牛酶是目前公认的可对真菌细胞壁进行较理想的酶解破壁酶,在真菌分子研究中已得到广泛应用,常规用量可使106CFU/mL孢子有效破壁[14],但我们应用酶解后的菌落PCR却呈阴性结果。我们推测这可能并非是蜗牛酶不能使T.asahii孢子破壁,而可能与蜗牛酶中复杂的制剂成分抑制PCR反应有关。为了克服传统酶解法基础上的菌落PCR存在的不足,我们尝试对该法进行改良,即将37℃温浴后的菌悬液离心,弃上清,加等量TE重悬后再取1 μL作为模板加入PCR反应体系中。结果显示,酶解改良法的敏感性为102CFU/mL,微量检测的阳性率亦达93.75%。这进一步印证了我们对常规酶解法菌落PCR阴性结果的推测。而通过对含有蜗牛酶的菌悬液进行离心,可将T.asahii破壁后的原生质体和基因组DNA沉积于管底,与上清液分离,使上清液成分中可能抑制PCR反应的蜗牛酶中的复杂制剂得以去除,进一步提高基于蜗牛酶改良法的菌落PCR扩增效率。以往文献报道中关于念珠菌和曲霉的直接菌落PCR模板中孢子含量为1×103~1×104相比[15],本研究中的直接菌落法和酶解改良法的敏感性具有显著优势。由于我们在进行菌落PCR扩增时仅加入1 μL上清液作为模板,102CFU/mL的敏感性实际仅相当于10⁃1个孢子,如果仅以孢子数量进行分析,这将很难对该结果进行解释,我们推测这可能和T.asahii基因组中目的基因核糖体DNA的多拷贝有关。早期有研究报道酵母基因组中含有100~200个核糖体DNA拷贝[16]。因此,即使仅有极少量的基因组DNA存在于反应体系中,亦可因核糖体DNA的多拷贝性实现较理想的扩增结果。酶解改良法的微量检测阳性率为93.75%,这更间接地证实了核糖体DNA的多拷贝性。由于酶解法耗时仅为1 h,较常规提取法耗时明显缩短,操作简便,且由于具有较高的敏感性和微量检测阳性率,适用于真菌载量较低的临床标本的快速检测,值得进一步的临床深入研究。
同时我们也对基于常规提取法的菌落PCR技术进行了对照研究,结果显示敏感性为102CFU/mL,微量检测阳性率为50%。我们认为,常规法敏感性较高可能与DNA提取过程中TE重悬时仅为50 μL,使其DNA浓度进一步提高有关。但微量检测阳性率相对较低,可能与本研究中采用103CFU/mL这样的微量检测标准有关,103CFU/mL的菌悬液中的实际菌含量很少,而且在常规DNA提取过程中各种复杂的步骤极易引起DNA流失,这便造成相同病原菌浓度的不同样本经常规DNA提取后,所采用的1 μL模板中的DNA含量差异较大,故本研究中该方法的微量阳性率检测未能获得满意效果。因此我们认为当对菌量较少的样本进行快速鉴定时,不宜采用程序复杂的常规提取法基础上的常规PCR扩增技术。
上述实验结果显示,基于酶解改良法的菌落PCR技术操作简便,可实现对微量T.asahii的快速鉴定,具有经济、便捷、敏感、高效的特点,对早期诊断院内T.asahii感染更有诊断价值和临床意义。但由于本研究中未进行临床样本或模拟临床样本的检测,在下一步的研究工作中还需弥补此类不足。
[1] Baka S,Tsouma I,Kouskouni E.Fatal lower limb infection by Trichosporon asahii in an immunocompetent patient[J].Acta Dermatovenerol Croat,2013,21(4):241⁃244.
[2] Rubic Z,Novak A,Tomic Z,et al.Prompt diagnosis and effective treatment of Trichosporon asahii catheter⁃related infection in non⁃immunocompromised neurosurgical patient[J].Mycopatho⁃logia,2014,Sep 24.[Epub ahead of print]
[3] Colombo AL,Padovan AC,Chaves GM.Current knowledge of Tri⁃chosporon spp.and trichosporonosis[J].Clin Microbiol Rev,2011,24(4):682⁃700.
[4] Meshkat Z,Soleimanjahi H,Mahmoudi M,et al.Determination of human papillomavirus type 16 genotype and construction of clo⁃ning vector pTZ57R encoding HPV16 E7 gene[J].Saudi Med J,2006,28(10):1511⁃1515.
[5] 夏志宽,王文岭,杨蓉娅.国内临床分离阿萨希毛孢子菌3个新基因型分析[J].中华医院感染学杂志,2012,22(14):2988⁃2990.
[6] Makimura K,Murayama SY,Yamaguchi H.Detection of a wide range of medically important fungi by the polymerase chain reac⁃tion[J].J Med Microbiol,1994,40(5):358⁃364.
[7] 杨蓉娅,敖俊红,王文岭,等.阿萨希丝孢酵母引起播散性毛孢子菌病国内首例报告[J].中华皮肤科杂志,2001,34(5):329⁃332.
[8] 李新红,冯新国,欧阳淑兰.阿萨希毛孢子菌感染两例[J].中华医院感染学杂志,2012,22(19):2012.
[9] 郑晓丽,王志东,闫洪敏,等.异基因造血干细胞移植过程中并发播散性阿萨希毛孢子菌感染1例并文献复习[J].临床血液学杂志,2013,26(5):312⁃314.
[10] Gussow D,Clackson T.Direct clone characterization from plaques and colonies by the polymerase chain reaction[J].Nu⁃cleic Acids Res,1989,17(10):4000.
[11] Bergkessel M,Guthrie C.Colony PCR[J].Methods Enzymol,2013,529:299⁃309.
[12] 潘峰,周东风,肖晶,等.一步法PCR联合荧光原位杂交检测曲霉菌属感染标本[J].中华医院感染学杂志,2012,22(10):2223⁃2226.
[13] 陈吉良,黄小龙,吴安迪,等.一种快速高效提取病原真菌DNA作为 PCR模板的方法[J].菌物学报,2011,30(1):147⁃149.
[14] Ezeronye OU,Okerentugba PO.Optimum conditions for yeast protoplast release and regeneration in Saccharomyces cerevisiae and Candida tropicalis using gut enzymes of the giant African snail Achatina achatina[J].Lett Appl Microbiol,2001,32(3):190⁃193.
[15] Alshahni MM,Makimura K,Yamada T,et al.Direct colony PCR of several medically important fungi using Ampdirect plus[J].Jpn J Infect Dis,2009,62(2):164⁃167.
[16] Petes TD,Botstein D.Simple Mendelian inheritance of the reiter⁃ated ribosomal DNA of yeast[J].Proc Natl Acad Sci USA,1977,74(11):5091⁃5095.
Study of improved colony PCR technologies for the identification of Trichosporon asahii
ZHANG De⁃quan1,2,LIU Han1,LIAO Yong1,XIA Zhi⁃kuan1,YANG Dong⁃qian1,YANG Yang1,LV Xue⁃lian1,YANG Rong⁃ya1
(1.The Military Institute of Injury and Reparation,General Hospital of Beijing Military Command of PLA,Beijing 100700,China;2.Hospital of General Political Department of PLA,Beijing 100120,China)
Objective To explore a direct colony PCR method for rapid identification of T.asahii.Methods Four methods inclu⁃ding direct colony,direct colony with centrifugation,enzymolysis,and improved enzymolysis method were used to preliminarily sample treatment.The sensitivity and the positive rate of colony PCR based on four methods for isolates of T.asahii were evaluated and com⁃pared with the PCR results of the traditional DNA extraction.Results The sensitivity of the improved enzymolysis method,direct col⁃ony method and the traditional DNA extraction were both 102CFU/mL,while the positive rates were 93.75%,75%and 50%,respec⁃tively.The direct colony with centrifugation presented the sensitivity of 104CFU/mL and the positive rate of 43.75%.The enzymolysis method presented total negative results in the detection of both sensitivity and positive rate.Conclusion The improved enzymolysis method which presented the advantages of high sensitivity and positive rate of trace samples,could be applied for the rapid identifica⁃tion of T.asahii.
Colony PCR;Trichosporon asahii;DNA preliminary extraction
R 379.9
A
1673⁃3827(2015)10⁃0006⁃05
2014⁃11⁃04
[本文编辑] 王 飞
国家自然科学基金(81471928,81271764,81301410)
张德全,男(汉族),硕士研究生在读,主治医师.E⁃mail:mycologist@qq.com
杨蓉娅,E⁃mail:yangrya@sina.com;吕雪莲,E⁃mail:myco⁃ses@gmail.com
