一氧化氮在打破杜梨种子休眠中的作用
2015-12-02宋要强屠荫华
宋要强,屠荫华,惠 伟
(1.陕西师范大学生命科学学院,陕西西安 710062;2.陕西化龙山国家级自然保护区管理局,陕西镇坪 725600;3.岐山县食品药品监督管理局,陕西岐山 722400)
杜梨(Pyrus betulaefolia Bunge)是蔷薇科棠梨属落叶乔木,是梨、苹果等嫁接繁殖的优良砧木;而且杜梨根系发达适应性强是荒山造林的先锋树种。但是杜梨种子成熟后有较长的休眠,采收后必须经过长时间的低温层积处理才能萌发,费时费力,损失严重。因此研究杜梨休眠有很高的理论价值和实用价值。关于打破杜梨种子休眠的研究比较少,只有几篇GA、ABA、6-BA参与杜梨休眠的报道,但是NO在杜梨种子休眠中的作用至今还未见报道。NO是植物体内存在的信号分子,调节着NO参与植物生长发育、种子萌发、气孔运动、细胞凋亡以及植物抗逆反应等生理过程[1~3]。最近研究发现NO在拟南芥[4]、温季牧草[5]、苹果[6]等植物种子的休眠解除中也起着非常重要的作用。
经过多年的研究,大家公认的植物体内NO合成途径有3条:(1)一氧化氮合成酶(NOS)的合成途径[7~9],(2)硝酸还原酶(NR)的生成途径[10,11],(3)非酶促反应生成途径[12]。
本研究以杜梨为实验材料,研究了NO在打破杜梨种子休眠中的作用,及杜梨种子萌发时内源一氧化氮的合成途径,为种子休眠的理论研究提供试验依据,同时为生产上打破休眠提供技术参考。
1 材料和方法
1.1 实验材料和仪器
购买2013年当年的杜梨(Pyrus betulifolia Bunge)种子,购入后于玻璃瓶内密闭,4℃低温保存。实验用硝普钠(sodium nitroprusside,SNP)、2-苯基-4,4,5,5-四甲基咪唑啉-1-氧-3-氧化物(PTIO)、NG-氮-L-精氨酸-甲酯(L-NAME)为美国sigma公司生产。氯化汞(HgCl2)和钨酸钠(Na2WO4)来自国内。
光照培养箱是上海悦丰仪器仪表有限公司生产的GC-250型微机光照培养箱。
1.2 种子处理
种子经过0.1%的HgCL2溶液消毒3 min、冲洗后,在20℃下蒸馏水中浸泡24 h,让实验种子吸水膨胀。浸泡后用浓度为1 mM,5 mM,10 mM,20 mM的外源NO供体SNP处理,以蒸馏水处理为对照,处理时间为24 h,温度20℃。为了检验NO的作用和NO的合成途径,进行了NO清除剂PTIO、NO合酶抑制剂L-NAME和硝酸还原酶抑制剂Na2WO4的处理,PTIO处理浓度为200μg·L-1,Na2WO4处理浓度为10 mM,L-NAME处理浓度为200 μM;处理时间24 h,处理在20℃的培养箱内进行。
1.3 种子培养
用培养皿滤纸法培养:培养皿直径90 mm。处理后倒出处理液,蒸馏水冲洗4次~5次,后均匀平铺在培养皿中培养,培养皿中铺一层滤纸,加5mL蒸馏水。每个培养皿30粒种子,每个处理3个重复。培养在光照培养箱内进行,温度20℃,光照周期为12 h光照和12 h黑暗。
1.4 发芽率的测定
开始发芽后每天固定时间对发芽率进行统计,胚根突破种皮为发芽。发芽率(%)=发芽个数÷30×100%。
2 结果与分析
2.1 不同浓度的SNP对杜梨种子休眠的影响
经24 h浸泡杜梨种子充分吸水膨胀后,用不同浓度的SNP处理种子的萌发情况见图1,从中可以看出SNP处理从1到20 mM都能提高杜梨种子萌发率,随着SNP浓度的增加,杜梨种子萌发率也随之增加,SNP浓度越高,萌发率越高。10 mM和20 mM SNP处理的种子14 d时萌发率分别达到56.7%和58.9%,是对照(20.0%)的2.8倍和2.9倍,差异极显著(P<0.01)。20 mM和10 mM差异不显著,但是20 mM的SNP处理抑制芽的伸长,甚至引起幼苗的死亡,因此10 mM SNP是打破杜梨种子休眠较合适浓度。

图1 不同浓度SNP对杜梨种子休眠的影响Fig.1 Effect of different concentrations of SNP on the dormancy of Pyrus betulifolia seeds
2.2 PTIO在打破杜梨种子休眠中的作用
为了验证NO在打破杜梨种子休眠中的作用,观察了NO清除剂PTIO处理种子的萌发实验,与SNP处理进行对比,结果如图2。经过SNP处理杜梨种子在培养过程中迅速萌发,萌发率有较大提高,并与对照有极显著差异。在生长上与对照相比,幼根明显伸长,子叶增大变绿。同样培养条件下,200 μM的NO清除剂PTIO处理使杜梨种子的萌发率始终低于对照,14 d时的萌发率仅有15.6%,与对照(21.1%)差异达到显著水平(P<0.05),说明打破杜梨种子休眠需要NO参与。经10 mM SNP和200 μM PTIO共同处理14 d时的发芽率只有35.6%,与10 mM SNP单独处理(55.7%)相比差异显著(P<0.05)。可见NO可以打破杜梨种子休眠,提高种子萌发率。
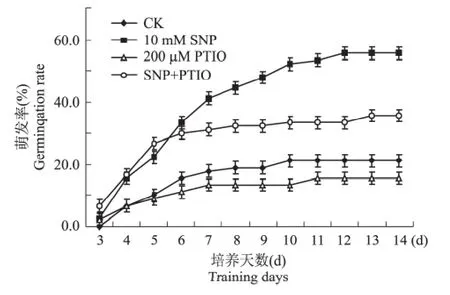
图2 PTIO对杜梨种子休眠的影响Fig.2 Effect of PTIO on the dormancy of Pyrus betulifolia Bunge seeds
2.3 参与打破杜梨种子休眠的NO合成途径
在植物体内NO的合成途径包括NO合酶(NOS)途径、硝酸还原酶(NR)途径以及非酶促途径。为了研究在打破杜梨种子休眠中,NOS途径和NR途径是否参与,用NOS抑制剂L-NAME和NR抑制剂Na2WO4处理杜梨种子,结果如图3。从图3可以看出经L-NAME单独处理14 d时杜梨的萌发率仅仅是15.6%,为对照(22.2%)的70%,差异达到显著水平(P<0.05),可见NOS途径参与杜梨种子休眠的打破。经Na2WO4单独处理的种子在培养过程中的萌发率和对照相近,至第14天时的萌发率是23.3%与对照(22.2%)没有显著差别。可见NR途径没有参与杜梨种子休眠的打破。
3 讨论

图3 L-NAME和NA2WO4对杜梨种子休眠的影响Fig.3 Effect of L-NAME and Na2WO4on the dormancy of Pyrus betulifolia seeds
不同物种之间种子的休眠情况差别很大,习惯上把萌发率大于80%作为种子休眠打破的标志,也有的人以50%的萌发率作为标准[13]。种子休眠的原因多种多样,杜梨种子休眠是因为种子没有完成后熟。NO是近年研究比较多的气态小分子,大量的研究表明NO作为信号分子在植物生长发育和胁迫反应中起着重要作用。NO打破种子休眠促进种子萌发的报道也不少,但这些研究主要集中在需光种子的休眠方面,如NO可以代替光照打破泡桐[14]、拟南芥[15]和莴苣[16]等种子的休眠促进萌发,这表明NO作为信号分子能够打破光敏色素调节的休眠。SNP处理对黄色羽叶豆种子的萌发也有明显的促进作用,羽叶豆种子既没有休眠也不是需光种子[17]。2006年Zhang等发现在小麦种子萌发的早期阶段NO可以迅速增加β-淀粉酶的活性从而促进小麦种子的萌发[18]。可以看出NO在种子休眠和萌发中的作用似乎具有普遍性。2007年Agnieszka Gniazdowska等发现NO可以打破去皮的苹果种子的休眠,促进它的萌发[6]。杜梨和苹果同属蔷薇科植物,亲缘关系比较近,NO在杜梨种子中是不是也有同样的效果?本实验的结果证实了这一猜想。
从图1可以看出,不同浓度的SNP处理都有打破杜梨种子休眠的效应,并且表现为浓度依赖性,浓度越高萌发率越高,比如10mM SNP处理14 d时的萌发率可以达到56.7%,而5 mM SNP处理14 d时萌发率只有41.1%。NO不是SNP唯一的水解产物,为了确定打破杜梨种子休眠中是否NO在起作用,我们进行了药理学实验(图2)。在SNP的处理中加入NO清除剂PTIO处理后,可以逆转SNP的作用,14 d后只有35.7%种子萌发,与SNP单独处理相比差异显著。PTIO可以维持杜梨种子休眠抑制萌发,经PTIO单独处理14 d时种子的发芽率只有15.7%,与对照(21.1%)也有明显的差异。从实验结果我们可以得出结论NO可以打破杜梨种子休眠。
植物中NO的产生途径研究已经进行了20多年,前人研究表明,植物体内NO来源可能有3个:NOS途径、NR途径和非酶促合成途径。Ninnemann和Maier(1996)第一次明确阐述了豆科植物可以通过 NOS途径合成 NO[19]。随后的研究证明玉米[20,21]、拟南芥[22,23]、烟草[24]等许多植物中都存在NOS途径和NR途径。但是植物通过哪条合成途径调控种子休眠至今未见报道,Caro和 Pun-tarulo在1999年曾观察到在大豆种子的 NOS活性随萌发进程深入而上升[25],这似乎暗示了在种子萌发过程中存在NOS合成途径。本实验中(图3)分别用200 μM的L-NAME和10mM的Na2WO4处理杜梨种子来研究NO通过哪条途径来调控种子休眠。图3表明L-NAME单独处理可以抑制杜梨种子萌发,14 d时种子的萌发率是15.7%,与对照(22.2%)差异显著。而Na2WO4处理效果不显著,14d时发芽率是23.3%与对照没有显著差异。结果证明在杜梨种子休眠打破时,NO的来源可能是通过NOS途径,而不是通过NR途径合成的。
由此可以得出结论:外源NO可以打破杜梨种子休眠,显著提高萌发率,其中10 mM是SNP处理的最佳浓度。在打破杜梨种子休眠中,NO合成有一氧化氮合酶(NOS)途径而没有硝酸还原酶(NR)途径参与。
[1]Wendehenne D,Durner J,Klessig DF.Nitric oxide:A new player in plant signalling and defence responses.Curr Opin Plant Biol,2004,7(4):449~455.
[2]Crawford NM,Guo FQ.New insights intonitric oxide metabolism and regulatory functions.Trends Plant Sci,2005,10(4):195~200.
[3]Lamotte O,Courtois C,Barnavon L,et al.Nitric oxide in plants:The biosynthesis and cell signalling properties of a fascinating molecule.Planta,2005,221(1):1~4
[4]Bethke P C,Badger M R,Jones R L.Apoplastic synthesis of nitric oxide by plant tissues[J].Plant Cell,2004,16(2):332~ 341.
[5]Gautam Sarath,Guichuan Hou,Lisa M.Baird.Reactive oxygen species,ABA and nitric oxide interactions on the germination of warm-season C4-grasses[J].Planta,2007,226:697~ 708.
[6]Agnieszka Gniazdowska,Urszula Dobrzyjska.Breaking the apple embryo dormancy by nitric oxide involves the stimulation of ethylene production[J].Planta,2007,225:1051~1057.
[7]Delledonne M,Xia YJ,Dixon RA,Lamb C.Nitric oxide functions as a signal in plant disease resistance[J].Nature,1998,394(6693):585~588.
[8]Durner J,Wendehenne D,Klessig D F.Defense gene induction in tobacco by nitric oxide,cyclic GMP,and cyclic ADP ribose[J].Proc NatlAcad Sci USA,1998,95:10328~10333.
[9]Ninnemann H,Maier J.Indication for the occurrence of nitric oxide synthase in fungi and plants and the involvement in photoconidiation of Neurospora crassa[J].Photo-chemistry and Photobiology,1996,64:93~398.
[10]Dean J,Harper J.Nitric-oxide and nitrous oxide production by soybean and winged bean during the in vivo nitrate reductase assay[J].Plant Physiol,1986,82(3):718~ 723.
[11]Klepper L.Nitric-oxide emissions from soybean leaves during in vivo nitrate reduc-tase assays[J].Plant Physiol,1987,85:96~99.
[12]Bethke PC,Badger MR,Jones RL.Apoplastic synthesis of nitric oxide by plant tissues[J].Plant Cell,2004,16(2):332~ 341.
[13]胡晋.种子生物学[M].高等教育出版社,2006,1:126~140.
[14]Grubisic D,Giba Z,Konjevic R.The effect of organic nitrates in phytochrome controlled germination of Paulownia tomentosa seeds[J].Photochem Photobiol,1992,56:629~632.
[15]Lindermayr C,Saalbach G,Bahnweg G,et al.Differential inhibition of Arabidopsis methionine adenosylt ransferases by protein Snit rosylation[J].Biol Chem,2006,281(7):4285~ 4291.
[16]C.Nicolás,G.Nicolás,D.Rodríguez,Antagonistics effects of ABA and gibberellic acid on the breaking of dormancy of Fagus sylvatica,Physiol[J].Plant,1996,96:244~250.
[17]Krystyna Oracz1,et al.Release of sunflower seed dormancy by cyanide:cross-talk with ethylene signalling pathway[J].Journal of Experimental Botany,2008,59(8):2241~2251.
[18]Crawford NM,Guo FQ.New in sights into nitric oxide metabolism and regulatory functions[J].Trends Plant Sci,2005,10(4):195~200.
[19]Ninnemann H,Maier J.Indication for the occurrence of nitric oxide synthase in fungi and plants and the involvement in photo conidiation of Neurospora crassa[J].Photochemistry Photobiology,1996,64(2):393~398.
[20]Ribeiro E A,Cunha F Q,Tamashiro W,Martins I S.Growth phase-dependent subcellu-lar localization of nitric oxide synthase in maize cells[J].FEBS Letters,1999,445(2~ 3):283~ 286.
[21]Leubner-Metzger G,Petruzzelli L,Waldvogel R,V?geli-Lange R,MeinsF.Ethylene responsive elementbinding protein(EREBP)expression and the transcriptional regulation of class I b-1,3-glucanase during tobacco seed germination[J].Plant Mol Biol,1998,38:785~795.
[22]Guo FQ,Okamoto M,Crawford NM.Identification of a plant nitric oxide synthase gene involved in hormonal signaling[J].Sence,2003,302(5642):100~103.
[23]Tun NN,et al.Polyamines induce rapibiosynthesis of nitric oxide(NO)in Athaliana seedlings[J].Plant and Cell Physiology,2006,47(3):346~354.
[24]Chandok MR,et al.The pathogen-inducible nitric oxide synthase(iNOS)in plants is a variant of the P protein of the glycine decarboxylase complex[J].Cell,2003,113(4):469~ 482.
[25]A.P.Calvo,C.Nicolás,O.Lorenzo,G.Nicolás,D.Rodríguez,Evidence for positive regulation by gibberellins and ethylene of ACC oxidase expression and activity during transition from dormancy to germination in Fagus sylvatica L.seeds[J].Plant Growth Reg,2004,23:44~53.
